过表达脑红蛋白通过激活PI3K/Akt信号通路防治AD的体外研究*
2014-07-18戴颂阳
杨 军, 戴颂阳, 向 月, 张 雄
(重庆医科大学神经科学研究中心,重庆市神经生物学重点实验室,重庆 400016)
过表达脑红蛋白通过激活PI3K/Akt信号通路防治AD的体外研究*
杨 军, 戴颂阳, 向 月, 张 雄△
(重庆医科大学神经科学研究中心,重庆市神经生物学重点实验室,重庆 400016)
目的: 探索过表达脑红蛋白(neuroglobin,NGB)对转染了pAPPswe的SH-SY5Y细胞的神经保护作用及机制。方法: 成功构建过表达NGB的质粒pEGFP-NGB并转染入已预先转染了pAPPswe的SH-SY5Y细胞,MTT法检测过表达NGB对该细胞存活率的影响;JC-1法检测其对细胞线粒体膜电位的影响;流式细胞术检测过表达NGB对细胞凋亡的影响;Western blotting法检测其对细胞中p-Akt、 Akt和caspase-3/9表达的影响;ELISA法检测其对细胞内Aβ42生成的影响。结果: MTT结果显示,与对照组和空质粒组比较,转染NGB后,pAPPswe-SH-SY5Y细胞的存活率明显提高,差异有统计学意义(P<0.05)。JC-1染色结果显示过表达NGB能够明显抑制转染pAPPswe对SH-SY5Y细胞线粒体膜电位的降低作用(P<0.05)。流式细胞术结果显示过表达NGB能够抑制早、晚期细胞的凋亡。而Western blotting显示过表达NGB不仅能抑制细胞内caspase-3和caspase-9蛋白水平的表达,而且还能够促进细胞内p-Akt蛋白的表达,而这种促进作用能够被PI3K/Akt的抑制剂LY294002所抑制。ELISA结果显示过表达NGB能够明显抑制细胞内Aβ42的生成。结论: 过表达NGB能够显著抑制pAPPswe诱导的细胞损伤,而且还抑制与细胞凋亡密切相关的caspase-3和caspase-9等蛋白表达。NGB的神经保护作用可能是通过激活PI3K/Akt信号通路来实现的。
脑红蛋白; SH-SY5Y细胞; 细胞凋亡; Caspase-3/9; PI3K/Akt信号通路
众所周知,神经元的丢失是阿尔茨海默病(Alzheimer disease,AD)的主要的病理特征之一,而神经元丢失的主要表现为神经元的凋亡[1]。尽管,AD中神经元凋亡的机制仍旧不清,但多数学者认为β淀粉样蛋白(β-amyloid protein, Aβ)在脑组织中的积聚是各种原因诱发AD的共同通路,也是诱发神经元凋亡并导致AD认知功能障碍关键因素[2]。因此,如何抑制Aβ的产生以及降低Aβ诱导的神经元的凋亡可能成为防治AD的重要策略[3]。脑红蛋白(neuroglobin,NGB)是一种广泛存在于脑内的新型携氧球蛋白,由德国科学家Burmester等[4]于2000年发现。该蛋白具有广泛的内源性脑保护功能:不仅对由于缺血、缺氧引起的脑损伤有保护功能(如脑卒中)[5],而且对非缺血缺氧性的脑损伤也有保护功能(如神经系统变性疾病AD)[6]。但具体的保护调控机制目前尚不清楚。本实验以pAPPswe转染SH-SY5Y细胞建立AD模型,观察过表达NGB对细胞的神经保护作用,并探讨其分子调控机制,为治疗AD提供理论依据。
材 料 和 方 法
1 细胞及质粒
神经母细胞瘤SH-SY5Y细胞由重庆医科大学病理生理教研室汤为学教授惠赠;pAPPswe质粒由重庆医科大学附属儿童医院宋伟宏教授惠赠;pEGFP-NGB质粒以及空质粒均由上海吉凯公司提供。NGB基因片段序列为:5’-TCC GCT CGA GCT ATG GAG CGC CCG GAG CCC GA-3’; 5’-ATC GGG ATC CTT ACT CGC CAT CCC AGC CTC GA-3’。
2 主要试剂
DMEM高糖培养基、胎牛血清和胰蛋白酶购自HyClone;JC-1线粒体膜电位检测试剂盒、MTT和SDS-PAGE凝胶配置试剂盒和青霉素-链霉素双抗购自碧云天生物技术研究所;PRO-PREPTM蛋白提取液购自北京赛百盛基因技术有限公司;PVDF膜购自Millipore;PageRulerTMPrestained Protein Ladder购自 Fermentas;多克隆兔抗人caspase-3和caspase-9抗体购自Bioworld;单克隆兔抗人Akt和p-Akt抗体和HRP标记的山羊抗兔IgG均购自北京博奥森生物技术有限公司;Lipo2000购自Invitrogen;ECL发光试剂盒购自Bio-Rad;免疫组化试剂盒购自北京康为世纪生物技术有限公司;ELISA试剂盒购自Biosourse。
3 主要实验方法
3.1 细胞培养 将冻存的SH-SY5Y细胞37 ℃复苏至培养瓶中,用含10%胎牛血清、1%青链霉素的DMEM培养液,置37 ℃、5% CO2的培养箱中培养。
3.2 pEGFP-NGB细胞转染 当已经转染了pAPPswe的SH-SY5Y细胞单层融合率达85%以上时,弃培养液,取8 μg 质粒pEGFP-NGB加入0.75 mL无抗生素无血清的DMEM培养液中混匀;取30 μL Lipo2000加入0.75 mL无抗生素无血清的DMEM培养液中混匀,室温静置5 min;再将两管液体轻混,室温静置20 min后加入含7.5 mL无抗生素无血清的DMEM培养液中,继续培养6~8 h后,更换正常细胞所需DMEM培养液,继续孵育24 h[7]。
3.3 MTT法检测细胞存活率 将SH-SY5Y细胞稀释至1×107/L,然后按每孔500 μL体积的细胞悬液接种于96孔板中,分为对照组(已转染pAPPswe)、转染空质粒组(vector组)及转染pEGFP-NGB组(pNGB组)。待细胞贴壁24 h后,向各孔中分别加入50 μL MTT,于37 ℃培养箱中温育4 h。弃去各孔中的DMEM培养基和MTT,在所有孔中各加入200 μL DMSO,振荡混匀后,用酶标仪在490 nm波长处检测其吸光度(A490)。按下式计算细胞存活率。
细胞存活率(%)= 实验组A490值/对照组A490值×100%。
3.4 线粒体膜电位的检测 采用JC-1法。实验分组同MTT法,加入JC-1染料共同孵育30 min,PBS洗涤细胞3次,收集细胞,采用ND-1000荧光分光光度计检测JC-1单体时,激发光设置为490 nm,发射光设置为530 nm;检测JC-1聚合物时,激发光设置为525 nm,发射光设置为590 nm,激发波长为485 nm。所有的数值均以590 nm处(红光)的吸光度/530 nm处(绿光)的吸光度表示,即用红绿荧光的比值来衡量线粒体去极化的比例。
3.5 流式细胞仪检测 1×107/L的转染pAPPswe的SH-SY5Y细胞接种于6孔板,经过不同处理后,用预冷的PBS液冲洗细胞2遍,加入Annexin V-FITC和PI的混合液,置于室温、避光环境下孵育15 min,最后用流式细胞仪检测。
3.6 Western blotting 分别收集对照组、空质粒转染组、pNGB组以及pNGB+LY294002组的细胞,加入100 μL蛋白裂解液,-20 ℃放置20 min,13 000 r/min离心5 min,收集上清,Bradford法检测蛋白浓度。8%~12%的SDS-PAGE分离后,转移至PVDF膜上,以含0.5 g/L脱脂奶粉TBST液室温封闭1 h,加入兔抗人caspase-3(1∶250)、caspase-9抗体(1∶ 250)、Akt(1∶500)、p-Akt(1∶500)和β-actin抗体(1∶ 5 000),4 ℃孵育过夜;用TBST洗涤3次,加入HRP标记的羊抗兔IgG(1∶5 000),室温孵育2 h,ECL法显影,并用凝胶化学成像分析仪记录其灰度值。
3.7 ELISA法检测Aβ42的生成 按照说明书收集各组细胞培养液1 mL,加入20 μL 广谱蛋白酶抑制剂Protease Inhibitor Cocktail Set Ⅰ,至终浓度为1 mmol/L,分装保存于-20 ℃。取出已包被的96孔板,加入标准品和待测样品每孔各50 μL(每个样品设置5个复孔),立刻加入50 μL detection antibody同时设空白对照组,橡皮膏条封存,置室温3 h。洗涤4遍后,甩掉板中液体后向每孔加入100 μL anti-rabbit IgG-HRP工作液, 橡皮膏条封存,置室温30 min;再洗板4遍,甩掉板中液体,每孔加入100 μL stabilized chromogen, 液体变蓝,橡皮膏条封存,置室温避光30 min;然后每孔加入100 μL stop solution,终止显色,此时蓝色转为黄色;最后用酶标仪在450 nm波长下读取吸光度(A)值,然后根据标准曲线计算出Aβ42的浓度。
4 统计学处理
数据以均数±标准差(mean±SD)表示,应用SPSS 15.0统计学软件对数据进行正态检验及方差齐性检验,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验分析,以P<0.05为差异有统计学意义。
结 果
1 过表达NGB提高转染pAPPswe的SH-SY5Y细胞的存活率
MTT检测结果显示,对照组(转染pAPPswe的SH-SY5Y细胞)的存活率为0.687±0.098,空质粒转染组的存活率为0.704±0.053,与对照组比较,差异无统计学意义(P>0.05);而pNGB组细胞的存活率为0.883±0.074,与对照组比较差异有统计学意义(P<0.01),见图1。
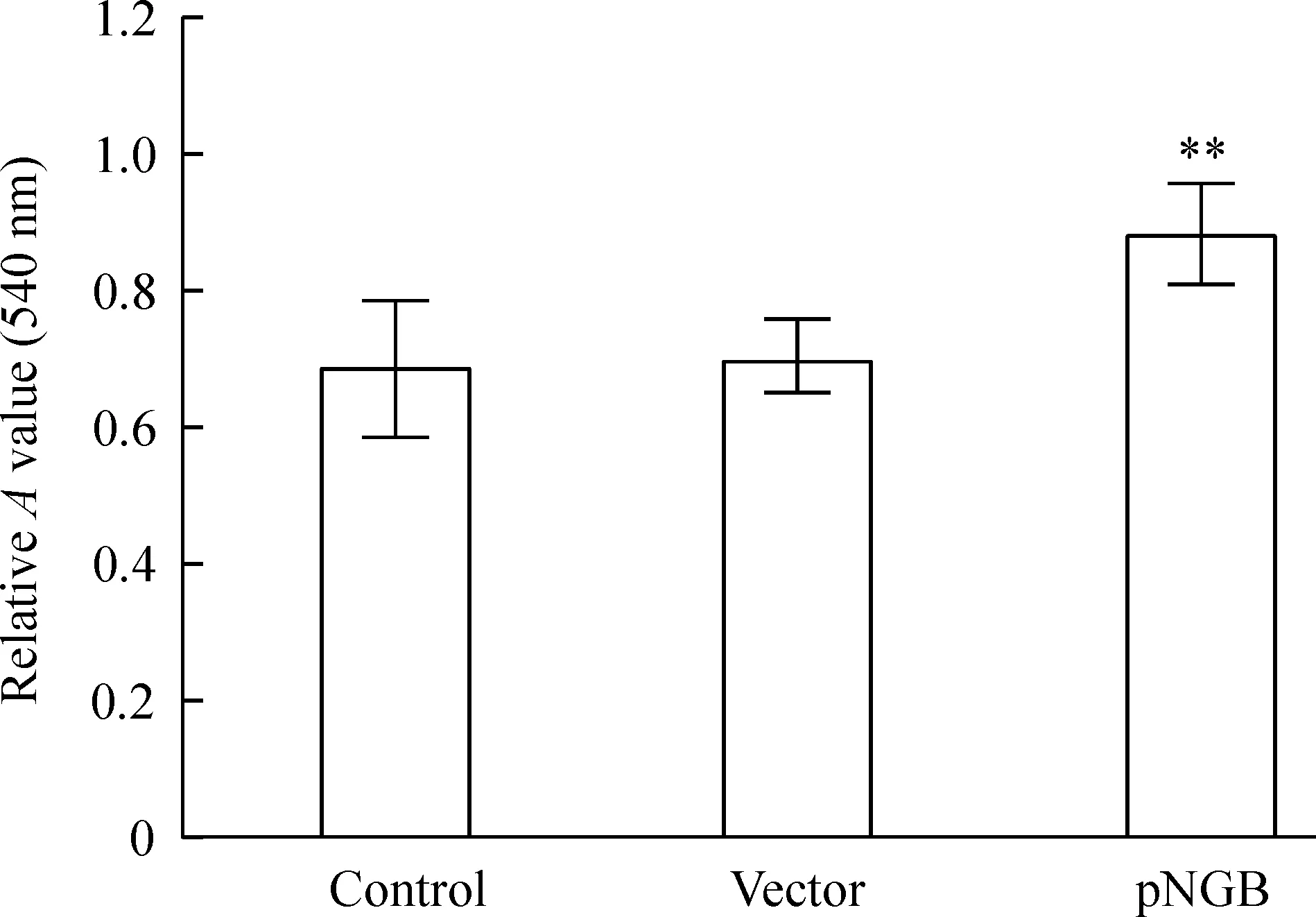
Figure 1.The effect of NGB over-expression on the survival of SH-SY5Y cells transfected with pAPPswe. Mean±SD.n=6.**P<0.01vscontrol or vector.
图1 过表达NGB对转染pAPPswe的SH-SY5Y细胞存活率的影响
2 过表达NGB提高转染pAPPswe的SH-SY5Y细胞的线粒体膜电位
线粒体膜电位的降低通常被认为是细胞凋亡的早期现象。本实验JC-1法检测结果显示,对照组细胞红绿荧光的比值为(50.7±3.5)%,空质粒组红绿荧光的比值为(52.4±4.2)%,2组比较无显著差异;转染pNGB后,过表达的NGB使细胞线粒体膜电位显著提高,其红绿荧光的比值为(76.5±5.9)%,与对照组和空质粒组比较,差异有统计学意义(P<0.01),见图2。
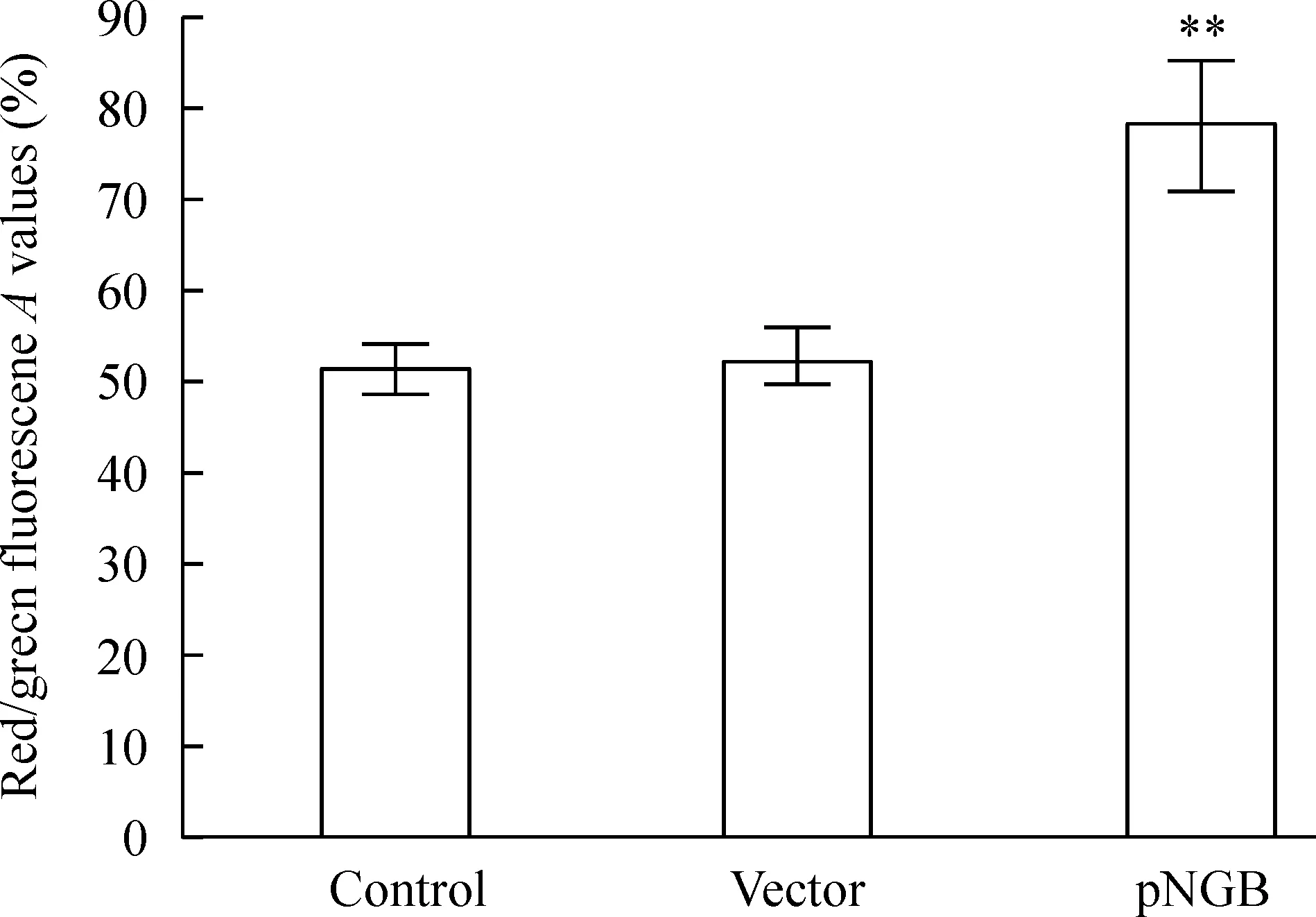
Figure 2.The effect of NGB over-expression on the mitochondrial membrane potential in pAPPswe-transfected SH-SY5Y cells. Mean±SD.n=4.**P<0.01vscontrol or vector.
图2 过表达NGB对转染pAPPswe的SH-SY5Y细胞内线粒体膜电位的影响
3 过表达NGB减少转染pAPPswe的SH-SY5Y细胞的凋亡
流式细胞术结果显示,对照组细胞早期凋亡率为(0.78±0.27)%,空质粒转染组为(0.93±0.33)%,两者比较差异没有统计学意义(P>0.05),而转染pNGB组细胞早期凋亡率为(0.24±0.11)%,与上述2组比较,差异有统计学意义(P<0.01)。而3组细胞的晚期凋亡率分别为(4.43±1.50)%、(4.04±0.59)%和(2.53±1.03)%,pNGB组与其它2组比较,差异也有统计学意义(P<0.01),见图3。
4 过表达NGB通过激活PI3K/Akt通路抑制转染pAPPswe的SH-SY5Y细胞内caspase-3和caspase-9蛋白的表达
Western blotting检测结果显示,与对照组和空质粒转染组比较,pNGB组细胞内的caspase-3和caspase-9蛋白水平明显降低,差异有统计学意义(P<0.01);p-Akt的表达水平则明显增高(P<0.01);而Akt的表达没有显著变化(P>0.05)。在使用PI3K/Akt特异性抑制剂LY294002处理后,细胞内的caspase-3和caspase-9蛋白水平明显增高,而p-Akt蛋白表达水平却降低,与pNGB转染组比较,差异有统计学意义(P<0.01),见图4。

Figure 3.The effect of NGB over-expression on the apoptosis of pAPPswe-transfected SH-SY5Y cells detected by flow cytometric analysis.
图3 过表达NGB对转染pAPPswe的SH-SY5Y细胞凋亡的影响
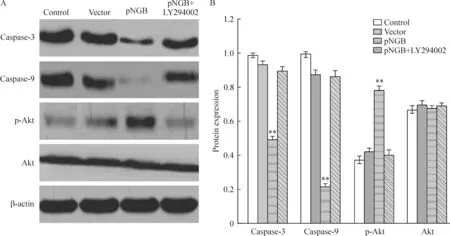
Figure 4.Effects of NGB over-expression on the protein levels of caspase-3, caspase-9, Akt and p-Akt in pAPPswe-transfected SH-SY5Y cells.A: the protein levels of caspase-3, caspase-9, Akt and p-Akt determined by Western blotting; B: the quantitative analysis of relativeAvalues of caspase-3, caspase-9, Akt and p-Akt.Mean±SD.n=4.**P<0.01vscontrol or pNGB+LY 294002.
图4 过表达NGB对转染pAPPswe的SH-SY5Y细胞内caspase-3、caspase-9、Akt和p-Akt蛋白水平的影响
5 过表达NGB明显降低Aβ42生成
在正常的情况下或者肿瘤细胞内,我们极少可以检测到Aβ42。而如图5显示,在SH-SY5Y细胞转染pAPPswe后,我们可以检测到Aβ42的生成量约为(34.1±3.5) ng/L,这表明AD的细胞模型成功建立,进而可以进行后续实验。在转染空质粒后,Aβ42的生成量约为(33.5±4.7) ng/L,与对照组比较,两者没有显著差异(P>0.05)。成功转染NGB后,过表达的NGB可明显降低Aβ42的生成,生成约为(21.3±2.5) ng/L,与对照组和空质粒组比较,差异有统计学意义(P<0.01)。
讨 论
人神经母细胞瘤细胞株SH-SY5Y是一种具有低分化的肿瘤细胞。由于其增殖速度快,在形态上,生理和生化等功能上与人正常的神经细胞相似,因此已作为一种经典的体外实验模型被广泛用于神经系统疾病的发病机制[8]和药物治疗、预防机制[9]等的研究中。而在课题组前期的研究中[7],我们利用pAPPswe转染SH-SY5Y细胞产生了可检测到的Aβ,为探讨curcumin抑制Aβ治疗AD的潜在机制研究提供了可靠的AD的细胞模型。因此,本实验仍然利用pAPPswe转染SH-SY5Y细胞建立AD的细胞模型。本研究中,pAPPswe转染SH-SY5Y细胞后,淀粉样蛋白前体(amyloid protein precursor, APP)的活性增强,促进了APP的裂解,不仅产生了可以被检测到的Aβ42,而且也导致了细胞存活率的降低,线粒体膜电位也降低,细胞凋亡甚至导致细胞的死亡。这些都表明模型是建立成功的。在转染NGB后,SH-SY5Y细胞过表达NGB能够显著提高细胞的存活率,恢复了线粒体膜电位的水平并且降低细胞的凋亡率,而且还降低了细胞上清中Aβ42的含量,这些都表明NGB对SH-SY5Y细胞具有神经保护作用。
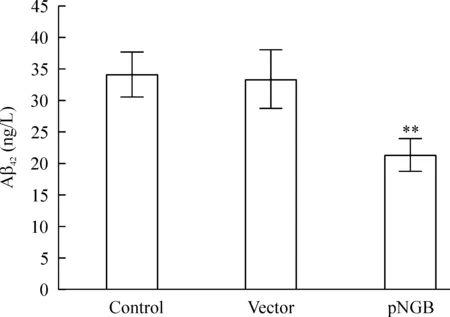
Figure 5.Over-expression of NGB significantly decreased the generation of Aβ42.Mean±SD.n=5.**P<0.01vscontrol or vector.
图5 过表达NGB明显降低Aβ42生成
众所周知,凋亡的过程主要分为以下几个阶段:接受凋亡信号、凋亡调控分子间的相互作用、蛋白水解酶的活化、后进入连续反应过程。其中,caspases是特异性凋亡信号转导分子,其激活被是凋亡发生机制中最关键的环节之一。Caspases家族成员众多,其中caspase-8/9/10是凋亡的启动子,而caspase-3/6/7为凋亡的执行者。研究已经证实,caspase与AD密切相关。Li等[10]研究发现,Aβ在引起星形胶质细胞和小脑颗粒细胞凋亡的过程中, caspases-2、3、6活性增加,三者各自的抑制剂对Aβ诱导的凋亡起到明显的保护作用,表明多种caspases参与了Aβ诱导的凋亡。Francois等[11]的研究证明,APP存在3个caspase-3的剪切位点:(P4)DNVD197(P1)/S、(P4) DYAD219(P1)/G和(P4)VEVD720(P1)/A。APP被caspases剪切后的胞内羧肽片段C31参与Aβ诱导的凋亡。而Aβ诱导的凋亡又促进caspases的激活和APP的裂解。Raina等[12]也发现在AD大脑皮层和海马神经元中caspase-3的活性与βAPP的断裂,Aβ的升高及老年斑的形成是一致的。Caspases对βAPP的剪切破坏了细胞内APP的正常代谢过程,向着生成Aβ的方向进行,引起更多的Aβ生成和沉积,Aβ介导的毒性又促进caspases对APP的裂解,从而形成恶性循环。因此,我们推测过表达NGB降低Aβ42的生产以及降低Aβ诱导的细胞损伤的机制可能是通过抑制caspases的活性实现的。本实验结果表明,过表达NGB能够明显降低与凋亡密切相关的caspase-3和caspase-9蛋白水平的表达,这进一步证实了线粒体凋亡途径直接参与了Aβ诱导的凋亡过程,在AD的发生发展过程中发挥了重要作用,而NGB发挥其神经保护作用与抑制caspase-3和caspase-9的活性进而抑制凋亡的发生并且降低Aβ42的生成形成的良性循环有关。
研究发现caspase-9是PI3K/Akt信号通路下游的靶基因[13],应用高浓度的PI3K抑制剂后会阻断Akt的磷酸化,从而增强caspase-9蛋白的磷酸化,促进其下游分子引起的一系列串联反应而加快凋亡进程,而抑制神经干细胞的存活[14]。新近的研究发现,NGB是PI3K/Akt信号通路的诱导剂[15]。因此我们认为,NGB有可能是通过激活PI3K/Akt信号通路,进而抑制下游靶基因caspases的活性而抑制神经元的凋亡,从而保护神经元。在本实验中,我们发现过表达NGB能够降低caspase-3和caspase-9的蛋白水平表达,并且增加Akt磷酸化水平,而这种作用可以被PI3K/Akt信号通路的特异性抑制剂LY294002所拮抗,这说明PI3K/Akt通路参与了NGB抑制caspase-3和caspase-9的活性,促进细胞的生长等过程。
综上所述,过表达NGB不仅能够减少Aβ的生成,而且还能够削弱Aβ诱导的细胞损伤,而其机制可能是通过激活PI3K/Akt信号通路进而抑制与细胞凋亡密切相关的caspase-3、caspase-9等活性,这将为防治AD提供新的思路。
[1] Yuan JY, Yanker BA. Apoptosis in the nervous system [J]. Nature, 2000, 407(6805): 802-809.
[2] Golde TE, Dickson D, Hutton M. Filling the gaps in the Aβ cascade hypothesis of Alzheimer’s disease[J]. Curr Alzheimer Res, 2006, 3(5):421-430.
[3] Galimberti D, Scarpini E. Alzheimer’s disease: from pathogenesis to disease-modifying approaches[J]. CNS Neurol Disord Drug Targets, 2011, 10(2): 163-174.
[4] Burmester T, Weich B, Reinhardt S, et al. A vertebrate globin expressed in the brain[J]. Nature, 2000, 407(6803):520-523.
[5] 刘永年, 俞科贤, 马祁生, 等. 间歇性低氧缺血预处理对大鼠全脑缺血/再灌注海马CA1区Ngb和Bcl-2蛋白表达的影响[J]. 中国病理生理杂志, 2013, 29(12):2240-2244.
[6] Sun F, Mao X, Xie L, et al. Neuroglobin protein is upregulated in Alzheimer’s disease[J]. J Alzheimers Dis, 2013, 36(4):659-663.
[7] Zhang X, Yin WK, Shi XD, et al. Curcumin activates Wnt/β-catenin signaling pathway through inhibiting the activity of GSK-3β in APPswe transfected SY5Y cells[J]. Eur J Pharm Sci, 2011, 42(5):540-546.
[8] Asci R, Vallefuoco F, Andolfo I, et al. Transferrin receptor 2 gene regulation by microRNA 221 in SH-SY5Y cells treated with MPP+as Parkinson’s disease cellular model[J]. Neurosci Res, 2013, 77(3):121-127.
[9] Ye X, Tai W, Bao X, et al. FLZ inhibited γ-secretase selecitively and decreased Aβ mitochondrial production in APP-SH-SY5Y cells[J]. Naunyn Schmiedebergs Arch Pharmacol, 2013, 387(1):75-85.
[10] Li C, Zhao R, Gao K, et al. Astrocytes: implication for neuroinflammatory pathogenesis of Alzheimer’s disease[J]. Curr Alzheimer Res, 2011, 80(1): 67-80.
[11]Gervais FG, Xu D, Robertson GS, et al. Involvement of caspases inproteolytic cleavage of Alzheimer’s amyloid-βprecursor protein and amyloidogenin Aβ peptide formation[J]. Cell, 1999, 97(3):395-406.
[12]Raina AK, Hochman A, Zhu X, et al. Abortive apoptosis in Alzheimer’s disease [J]. Acta Neumpathol, 2001, 101(4):305-310.
[13]Redlak MJ, Miller TA. Targeting PI3K/Akt/HSP90 signaling sensitizes gastric cancer cells to deoxycholate-induced apoptosis[J]. Dig Dis Sci, 2011, 56(2): 323-329.
[14]Yanagisawa M, Yu RK. O-linked beta-N-acetylglucosaminylation in mouse embryonic neural precursor cells[J]. J Nuerosci Res, 2009, 87(16): 3535-3545.
[15]Antao ST, Duang TT, Aran R, et al. Neuroglobin overexpression in cultured human neuronal cells protects against hydrogen peroxide insult via activating phosphoinositide-3 kinase and opening the mitochondrial KATPchannel [J]. Antioxid Redox Signal, 2010, 13(6):769-781.
Prevention and treatment of AD by over-expression of neuroglobin via activating PI3K/Akt signaling pathway
YANG Jun, DAI Song-yang, XIANG Yue, ZHANG Xiong
(InstituteofNeuroscience,ChongqingMedicalUniversity,ChongqingKeyLaboratoryofNeurobiology,Chongqing400016,China.E-mail:zhangxiong_0@aliyun.com)
AIM: To study the neuroprotective roles of neuroglobin (NGB) over-expression in the SH-SY5Y cells transfected with pAPPswe.METHODS: The plasmid pEGFP-NGB was successfully constructed and transfected into the SH-SY5Y cells, which were pretreated with pAPPswe. MTT assay was applied to detect the effect of NGB over-expression on the cell survival rates. JC-1 staining was used to detect the level of mitochondrial transmembrane potential. The cell apoptosis was analyzed by flow cytometry. The effects of NGB over-expression on the protein level of p-Akt, Akt and caspase-3/9 were determined by Western blotting. The generation of Aβ42in the cells was measured by ELISA.RESULTS: The cell survival rate was remarkably increased after transfection with NGB compared with control group and empty plasmid group (P<0.05). The over-expression of NGB significantly inhibited the decrease in mitochondrial membrane potential induced by pAPPswe. The over-expression of NGB inhibited the apoptosis of the cells. Furthermore, over-expression of NGB not only inhibited the expression of caspase-3 and caspase-9, but also induced the production of p-Akt, which was prevented by LY294002, an inhibitor of PI3K/Akt. The generation of Aβ42was inhibited in the cells with the over-expression of NGB. CONCLUSION: Over-expression of NGB significantly inhibits the SH-SY5Y cell injuries induced by pAPPswe and inhibits the expression of caspase-3/9, which is tightly related with cell apoptosis. Furthermore, the neuroprotective roles of NGB may be via activating PI3K/Akt signaling pathway.
Neuroglobin; SH-SY5Y cells; Apoptosis; Caspase-3/9; PI3K/Akt signaling pathway
1000- 4718(2014)12- 2166- 06
2014- 07- 18
2014- 09- 16
国家青年科学基金资助项目 (No. 81100948)
R363; R749.1+6
A
10.3969/j.issn.1000- 4718.2014.12.009
△通讯作者 Tel: 023-68485898; E-mail: zhangxiong_0@aliyun.com
