新疆某三甲医院肝癌住院患者的营养风险状况调查
2014-07-17张瑞丽古丽比也沙比尔王文然包永星
马 静, 肖 蕾, 张 华, 张瑞丽, 刘 畅, 古丽比也·沙比尔, 王文然, 包永星
(新疆医科大学第一附属医院, 乌鲁木齐 830054)
大量的研究表明,肿瘤患者的营养代谢相对于健康人具有一定的特异性,肿瘤患者的代谢具有高代谢、蛋白分解加速、脂肪动员、糖代谢紊乱等多种代谢紊乱特征,初诊时的营养状况也成为患者预后的独立危险因素之一[1]。在肿瘤不断发生发展的过程中,约有50%的患者存在营养不良和营养风险,90%以上的终末期肿瘤患者存在营养不良和营养风险,需要进行正规的评估和干预[2-3]。进行正规营养干预患者的预后要优于不进行营养干预的患者[4]。
原发性肝癌是危害新疆各民族健康的重大疾病[5-6],新疆是多民族聚集地区,肝癌也是新疆地区的常见恶性肿瘤之一,但是对新疆肝癌患者的营养状况调查和评价报道较少。为进一步了解新疆肝癌患者的营养状况,本研究采用中华医学会CSPEN指南NRS 2002(2008版)对入住于新疆医科大学第一附属医院的286例肝癌患者进行营养筛查,现报道如下。
1 对象与方法
1.1临床资料选择2010年1-12月新疆医科大学第一附属医院确诊的肝癌患者286例,其中男性230例,女性56例,男女比例4.2∶1.0,年龄25~87 岁,中位年龄60 岁。均经中国抗癌协会肝癌专业委员会2001年制定的原发性肝癌的临床诊断与分期标准,肝癌分期采用AJCC/UICC的TNM分期标准。纳入标准:入院前经过相关检查并且经过新疆医科大学第一附属医院腹部肿瘤专家讨论明确诊断为原发性肝癌的患者;住院1 d以上;经过知情同意和医院伦理委员会批准,同意进行调查者。排除标准:入院期间诊断不明的;无严重胃肠道疾病、严重心脑血管疾病、内分泌代谢性疾病;在调查期间重复入院;不同意进行调查及无法沟通的患者。
1.2方法由专业调查人员对所有调查对象在入院24 h内 NRS2002量表进行筛查。调查对象晨起排二便后,免鞋测定身高、体质量。体质量测定校正至±0.2 kg,身高标尺校正至±0.5 cm。
NRS2002营养风险筛查的核心问题包括:(1)原发疾病对营养状态影响的严重程度;(2)近期(1~3个月)体质量变化;(3)近1 w食物摄入量变化;(4)体质指数(bodu mass index, BMI);(5)年龄>70岁,营养风险加1分。BMI的评定标准采用中国陈春明标准, BMI<18.5 kg/m2者结合一般状况差可判定为营养不良,对于因无法站立或严重胸腹水而无法得到准确BMI者,如无明显肝肾功能异常,在入院第2天检测血清白蛋白作为替代指标,血清白蛋白<30 g/L者营养状况评分为3分。
营养风险具体筛查方法根据中华医学会CSPEN指南NRS 2002(2008版),第一步进行首次营养筛查:初筛项目包括:BMI(体质指数)<18.5 kg/m2;过去3个月体质量是否下降;过去1 w内食物摄入量是否减少;患者有无严重疾病(如ICU治疗),若其中任何一个问题结果为“是”,则直接进入第二步营养监测,如果所有问题的回答均为“否”,则每周重复调查1次。第二步为最终筛查项目,其结果分为疾病严重程度、营养状态评分及年龄因素评分3项评分之和(表1)。总评分≥3分提示存在营养风险,需结合个体情况进行营养支持;评分<3分暂不进行临床营养支持,但需定时复查。
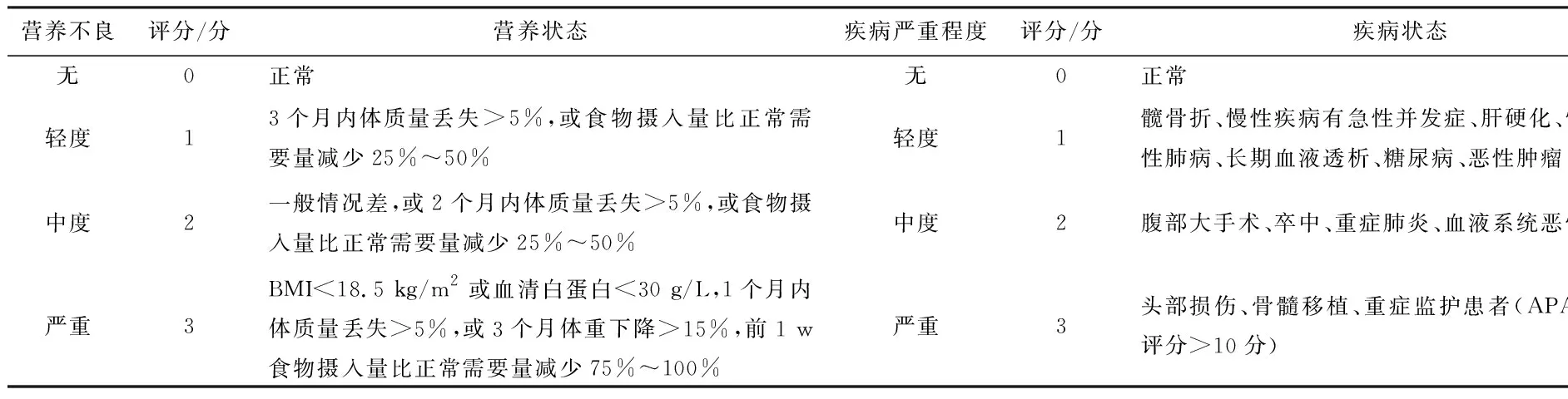
表1 NRS2002最终筛查表
注:年龄≥70岁,营养风险评分加1分。APACHE Ⅱ评分:急性生理学及慢性健康状况评分。
1.3统计学处理筛查表复核后,采用双录入法将资料录入EXCEL数据库,采用SPSS17.0软件包进行统计学分析,计量资料以均数±标准差(-x±s)表示,采用方差分析和t检验,计数资料采用四格表卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1营养风险发生率调查结果286例肝癌患者中,有营养风险发生率为60.84%(174/286),无营养风险发生率为39.16%(112/286),有营养风险患者中男性148例,女性26 例,男女比例为5.69∶1,中位年龄56岁。无营养风险患者中男性82 例,女性30 例,男女比例为2.73∶1,中位年龄62岁。
2.2营养风险与临床分期的关系无营养风险患者中Ⅰ期患者占14.28%(16/112),Ⅱ期患者18.75%(21/112),Ⅲ期患者占16.07%(18/112), Ⅳ期患者50.89%(57/112)。有营养风险患者中Ⅰ期患者占21.26%(37/174),Ⅱ期患者占13.79%(24/174),Ⅲ期患者占22.41%(39/174),Ⅳ期患者占43.53%(74/174)。有无营养风险与肿瘤分期无明显相关性(χ2=5.271,P=0.153)。
2.3营养风险与住院天数和费用的关系不同临床分期的肝癌患者中,有营养风险患者的住院天数和住院费用总体上高于无营养风险患者(P<0.05),见表2。
2.4营养风险和病死率的关系截止2013年3月31日,286例肝癌患者总体病死率为62.23%(178/286),有营养风险患者的病死率为68.02%(118/174),无营养风险患者病死率为53.57%(60/112),两者病死率差异有统计学意义(χ2=5.883,P<0.05)。
2.5随访及转归中位随访时间31个月,失访9例,随访率为96.85%。生存99例,死亡178例。死亡患者中男性146例,女性32例,男女比例为4.5∶1。死亡原因:上消化道出血79 例(44.38%),肝功能衰竭57例(32.02%),自发性腹膜炎26例(14.61%),肝性脑病 8例(4.49%),其他8 例(4.49%)。
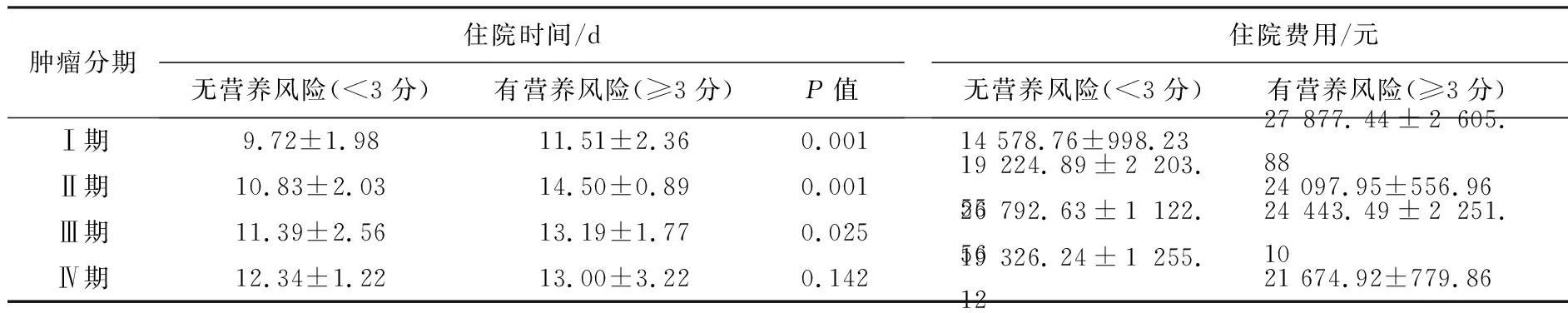
表2 不同分期肝癌住院患者营养风险与住院天数和费用关系
3 讨论
目前关于恶性肿瘤的营养状况的评价方法,包括预后营养指数(PNI)、营养风险指数(NRI)、主观全面评定(SGA)、微型营养评定(MNA)、营养不良通用筛查工具(MUST)和营养风险筛查2002(NRS2002)等,其中SGA和MNA为营养评定,不属于筛查。NRS2002是欧洲肠外营养学会于2002年提出并且推荐使用的营养筛查工具,也是迄今为止唯一基于128个随机对照研究共计8 944例研究对象循证医学为基础的研究工具,并且多数基于客观指标,故本研究应用营养风险筛查量表(NRS2002)对新疆医科大学第一附属医院286例肝癌患者进行评价。根据中华医学会肠外营养学分会的推荐意见,NRS2002评分 ≥3分(有营养风险)的患者可能从营养支持中获益,NRS2002评分<3分(无营养风险)的患者从营养支持中获益的机会比较小。
本研究显示,肝癌患者总体有营养风险的发生率为60.84%,男性肝癌患者为64.35%,女性患者为46.43%,男性肝癌患者比女性肝癌患者具有更高的营养风险的发生率。说明男性和女性肿瘤患者可能由于激素水平或者其他因素的差异从而导致患者的营养状况存在有差异,其原因需要进行进一步的研究。
本研究虽然发现部分肝癌患者存在营养风险,但是由于患者就诊于不同的科室,故未能进行正规的营养支持治疗,方案差异较大;同时因部分患者无法承受营养支持的费用,故无法评价营养支持的效果。肝癌起病隐匿,患者无明显的不适症状,确诊时多为中晚期,各期患者有营养风险的比例均高于无营养风险的患者,提示总体营养风险发生率较高。本研究显示,肿瘤分期与营养状况并无明显的相关性,Ⅰ期患者也存在有较高的营养风险的发生率,提示即使临床分期较早的肝癌患者,仍旧具有进行营养筛查的必要。
营养风险是指现存的或者潜在的营养和代谢状况对疾病或者手术有关的不利临床结局的营养,强调与营养因素有关的出现不利临床结局(如并发症)的风险,而不是出现营养不良的风险[7-8]。本研究提示,不同临床分期的肝癌患者中,存在营养风险的患者平均住院天数和住院费用总体上高于不存在营养风险的患者,再一次验证了存在有营养风险的患者如果接受各种手术或者介入、射频消融等治疗后更易出现不利的临床结局,从而增加了住院天数和总住院费用,且病死率较高。
美国肠外肠内营养学会(American Society for Parenteral and Enteral Nutrition, ASPEN)2011年临床指南明确指出营养风险筛查、评定及营养干预是营养诊疗的关键步骤,本研究仅仅进行了第一步的营养筛查,还需要继续进行后续的营养评定和营养干预。科学、合理的营养筛查、评定与支持才能够使有限的医疗资源利用最大化,改善患者结局,延长生存期,提高生活质量,使患者受益。
参考文献:
[1] Pan H, Cai S, Ji J, et al. The impact of nutritional status, nutritional risk, and nutritional treatment on clinical outcome of 2248 hospitalized cancer patients:a multi-center, prospective cohort study in Chinese teaching hospitals[J]. Nutr Cancer, 2013, 65(1):62-70.
[2] Tu MY, Chien TW, Chou MT. Using a nutritional screening tool to evaluate the nutritional status of patients with colorectal cancer[J]. Nutr Cancer, 2012, 64(2):323-330.
[3] Mendes J, Alves P, Amaral TF. Comparison of nutritional status assessment parameters in predicting length of hospital stay in cancer patients[J]. Clin Nutr, 2014, 33(3):466-470.
[4] Hayaishi S, Chung H, Kudo M, et al. Oral branched-chain amino acid granules reduce the incidence of hepatocellular carcinoma and improve event-free survival in patients with liver cirrhosis[J]. Dig Dis, 2011, 29(3):326-332.
[5] 肖蕾,张华,毛睿,等. 42808例恶性肿瘤统计分析[J]. 中国病案, 2011, 12(2):52-54.
[6] 倪雅琼,赵化荣,毛睿,等. 新疆地区3602例原发性肝癌临床流行病学资料分析[J]. 中华肿瘤杂志, 2012, 34(5):374-377.
[7] 中国抗癌协会肝癌专业委员会. 原发性肝癌的临床诊断与分期标准[J]. 肝脏, 2004, 16(S1):67-68.
[8] 张明,王杨,宋桂花,等. 潍坊某三甲医院早,中期(Ⅰ,Ⅱ,Ⅲ期)胃肠道癌患者的营养风险、营养不足发生率和营养支持情况调查[J]. 中华临床营养杂志, 2012, 20(6):345-349.
[9] 贾震易,杨俊,夏阳,等. 上海地区普外科住院患者营养风险筛查和营养支持应用调查[J]. 中华临床营养杂志, 2011, 19(5):288-294.
