产科因素对压力性尿失禁的发生及盆底肌力的影响
2014-07-17万晓慧古丽娜阿巴拜克力布合力其艾尔斯兰
万晓慧, 古丽娜·阿巴拜克力, 丁 岩, 刘 妍, 布合力其·艾尔斯兰
(新疆医科大学第一附属医院妇科, 乌鲁木齐 830054)
压力性尿失禁( stress urinary incontinence,SUI) 是指在咳嗽、大笑、打喷嚏或运动等腹压增加时,小便不自主流出的现象。SUI严重影响患者的日常生活,预防与早期诊断和治疗SUI己成为妇科学及产科学的重要研究课题之一。流行病学调查显示,妊娠及分娩是SUI的独立危险因素,并在SUI中发挥作用[1-2]。本研究对2009年8-11月在新疆医科大学第一附属医院产科分娩的701例初产妇进行问卷调查及Oxford骨盆底肌力评分[3],旨在探讨各种产科因素对女性压力性尿失禁和盆底支持组织功能的影响。
1 资料与方法
1.1研究对象选择2009年8-11月在新疆医科大学第一附属医院产科分娩的产妇701例,按分娩方式分为阴道分娩组(161例)和选择性剖宫产组(540例)。排除合并严重内、外科疾病并且既往无盆腔手术史的单胎初产妇女。
1.2尿失禁问卷调查问卷包括2个部分,第一部分为女性下尿路症状调查,参考女性下尿路症状国际尿失禁标准问卷(改良的布里斯托问卷)IQ-FLUTS,采用Gullen分度标准:Ⅰ度:仅仅在咳嗽、打喷嚏、大笑等腹压增高时偶尔有尿液溢出;Ⅱ度:在日常活动例如爬楼梯、走路等有任何屏气或腹压增高时都有尿液溢出;Ⅲ度:直立活动时即有尿液溢出;Ⅳ度:无论直立或斜卧时都有尿液溢出。第二部分为可能患病影响因素的调查,包括一般状况(年龄、身高、体质量、职业、文化程度、经济状况等)、孕产史、流产史、分娩方式(阴道分娩者包括第二产程的长短、会阴侧切或裂伤的有无等)、新生儿体质量、初产年龄、哺乳情况、产后体力劳动恢复情况等。
1.3盆底肌力的测定方法采用Oxford盆底肌力评分系统(modified Oxford scale),依收缩力量与回缩能力评估,分为0~5分,0分表示毫无收缩;1分表示有颤动,不易察觉;2分表示有轻微的不完全收缩;3分表示较强的完全收缩,没有对抗;4分表示完全收缩,具有轻微对抗,挤压好;5分表示完全收缩,具有持续对抗,挤压强。所有产妇产后6 w复查时进行盆底肌力检测,了解产后盆底肌力的改变情况。
1.4统计学处理采用SPSS17.0软件进行数据录入及统计学分析,对计量资料进行t检验,计数资料进行χ2检验,P<0.05为差异具有统计学意义。
2 结果
2.1产后尿失禁的发生情况产后发生压力性尿失禁患者与未发生压力性尿失禁患者,孕前平均体质量、孕前平均体质指数和新生儿平均体质量差异均有统计学意义(P<0.05),见表1。
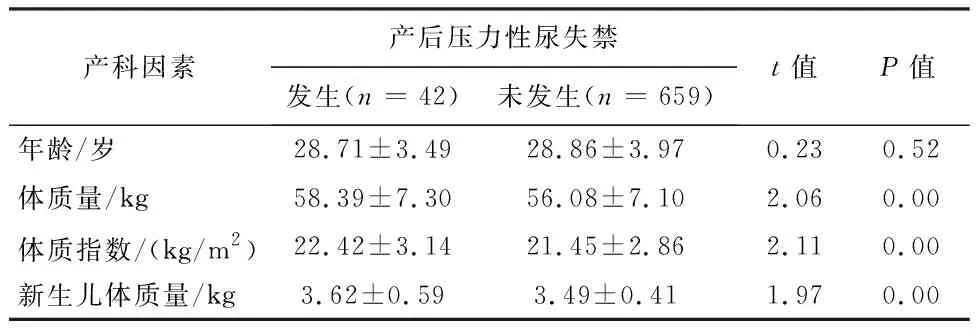
表1 产后压力性尿失禁的发生情况(-x±s)
2.2不同分娩方式与压力性尿失禁及盆底组织的关系
2.2.1 不同分娩方式与压力性尿失禁关系 阴道分娩组发生产后压力性尿失禁18例,占阴道分娩的11.18%(18/161);选择性剖宫产组发生产后压力性尿失禁24例,占选择性剖宫产组的4.44%(24/540),阴道分娩组的产后压力性尿失禁发生率明显高于选择性剖宫产组,两组差异具有统计学意义(P=0.00)。
2.2.2 经阴道分娩的产科因素与产后压力性尿失禁的关系 经阴道分娩组中发生产后压力性尿失禁与未发生产后压力性尿失禁患者在年龄、分娩孕周、第二产程时间方面均无明显差异,但孕前体质量、体质指数、新生儿体质量差异具有统计学意义(P<0.05)(表2)。阴道分娩组中会阴侧切或裂伤者130例,结果显示会阴切开和裂伤不是产后尿失禁的危险因素(P=0.74)。
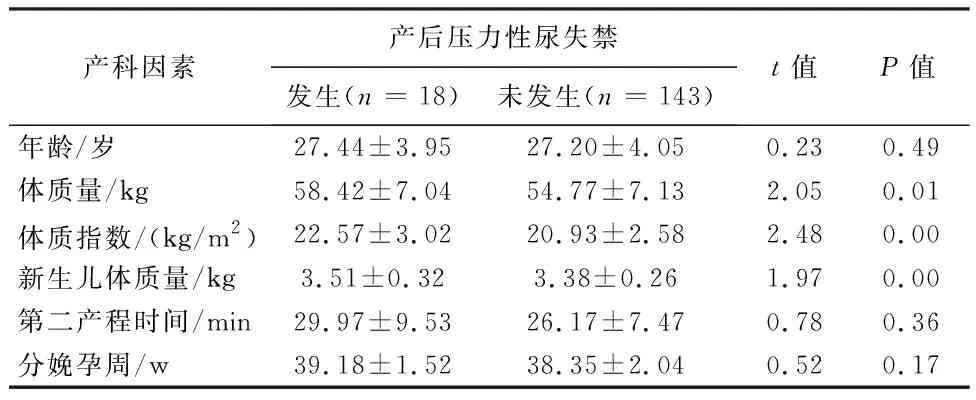
表2 经阴道分娩的产科因素与产后压力性尿失禁的关系(-x±s)
2.3产后母乳喂养情况与产后压力性尿失禁的关系本组产后6 w的母乳喂养率达到了94.15%(660/701),产后是否母乳喂养与产后尿失禁的发生率无明显关系(P=0.32)。
2.4不同分娩方式与盆底肌力的关系阴道分娩组产后盆底肌力评分≤2分者78例(48.45%),≥3分者83例(51.55%);选择性剖宫产组盆底肌力评分≤2分者150例(27.78%),≥3分者390例(72.22%)。阴道分娩组产后盆底肌力≤2分的比率高于选择性剖宫产组;而选择性剖宫产组盆底肌力≥3分的比率高于阴道分娩组,阴道分娩组的产后盆底肌力检测数值低于选择性剖宫产组,其差异具有统计学意义(P=0.00)。
3 讨论
3.1产后压力性尿失禁的发生率Fritel等[4]研究显示压力性尿失禁多与妊娠和分娩方式有一定的关系,增大的子宫和胎先露可致盆底支持结构薄弱,激素因素可直接影响胶原而致盆底弹性改变,从而影响控尿功能。产程和分娩可导致盆底肌解剖学改变,支持组织结构变化及神经损伤与盆底功能障碍密切相关。据有关研究显示,在分娩后45 d压力性尿失禁发生率为13.0%~31.1%, 产后3个月压力性尿失禁的发生率为11.0%~30.1%[5-6]。Wilson等[7]的问卷调查显示,经阴道分娩的初产妇在产后3个月内压力性尿失禁发生率为43.12%,而剖宫产妇女产后压力性尿失禁的发生率仅为5.12%。在本研究中,产后6 w压力性尿失禁发生率为5.99%(42/701),其中阴道分娩组产后压力性尿失禁发生率为11.18%(18/161),选择性剖宫产组发生率为4.44%(24/540),均低于Wilson等[7]报道的数据,分析其原因,可能与选择的研究对象均为初产妇、高剖宫产率(本研究的剖宫产率为77.03%)有关系;同时是否与我国产后有“做月子”的习俗、卧床休息时间长、体质指数低以及种族不同有关,还需进行进一步的研究探讨。
3.2产科各因素与SUI发生的相关性分析Burgio等[8]的调查资料显示,分娩后压力性尿失禁的发生与孕期尿失禁、哺乳期限长短、阴道分娩、新生儿出生体质量偏高、产钳助产和体质指数等因素明显相关;与年龄、种族、文化程度、会阴切开或裂伤情况、阴道分娩次数、产前宣教及分娩后盆底肌肉训练等因素无明显相关性。而Peyrat等[9]与Grady等[10]认为会阴切开、裂伤及感染等与压力性尿失禁的发病有关。
3.2.1 分娩方式与SUI发生的关系 研究证实在阴道分娩之后盆底肌肉、神经、韧带损伤和膀胱颈活动度增加均可导致盆底组织功能的改变,从而影响了膀胱的排空及收缩功能[11-12]。 随着阴道分娩次数的增加、产时发生难产等情况会使这种改变更加明显,压力性尿失禁发生率增加[13]。本研究提示产后尿失禁的发生与分娩方式的选择相关,与上述研究结果一致,阴道分娩组的尿失禁发生率明显高于选择性剖宫产组。
3.2.2 会阴切开或裂伤、产程与SUI发生的关系 会阴切开或裂伤对女性压力性尿失禁的利弊影响,目前没有肯定的结论。Viktrup等[14]对278例妇女的调查研究发现,会阴侧切或直切对产后压力性尿失禁没有明显的保护作用,同时还发现产后5 w内压力性尿失禁的发生率高于无会阴侧切或直切者。本组资料显示,会阴切开和裂伤不是产后尿失禁发生的危险因素(P>0.05)。需要说明的是,我国妇女在阴道分娩时采用会阴侧切较多,本次调查对象经阴道分娩均行会阴侧切,故产后远期压力性尿失禁的发生率有待更进一步的研究证实。
宋岩峰等[15]认为第二产程时间延长、产时进行器械助产时,因为胎头对盆底肌肉和神经的持续性机械压迫和扩张时间更持久,损伤作用更剧烈,超出人体生理性改变所能适应的最大限度,将会造成盆底的肌肉、神经、筋膜等组织结构发生永久性、不可逆性损伤。Tetzschner等[16]研究认为, 第二产程时间的长短对产后压力性尿失禁的发生无明显的关系。本研究也发现,阴道分娩第二产程的长短与产后压力性尿失禁的发生率无明显的关系,究其原因可能与本组调查对象的第二产程时间均在正常范围内有关。本研究中无产钳助产病例,无法进行相关统计分析,在临床实际工作中,使用产钳方式助产的病例数也呈现逐年下降趋势。
3.2.3 胎儿因素与SUI发生的关系 Sultan 等[17]研究显示,分娩高体质量胎儿时,将使产后压力性尿失禁发生率升高,分析其原因,可能是胎儿胎头头围及体质量过大增加时,盆底组织承受的压力也将随之增加,导致盆底肌肉、神经组织及尿道横纹肌肌纤维发生去神经作用,进而发生产后压力性尿失禁。本研究提示发生尿失禁产妇的新生儿平均体质量大于未发生尿失禁产妇,分别为(3.62±0.59) kg和(3.49±0.41) kg,两者之间差异有统计学意义。而阴道分娩组的产后压力性尿失禁者的平均新生儿体质量也大于未发生产后压力性尿失禁者,分别是(3.51±0.32) kg和(3.38±0.26) kg,两者之间差异有统计学意义(P<0.05),所以适当控制新生儿出生时体质量可以降低产后压力性尿失禁的发生率。
3.2.4 产妇体质量与SUI发生的关系 本研究显示产妇的孕前体质量、体质指数对于产后压力性尿失禁有影响,随着体质指数增高,压力性尿失禁的发生率增高,这与Parazzini等[18]的报道结果一致。高体质指数即肥胖,本身并不直接引起压力性尿失禁,但由于产妇自身腹壁脂肪增厚,形成慢性腹压增高,从而使压力性尿失禁发生率增高。另外,肥胖患者多数都会合并血脂或血糖的异常改变,导致盆腔的微血管发生病变以及膀胱神经损伤,均可能参与导致压力性尿失禁的发生。有研究认为,随着孕前体质指数的增加,可使压力性尿失禁的发生呈现增高趋势[19]。所以主张加强广大妇女健康宣教,适当控制孕妇体质量,避免过度肥胖,以降低人群压力性尿失禁的发生率。
3.2.5 产后母乳喂养情况与SUI发生的关系 本研究中产后早期的母乳喂养率较高94.15%(660/701),说明产后是否进行母乳喂养与产后压力性尿失禁的发生无明显关系,与Hvidman等[20]研究结果一致。但Gartland等[21]认为是否母乳喂养与产后压力性尿失禁的发生存在一定关系,认为在尿道黏膜组织和尿道平滑肌上存在雌激素受体,雌激素可以明显改善膀胱尿道的血液供应,并使尿道黏膜及黏膜下组织的厚度增加,增强尿道平滑肌的弹性,增加尿道阻力,保持了尿道柔软,而产妇母乳喂养可以在一定程度上能够调节雌激素数量,可以使雌激素的水平增加。因此,母乳喂养因提高了哺乳期间的激素水平而在一定程度上具有某些修复和改善尿道平滑肌的作用,增强了尿道支撑组织的高活动性,从而降低了产后压力性尿失禁的发生率。
3.2产科相关因素对盆底肌力的影响支持盆腔器官的力量主要来自骨盆底肌肉和结缔组织及其抵抗腹腔内压力的能力,其中肛提肌起着最为主要的作用。盆底肌肉的收缩能力反映了盆底组织的功能状态,并与SUI的发生密切相关,可作为检测盆底功能损伤的良好指标。但盆底肌力检测易受受试者的生理、心理状态及学习接受能力等因素的影响。女性在整个孕期,增大的子宫及其内的胎儿均受重力作用向盆底肌肉及筋膜等支持结构产生作用力,导致肌纤维处于牵拉状态而致盆底肌肉张力降低。一项动物实验在研究妊娠对盆底功能障碍的生物力学影响时发现,妊娠鼠盆底结缔组织形变量增加,而拉力变小[22-23]。妊娠期女性体内激素的改变是发生这种生物力学变化的主要原因,这是机体对分娩的适应性改变。产后由于这种生物力学变化未能完全恢复,促使了SUI的发生。加之阴道分娩过程中,宫颈、阴道扩张,盆底诸多肌群肌纤维受到牵拉,严重者甚至断裂,受损的肌肉强度较孕前下降,使尿道旁周围组织对尿道的支撑作用减弱,并促使尿道闭合压力下降,增加了压力性尿失禁的发病风险[24]。本研究显示阴道分娩组的产后盆底肌力检测数值低于选择性剖宫产组,其差异具有统计学意义。但由于本研究随访时间较短,不能完全了解产后受损的盆底组织功能是否能恢复,还需进一步研究。
综上所述,阴道分娩、新生儿体质量、孕前体质量、体质指数增加与产后压力性尿失禁的发生有关;阴道分娩、选择性剖宫产2种分娩方式均影响产后盆底肌力,阴道分娩可以明显降低产后盆底肌力。
参考文献:
[1] B∅ K, Kvarstein B, Nygaard I. Lower urinary tract symptoms and pelvic floor muscle exercise adherence after 15 years[J]. Obstet Gynecol, 2005, 105(5):999-1005.
[2] Strini T, Bukovi D, Roje D, et al. Epidemiology of pelvic floor disorders between urban and rural female inhabitants[J]. Coll Antropol, 2007, 31(2):483-487.
[3] Knight M, Callaghan WM, Berg C, et al. Trends in postpartum hemorrhage in high resource countries:a review and recommendations from the International Postpartum Hemorrhage Collaborative Group[J]. BMC Pregnancy Childbirth, 2009, (9):55.
[4] Fritel X, Fauconnier A, Levet C, et al. Stress urinary incontinence 4 years after the first delivery:a retrospective cohort survey[J]. Acta Obstet Gynecol Scand, 2004, 83(10):941-945.
[5] Dolan LM, Walsh D, Hamilton S, et al. A study of quality of Life in primigravidae with urinary incontinence[J]. Int Urogynecol J Pelvic Floor Dysfunct, 2004, 15(3):160-164.
[6] Chaliha C, Digesu A, Hutchings A, et al. Caesarean section is protective against stress urinary incontinence:an analysis of women with multiple deliveries[J]. BJOG, 2004, 111(7):754-755.
[7] Wilson PD, Herbison RM, Herbison GP. Obstetric practice and the prevalence of urinary incontinence three months after delivery[J]. Br J Obstet Gynaecol, 1996, 103(2):154-161.
[8] Burgio KL, Zyczynski H, Locher JL, et al. Urinary incontinence in the 12-month postpartum period[J]. Obstet Gynecol, 2003, 102(6):1291-1298.
[9] Peyrat L, Haillot O, Bruyere F, et al. Prevalence and risk factors of urinary incontinence in young and middle-aged women[J]. BJU Int, 2002, 89(1):61-66.
[10] Grady D, Brown JS, Vittinghoff E, et al. Postmenopausal hormones and incontinence:the Heart and Estrogen/Progestin Replacement Study[J]. Obstet Gynecol, 2001, 97(1):116-120.
[11] Meyer S, Schreyer A, De Grandi P, et al. The effects of birth on urinary continence mechanisms and other pelvic-floor characteristics[J]. Obstet Gynecol, 1998, 92(4 Pt 1):613-618.
[12] Thorp JM, Norton PA, Wall LL, et al. Urinary incontinence in pregnancy and the puerperium:a prospective study[J]. Am J Obstet Gynecol, 1999, 181(2):266-273.
[13] 宋岩峰. 盆底功能障碍性疾病的诊断及康复治疗[J]. 中国实用妇科与产科杂志, 2008, 24(8):507.
[14] Altman D. Ekströma, Gustafsson C, Lópeza FC, et al. Risk of urinary incontinence after childbirth:a 10-year prospective cohort study[J]. Obstet Gynecol, 2006, 108(4):873-878.
[15] 宋岩峰. 妊娠分娩与盆底结构损伤[J]. 中国实用妇科与产科杂志, 2007, 23(6):478-480.
[16] Tetzschner T, Sorensen M, Lose G, et al. Anal and urinary incontinence in women with obstetric anal sphincter rupture[J]. Br J Obstet Gynaecol, 1996, 103(10):1034-1040.
[17] Sultan AH, Kamm MA, Hudson CN. Pudendal nerve damage during Labour:prospective study before and after childbirth[J]. Br J Obstet Gynaecol, 1994, 101(1):22-28.
[18] Parazzini F, Chiaffarino F, Lavezzari M, et al. Risk factors for stress, urge or mixed urinary incontinence in Italy[J]. BJOG, 2003, 110(10):927-933.
[19] Solans-Domènech M, Sánchez E, Espua-Pons M, et al. Urinary and anal incontinence during pregnancy and postpartum:incidence, severity, and risk factors[J]. Obstet Gynecol, 2010, 115(3):618-628.
[20] Hvidman L, Foldspang A, Mommsen S, et al. Postpartum urinary incontinence[J]. Acta Obstet Gynecol Scand, 2003, 82(6):556-563.
[21] Gartland D, Donath S, MacArthur C, et al. The onset, recurrence and associated obstetric risk factors for urinary incontinence in the first 18 months after a first birth:an Australian nulliparous cohort study[J]. BJOG, 2012, 119(11):1361-1369.
[22] Lowder JL, Debes KM, Moon DK, et al. Biomechanical adaptations of the rat vagina and supportive tissues in pregnancy to accommodate delivery[J]. Obstet Gynecol, 2007, 109(1):136-143.
[23] Rahn DD, Ruff MD, Brown SA, et al. Biomechanical properties of the vaginal wall:effect of pregnancy, elastic fiber deficiency, and pelvic organ prolapse[J]. Am J Obstet Gynecol, 2008, 198(5):590.e1-590.e6.
[24] Lin G, Shindel AW, Banie L, et al. Molecular mechanisms related to parturition-induced stress urinary incontinence[J]. Eur Urol, 2009, 55(5):1213-1222.
