Cu(I)催化合成六氢氮类杂卓衍生物反应机理的研究
2014-07-13李来才
张 林,张 明,李来才
(四川师范大学化学与材料科学学院,成都610066)
1 引 言
近年来,随着有机化学的高速发展以及人们对新型有机化合物的深入了解,发现芳杂环类化合物大量存在于天然有机分子中,并广泛应用于合成药物、日用化工用品、农药、高分子有机材料等领域.因此,对于这类化合物的研究一直是化学界的重要课题之一[1,2].过渡金属催化C—C、C—O、C—N 等偶联反应具有高度选择性,反应条件温和及催化剂用量少等优点,已经成为当今合成芳杂环类化合物的重要途径.六氢氮杂卓衍生物多存在于核苷类抗生素和NK1/NK2拮抗剂等一些天然化合物和生物活性分子中,杂环类化合物具有多种药理活性[3-5],尤其在药物研发中占有重要地位,用于治疗心脏病,副作用小且无耐药性[6,7].单个C—N 键、C—O 键、C—C键偶联反应的反应机理,在近些年的研究中已经比较深入[8,9],但是单一的催化剂在 “一锅法”反应中反应机理的研究目前报道很少.陈文明小组[10]研究的六氢氮杂卓系列化合物的合成引起了我们的兴趣.陈等人利用连续投料的 “一锅法”反应完成C—N 键、C—O 键偶联反应得到六氢氮杂卓系列化合物,反应如Scheme 1 所示.在这篇报道中,我们知道C—N 键、C—O 键偶联反应都有各自特有的反应环境,在第二步继续偶联时催化剂CuI起到一个什么样的作用,从反应分子中脱离出来还是在反应分子内继续催化;为什么先是C—N键偶联,随后才是C—O 键偶联等等.为了更深入的了解Cu—X催化芳基卤分子间的N-芳基化和O-芳基化反应特征,本文采用密度泛函理论对此反应微观机理进行研究,希望通过对其微观反应过程的解析和说明,为相关实验提供一些理论信息.

Scheme 1
2 计算方法
采用量子化学中的密度泛函理论[11,12],在B3LYP/6-31+G (d)基组水平上 (C 采用赝势基组LANL2DZ,Br、I采用MIDIX 基组)对Cu(1)催化下对溴碘苯和六氢氮杂卓与苯酚三组份发生分子间的N-芳基化和O-芳基化反应过程中所有的反应物、中间体、过渡态和产物进行全参数优化.在相同基组下进行了频率计算,计算所得所有的过渡态有且只有唯一的虚频,通过内禀反应坐标 (IRC)计算和振动频率分析进一步验证了过渡态的合理性.在相同基组水平上运用自然键价轨道 (NBO)[13]分析方法分析了中间体、过渡态的轨道间相互作用,利用AIM2000 程序包[14]计算了相应的成键临界点 (BCP)电荷密度,分析了成键特征,通过振动分析得到零点能(ZPE)及其校正后的总能量.所有计算采用Gaussian 09程序完成[15].
3 结果与讨论
Cu催化六氢氮杂卓系列化合物的反应历程如图1所示,IM1→IM5有两条可行反应通道IA和IB,中间体IM1可通过IA路径,先与反应物R2作用再脱掉HI分子得到中间体IM5,也可以按IB路径先脱去HI分子再与反应物R2作用得到中间体IM5;IM8→IM12也有两条可行反应通道IC和ID,中间体IM8可通过IC路径,先与产物P1 作用再脱掉HI分子得到中间体IM12,也可按ID路径先脱去HI分子再与产物P1作用得到中间体IM12.反应过程中所有反应物、中间体、过渡态以及产物的优化构型和结构参数的标注见图2,相关的反应能量如表1,反应能级示意图如图3.计算结果表明:所有中间体的力常数本征值为正,是反应势能面上的稳定点,所有过渡态都具有唯一的虚频.
3.1 IA反应通道机理分析

图1 六氢氮杂卓合成路线Fig.1 Detailed synthesis route of 2-Perhydroazepinone

表1 反应各驻点的能量E(a.u.),相对能量Erel(kJ·mol-1)Table 1 Energies E(a.u.),relative energies Erel(kJ·mol-1)
研究发现反应的第一步是催化剂CuI的Cu原子先与反应物R1的N 原子形成配位键,得到络合中间体IM1.计算发现R1 中C (1)-N、C(2)-N、N-H (1)键 长 分 别 为0.1374 nm、0.1464nm、0.1013nm,而在IM1中C (1)-N、C (2)-N、N-H (1)键长分别为0.1448nm、0.1507nm、0.1024nm,键长依次增加.在R1+CuI→IM1过程中,BCP电荷密度发生了相应的变化:C (1)-N 由0.3141a.u.减少到0.2756a.u.,C(2)-N由0.2574a.u.减少到0.2326a.u.,N-H (1)由0.3312a.u.减少到0.3273a.u..另外,IM1中的Cu-I键长比催化剂CuI中Cu-I键长增加了0.0015 nm,BCP电荷密度减少了0.0006a.u..上述数据说明催化剂CuI的Cu原子与R1中的N 原子形成配位键,对原来的七元环进行拉扯使得与N 原子相连接的两个C 原子之间均变长,而N-H (1)被削弱.从NBO 计算分析得知,中间体IM1中BD(σ)C (6)-N→LP* (6)Cu 二阶稳定化能E(2)为25.49kJ/mol,BD (1)N-H→LP* (6)Cu二阶稳定化能E (2)为30.56kJ/mol,表明它们之间存在轨道间相互作用.从能量表表1可以看出从催化剂CuI与R1 形成中间体IM1 后,能量降低了102.88kJ/mol,说明中间体IM1 易形成并稳定存在.在催化剂CuI成功吸附反应物R1后,继续吸附反应物R2中富电子I原子,计算发现中间体IM2 中Cu-N、Cu-O 键长分别为0.3210nm、0.2057nm,BCP 电荷密度分别为0.0122a.u.、0.0681a.u.,说明了IM2 中Cu 原子与R2 中I原子形成配位键导致Cu-N 键变弱,Cu-O键增强.IM2中C (3)-I(2)键长为0.2129 nm,比R2增长了0.0019nm,其BCP电荷密度由0.1603a.u.降低到0.1218a.u.,说明IM2中的Cu原子与R2中I原子形成了配位键导致C (3)-I(2)键变弱.从NBO 计算分析得知,中间体IM2中BD (σ)C (15)-I(19)→LP* (7)Cu二阶稳定化能为25.91kJ/mol,LP (5)Cu→BD* (1)C(15)–I(19)二阶稳定化能为7.49kJ/mol,表明它们之间存在轨道间相互作用.从能量表表1可以看出IM1和R2配位形成中间体IM2,能量升高了13.68kJ/mol,说明中间体IM2易形成并稳定存在,并在此过程完成了催化剂的整个吸附过程.催化剂CuI完成对R1和R2的活化络合之后,经过过渡态TS1形成中间体IM3,振动频率证实了过渡态TS1其虚频振动频率为74.2icm-1.在TS1中,Cu-O的键长由0.2057nm 增加到0.2259nm,其BCP电荷密度由0.0.0652a.u.降低0.0454a.u.;而Cu-N 键长则缩短为0.2055nm.过渡态TS1中Cu-OC(1)-N-H (1)之间的成环临界点 (RCP)电荷密度为0.0364a.u.,说明TS1是五元环状过渡态.从能量表表1可以看出IM2→TS1→IM3过程,反应所需活化能为110.48KJ/mol.中间体IM3经过渡态TS2脱HI分子形成中间体IM5,振动频率证实TS2虚频振动频率为467.3icm-1.从能量表表1数据可知,IM3→TS2→IM4→IM5过程的活化能为13.53KJ/mol,说明脱掉HI分子过程容易进行.
3.2 IB反应通道机理分析


图2 反应路径中各驻点的分子构型图Fig.2 Geometric parameters of the compounds in pathway(Bond length in nm,BCP(in brackets)in a.u.)
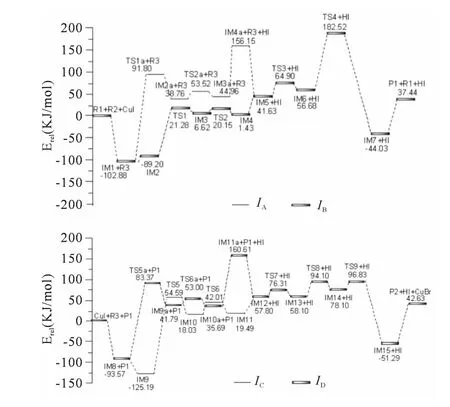
图3 路径中各驻点的能级图Fig.3 The diagram of relative energies along the channel
中间体IM1经过过渡态TS1a转化为中间体IM2a,通过计算证实了过渡态TS1a虚频的振动频率是513.5icm-1.在过渡态TS1a 中,N-H(1)键长为0.2017nm,比中间体IM1的0.1024 nm 增加了0.0993 nm,其BCP 电荷密度由0.3273a.u.减小到0;Cu-H (1)键长为0.1449 nm,比中间体IM1 的0.2474nm 缩短了0.1025 nm,其BCP电荷密度由0增加到0.1293a.u..以上构型数据充分表明IM1→TS1a→IM2a过程,N-H (1)键逐步断裂,而Cu-H (1)键逐步形成.在IM2a中,N-H (1)键长为0.3536nm,说明N-H (1)键已经完全断裂.从能量表表1数据可知,IM1→TS1a→IM2a 过程的活化能为193.68KJ/mol,活化能较高.中间体IM2a经过过渡态TS2a转化为中间体IM3a,通过计算证实了过渡态TS2a虚频的振动频率是316.5icm-1.在过渡态TS2a 中,Cu-H (1)的键长为0.2599 nm,比IM2a的0.1522nm 增加了0.1077nm,其BCP 电荷密度由0.1129a.u.减小到0;而I(1)-H (1)的键长为0.1653nm,比IM2a 的0.1962nm 缩短了0.0309nm,其BCP 电荷密度由0增加到0.1361a.u..以上构型数据充分表明IM2a→TS2a→IM3a过程,Cu-H (1)键逐步断裂,而I(1)-H (1)键逐步形成.在IM3a中,Cu-H (1)键长为0.3182nm,I(1)-H (1)键长为0.1649nm,说明Cu-H (1)键已经完全断裂,I(1)-H (1)已经形成.从能量表表1数据可知,IM2a→TS2a→IM3a过程的活化能为14.76 KJ/mol,反应活化能较低,该反应容易进行.中间体IM3a 进一步脱去一分子HI 形成中间体IM4a.在IM3a中,Cu-I(1)键长为0.2436nm,其BCP电荷密度为0.0721a.u..在IM4a中Cu-I(2)键长为0.1964nm,IM4a与反应物R2活化络合形成中间体IM5 后,Cu-I(2)键长增加到0.1993 nm,相应的BCP 电荷密度变化由0.0922a.u.减小到0.0874a.u..从能量表表1数据可知,IM4a+R2→IM5过程能量降低了114.52 KJ/mol,表明该反应容易进行.中间体IM5经过过渡态TS3转化为中间体IM6,过渡态TS3虚频的振动频率为76.6icm-1.从能量表1上也可以看出,从IM5 到TS3 所需要的活化能为23.27 kJ/mol,活化能较小,说明该反应很容易进行.中间体IM6经过过渡态TS4得到中间体IM7,过渡态TS4虚频振动频率为133.4icm-1.从能量表表1可知,IM6→TS4→IM7过程的活化能为125.84 kJ/mol,活化能较大,是整个反应的速控步骤.中间体IM7转化到产品P1是催化剂CuI从反应物上的裂解过程,表明是催化剂完成了一个催化单元,这步反应的活化能是81.47kJ/mol,裂解较容易进行.
3.3 IC反应通道机理分析
在此处催化剂CuI完成了N-C (3)的结合过程,接下来催化剂CuI继续进攻含有孤对电子的反应物R3上的O 原子形成中间体IM8.计算发现中间体R3 受CuI吸附作用与O 形成配位键,使C (5)-O (2)、O (2)-H (2)键长分别由R3的0.1373nm、0.0970nm 增加到0.1400nm、0.0971nm,相应的BCP 电荷密度由R3 中的0.2786a.u.、0.3543a.u. 降 低 至 0.2519au、0.3496a.u..Cu-I也由CuI中的0.2367nm 增加至0.2373nm.从NBO 计算分析得知,中间体IM8中成键轨道BD(σ)C-O 的占据数为1.9951e小于反应前占据数1.9954e;在中间体IM8中BD(σ)O (7)–H (10)→LP* (8)Cu的二阶稳定化 能E (2)为24.61kJ/mol,BD (σ)Cu-I(9)→LP* (8)Cu 的二阶稳定化能E (2)为16.74kJ/mol,表明它们之间存在轨道间相互作用.从能量表表1可以看出,CuI与R3的O 原子形成配位键得到IM8 后,能量降低了93.57kJ/mol,表明IM8易形成并稳定存在.
中间体IM9是中间体IM8中的Cu原子与产物P1中的Br原子形成的配体.从计算结果上看,IM9中Cu 与Br原子已经成键,键长为0.2358 nm,BCP 电荷密度为0.0664a.u.,而C-Br键则从产物P1中的0.1914nm 增长到0.1949nm.从NBO 计算分析得知,成键轨道BD (σ)C-Br的占据数为1.9837e小于反应前占据数1.9880e;BD(σ)C (11)–Br(14)→LP* (7)Cu的二阶稳定化能E (2)为27.92kJ/mol,LP (5)Cu→BD* (1)C (11)-Br(14)的二阶稳定化能E(2)为4.86kJ/mol,表明它们之间存在较强的轨道间相互作用.从能量表表1 可以看出,IM8 和产物P1配位形成中间体IM9,能量降低了31.62 kJ/mol,表明IM9易形成并稳定存在.然而从计算结果上看,IM8→IM9过程,Cu-O (2)键长从0.1986nm 增长到0.3581nm,BCP 电荷密度由0.0723a.u.降低到0.0040a.u..这是由于CuI吸附过程中形成的空间位租和化学键不同造成的,在IM8中,Cu原子进攻苯酚中O 原子,与O 原子的孤对电子形成配位键;吸附产物P1 时,Cu原子与产物P1中的Br原子形成配体,产生强于配位键的化学键.在催化剂CuI完成对中间体IM8和产物P1的活化络合形成中间体IM9之后,中间体IM9经过过渡态TS5转化为中间体IM10,过渡态TS5虚频振动频率为742.8icm-1,从能量变化上看,从中间体IM9转化到过渡态TS5能量升高了179.78kJ/mol,活化能较大,是整个反应的速控制步骤.中间体IM10经过过渡态TS6转化为复合物IM11,进一步脱去HI分子形成中间体IM12,计算得到过渡态TS6 虚频振动频率为477.2icm-1,IM10→TS6→IM11 的活化能为23.98KJ/mol,该能量较小,反应很容易进行.M11→IM12是脱掉HI分子的过程,脱掉HI分子后能量升高了38.31KJ/mol,该过程也是比较容易进行的.
3.4 ID反应通道机理分析
中间体IM8 经过过渡态TS5a 形成中间体IM9a,过渡态TS5a 虚频振动频率为676.6 icm-1.在过渡态TS5a中,O (2)-H (2)键长为0.1782nm,比IM8中增加了0.0811nm;Cu-H (2)键 长 为0.1478 nm,比IM8 中 缩 短 了0.1124nm.IM8→TS5a过程BCP电荷密度变化:O (2)-H (2)由0.3496a.u.减小到0,Cu-H(2)由0增加到0.1196a.u..以上构型数据说明,IM8→TS5a→IM9a过程,O (2)-H (2)键部分断裂,Cu-H (2)键逐步形成.从能量变化上看,IM8→TS5a的活化能为176.94KJ/mol,活化能较大,为整个反应的速控步骤,决定该反应的反应速率.中间体IM9a经过过渡态TS6a形成中间体IM10a,过渡态TS6a虚频振动频率为497.2 icm-1.IM9a→TS6a→IM10a 过程的活化能为11.21 KJ/mol,该能量较小,反应容易进行.IM10a脱掉一分子HI形成中间体IM11a,IM11a与产物P1活化络合生成中间体IM12,IM11a→IM12过程中,IM11a+P1→IM12 过程能量降低了176.94 KJ/mol,该反应容易进行.中间体IM12中的Cu原子继续进攻分子内的苯环,IM12通过过渡态TS7完成Cu对目标C (4)原子的络合得到中间体IM13,TS7的虚频振动频率为76.9 icm-1,IM12→TS7→IM13 过程,能量升高了18.51kJ/mol,进而转化到IM13 时能量降低了18.21kJ/mol,该反应容易进行.Cu原子对目标C (4)原子络合形成中间体IM13 后,中间体IM13又经过过渡态TS8形成中间体IM14,过渡态TS8 虚频振动频率为106.5icm-1.中间体IM13转化到过渡态TS8 能量升高了36.00kJ/mol,表明该反应是容易进行的.中间体IM14经过过渡态TS9转化成中间体IM15,IM14经过过渡态TS9转化到中间体IM15所需要的活化能为8.73 kJ/mol,能量比较小,说明反应比较容易进行.最后,从中间体IM15到产物P2是CuBr离去的过程.
由表1中能量数据可以看出,中间体IM1→中间体IM5有两条可行反应通道IA和IB,中间体IM8→中间体IM12 也有两条可行反应通道IC和ID.路径IA的速控步骤是IM6→TS4→IM7,活化能为126.34KJ/mol;路径IB的速控步骤为IM1→TS1a→IM2a,活化能为193.68KJ/mol;比较可知,路径IA活化能较低,是主要的反应通道.路径IC的速控步骤是IM9→TS5→IM10,活化能为179.78 KJ/mol;路径ID的速控步骤为IM8→TS5a→IM9a,活化能为176.94KJ/mol;比较可知,反应通道IC和ID反应控制步骤活化能相差不大,两条反应通道可同时进行.整个反应的反应历程为:CuI+R1+R2→IM2→TS1→IM3→TS2→IM4→IM5→TS3→IM6→TS4→IM7→P1→P1+IM8→IM9a→TS5a→IM10a→TS6a→IM11a→IM12→TS7→IM13→TS8→IM14→TS9→IM15→P2.整个反应的速控步骤为IM8→TS5a→IM9a,反应活化能为176.94kJ/mol.
为了更好地说明催化剂CuI在第二步反应的作用,我们研究了没有催化剂CuI该反应的反应过程如Scheme 2,反应中所有反应物、过渡态以及产物的优化构型和结构有关参数的标注见图1.过渡态TS10虚频振动频率为389.3icm-1,证实了该过渡态的存在.没有催化剂CuI的反应过程的反应活化能是199.01kJ/mol,比有催化剂CuI的最高反应活化能高22.07kJ/mol.

Scheme 2
4 结 论
本文采用密度泛函理论研究Cu催化的 “一锅法”合成六氢氮杂卓化合物反应的微观反应机理,优化所有反应物、中间体、过渡态和产物的几何构型,在相同条件下进行了频率计算,通过频率的正负值确定中间体和过渡态真实性.其反应的历程为:CuI+R1+R2→IM2→TS1→M3→TS2→IM4→IM5→TS3→IM6→TS4→IM7→P1→P1+IM8→IM9a→TS5a→IM10a→TS6a→IM11a→IM12→TS7→IM13→TS8→IM14→TS9→IM15→P2.整个反应的速控步骤为IM8→TS5a→IM9a,反应活化能为176.94kJ/mol.通过比较反应速控步骤有无Cu催化剂对反应活化能的影响,结果表明没有Cu (I)催化剂时,比有Cu(I)催化时的反应活化能升高了22.07kJ/mol,说明了Cu (I)催化剂促进了反应的进行,这与实验结果相一致.
[1] Xu H J,Lin Q S,Lin Y C,et al.Recent progress in copper catalyzed carbon-hetero cross-coupling reactions[J].Chinese J.Org.Chem.(有 机 化 学),2010,30(1):9(in Chinese)
[2] Xu L Y,Tao S J,Zhang X Z,et al.Synthesis and anti-proliferative activity ofβ-elemene derivatives of aromatic heterocycles[J].Chinese J.Med.Chem.(中国药物化学杂志),2006,16(5):277(in Chinese)
[3] Hitoshi H,Miyuki F,Makiko D,et al.Synthesis and antimycobacterial activity of capuramycin analogues.Part 1:substitution of the azepan-2-one moiety of capuramycin[J].Bioorg.Med.Chem.Lett.,2003,13(17):2829.
[4] Marc G,Luigi La V,Robert M,et al.Dual neurokinin NK1/NK2 antagonists:N-[(R,R)-(E)-1-arylmethyl-3-(2-oxo-azepan-3-yl)carbamoyl]allyl-N-methyl-3,5-bis(trifluoromethyl)benzamides and 3-[N′-3,5-bis(trifluoromethyl)benzoyl-N-arylmethyl-N′-methylhydrazino]-N-[(R)-2-oxo-azepan-3-yl]propionamides[J].Bioorg.Med.Chem.Lett.,2001,23(11):3081.
[5] Prakash O,Kumar A,Sadana A,et al.Study of the reaction of chalcone analogs of dehydroacetic acid and o-aminothiophenol:synthesis and structure of 1,5-benzothiazepines and 1,4-benzothiazines[J].Tetrahedron,2005,61(27):6642.
[6] Taku N,Mohammed A,Matlib,et al.Effects of diltiazem,a calcium antagonist,on regional myocardial function and mitochondria after brief coronary occlusion[J].J.Mol.Cell.Cardiol.,1980,12(1):29.
[7] Jitender B B,Kuldip D U,Atul T M,et al.Synthesis,biological activity and QSAR studies of some heterocyclic compounds[J].Eur.J.Med.Chem.,2008,43(11):2279.
[8] Wang Y F,Zeng J H,Cui X R.Recent progress in copper-catalyzed C-N coupling reactions[J].Chinese J.Org.Chem.(有机化学),2010,30(2):181(in Chinese)
[9] Wang D P,Zhang X D,Liang Y,et al.Recent progress in the palladium-catalyzed stille cross-coupling reactions[J].Chinese J.Org.Chem.(有机化学),2006,26(1):19(in Chinese)
[10] Chen W M,Li J J,Feng C,et al.Copper-catalyzed one-pet multicomponent coupling reaction of phenols,amides and 4-bromphenyl iodide [J].Org.lett.,2008,10(20):4565.
[11] Kohn W,Sham L J.Self-consistent equations including exchange and correlation effects [J].Phys.Rev.,1965,140:A1133.
[12] Hariharan P C,Pople J A.The influence of polarization functions on molecular orbital hydrogenation energies[J].Theor.Chim.Acta,1973,28(3):213.
[13] Pople J A,Gill P M W,Johnson B G.Kohn-Sham density-functional theory within a finite basis set[J].Chem.Phys.Lett.,1992,199(6):557.
[14] Slater J C.Quantum theory of molecules and solids:the self-consistent field for molecules and solids[M].New York:McGraw Hill Press,1974.
[15] Frisch M J,Trucks G W,Schlegel H B,et al.Gaussian 09,Rev A 02.Wallingford CT:Gaussian,Inc.,2009.
