包茎局部狭窄环中胶原纤维分型状况研究
2014-07-13盛新福张立东王玉杰贺继强
孙 程, 盛新福, 张立东, 王玉杰, 贺继强
(新疆医科大学1第一附属医院泌尿外科, 2临床医学系, 乌鲁木齐 830054)
局部外用类固醇是目前国外治疗包茎的新疗法,多使用低浓度倍他米松软膏等药物外用于包茎狭窄环处,早晚各1次,一般疗程不超过1个月[1-2]。本课题组也曾开展了相关的临床试验,对包茎狭窄环处组织和正常对照组织进行了电镜学超微结构研究,发现包茎狭窄环处存在大量异常堆积的胶原纤维,而正常组及外用类固醇治疗后痊愈组中未见胶原异常堆积[3]。包茎局部狭窄环中胶原纤维的分型研究对于进一步揭示包茎外环口张力过高的原因以及类固醇治疗包茎机理的研究有重要意义。本研究采用免疫组织化学法对包茎局部狭窄环组织胶原纤维进行分型研究并分析导致包茎外环口张力过高的主要原因。
1 资料与方法
1.1临床资料随机选择门诊手术室要求行包皮环切术者16例,包茎组8例,正常对照组8例,年龄8~12岁。包茎组患儿均为包皮外环口狭窄导致包皮无法上翻者。门诊手术均采取袖套样包皮环切术以确保外环口组织完整。
1.2免疫组织化学法将手术环切标本经固定、石蜡组织包埋后切片。采用两步法免疫组化检测,经脱蜡水化,抗原修复,加一抗及二抗显色复染显色液显色复染后封片,显微镜观察。所用Ⅰ型、Ⅱ型、Ⅲ型及Ⅳ型胶原检测试剂盒均由武汉博士德生物工程有限公司提供。
1.3结果判定在显微镜下,染色标准为:阳性染色面积占总面积<25%为(+/-),25%~50%为(+),51%~75%为(++),>75%为(+++),分别计分为1、2、3、4分。染色强度分别以(+/-)、 (+)、(++)表示,分别计分为1、2、3分。将二者计分乘积作为免疫组化结果,然后根据两项记分之和判断其结果。
1.4统计学处理采用Mann-Whitney U秩和检验对结果进行统计学分析,检验水准α=0.05。
2 结果
两组Ⅰ型胶原的表达有统计学差异(P=0.009),两组Ⅲ型胶原表达存在统计学差异(P=0.007),Ⅰ型胶原和Ⅲ型胶原之比也存在统计学差异(P=0.001),结果见表1。
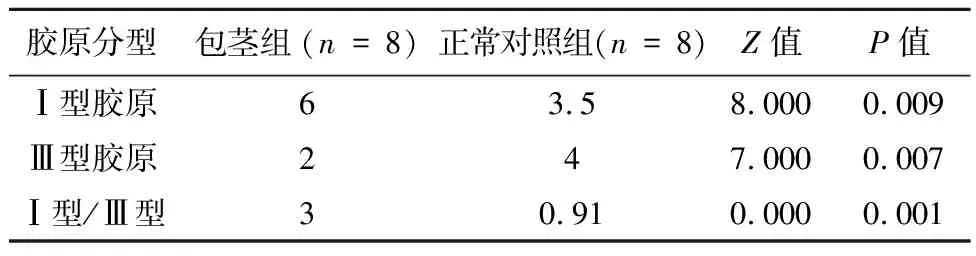
表1 包茎组和正常对照组胶原表达比较
此外发现Ⅱ型胶原在包茎组个别标本中有一定高表达,正常对照组中均为低表达。 Ⅳ型胶原在两组中均为低表达,未见明显统计学差异。
3 讨论
本研究采用了Ⅰ型、Ⅱ型、Ⅲ型、Ⅳ型胶原(CollagenⅠ~Ⅳ)检测试剂对包茎局部狭窄环组织和正常对照组织进行免疫组化研究。两组标本主要染色显示的胶原纤维为Ⅰ型胶原和Ⅲ型胶原,但在包茎组与正常对照组中构成比例不同。在包茎组中以Ⅰ型胶原为主,Ⅰ型胶原与Ⅲ型胶原的比值高于正常对照组。Ⅱ型胶原在包茎组个例中有表达,原因不明尚待进一步研究。Ⅳ型胶原在两组中均为低表达。
皮肤的张力主要由胶原纤维来决定,而其中Ⅰ型胶原多致密成网,具有高度的机械稳定性[4],是决定张力的主要因素。Ⅰ型胶原和Ⅲ型胶原的比例与皮肤张力呈明显正相关,胎儿及新生儿皮肤中Ⅲ型胶原较多,因而皮肤弹性相对较高[5],随着Ⅰ型胶原和Ⅲ型胶原比例的升高,皮肤张力增加而弹性降低。
在瘢痕组织中可发现Ⅰ型胶原的过度增生,Ⅰ型胶原和Ⅲ型胶原的比值明显升高[6]。对瘢痕的进一步研究表明成纤维细胞活性的明显增强可导致胶原纤维过度生成[7],而基质中胶原合成与降解的调节失衡是导致胶原过度堆积的主要原因[8-9],甚至可出现Ⅰ型胶原取代Ⅲ型胶原而导致Ⅰ型胶原过度沉积[10-11]。Ⅰ型和Ⅲ型胶原的比例升高是导致皮肤瘢痕组织张力过高的主要原因[12-13]。Ⅰ型胶原和Ⅲ型胶原的比例在心肌中增加也可造成左心室僵硬而影响其舒张功能[14]。
本研究发现包茎组Ⅰ型胶原表达明显高于正常对照组,Ⅲ型胶原则明显低于正常对照组,Ⅰ型胶原和Ⅲ型胶原的比例明显高于正常对照组。认为包茎局部狭窄环中Ⅰ型胶原和Ⅲ型胶原的比例过高是导致包茎外环口张力过高的主要原因,提示局部类固醇治疗包茎可能通过降解包茎狭窄环处过多的Ⅰ型胶原而达到治疗效果。胶原作为重要的细胞外基质,其合成和降解主要由基质金属蛋白酶系调控[15]。推测包茎局部狭窄环处胶原纤维异常与局部基质金属蛋白酶系失调有关。对相关基质金属蛋白酶的研究将为进一步揭示包茎局部狭窄环的形成原因以及开发更高效治疗包茎的临床药物具有重要意义。
参考文献:
[1] Webster TM, Leonard MP. Topical steroid therapy for phimosis[J]. Can J Urol, 2002,9(2):1492-1495.
[2] Van Basten JP, De Vijlder AM, Mensink HJ.The use of corticosteroid cream to treat phimosis[J]. Ned Tijdschr Geneeskd,2003,147(32):1544-1547.
[3] 孙程 盛新福,地里夏提,等.局部类固醇治疗小儿包茎临床疗效分析[J].中华泌尿外科杂志,2007,28(6):421-423.
[4] 张学军,刘维达,何春涤.现代皮肤病学基础[M].2版.北京:人民卫生出版社, 2010:29-30.
[5] 刘辅仁.实用皮肤科学[M].3版.北京:人民卫生出版社,2005:8-9.
[6] 李航,刘玮(译).皮肤外科学-美容皮肤外科[M].北京:人民卫生出版社,2012:300-301.
[7] Gauglitz GG, Korting HC, Pavicic T, et al. Hypertrophic scarring and keloids :pathomechanisms and current and emerging treatment strategies[J]. Mol Med,2011,17(1):113-125.
[8] 刘佳琦, 胡大海. 瘢痕疙瘩形成机制的研究进展[J]. 国际外科学杂志, 2007,34(5):346-349.
[9] 张娟娟, 吕世军. 病理性瘢痕发病机制研究进展[J]. 医学综述,2007,13(8):580-582.
[10] Babu M, Diegelmann R, Oliver N. Fibronectin is over-produced by keloid fibroblasts during abnormal wound healing[J].Mol Cell Biol,1989,9:1642-1650.
[11] Friedman DW, Boyd CD. Regulation of collagen gene expression in keloids and hypertrophic scars[J].J Surg Researh, 1993,55:214-222.
[12] 唐世杰,胡素銮,庞素芳,等.增生性瘢痕和瘢痕疙瘩组织中Ⅰ、Ⅲ型胶原蛋白含量的改变及其意义[J]. 医学临床研究,2004,21(4):368.
[13] Wang X,Smith P,Pu L,et al.Exogenous transforming grouth factor modulates collagen Ⅰand collagen Ⅲ synthesis in proliferative scar xenografts in nude rats[J].J Surg,1999,87:194-199.
[14] Berk BC,Fujiwara K, Lehoux S, et al. ECM remodeling; in hypertensive heart disease[J].J Clin Invest,2007 ,117(3):568-575.
[15] 伍津津,牛堂友.皮肤组织工程学[M].北京:人民军医出版社,2009:30-31.
