微型化学实验教学浅谈
2014-07-10张正超
●张正超
所谓微型化学实验,就是以尽可能少的化学试剂来获取所需化学信息的实验方法与技术,它具备两个突出的特点:微型化学实验中所需药品用量较少;在微型化的仪器装置中进行化学实验。微型化学实验对化学课堂教学有如下特点:
一、微型化学实验操作简便,安全
高中常规实验比较多,有毒的实验过半。固体有毒残留物较好处理。气体有毒残留物不便于回收,故很多学校就配了通风橱,把有毒气体抽到大气中,仅仅是转移了污染物,采用微型实验可将污染降低到最低限度。 氯气的制备及其化学性质的实验使用标准仪器就能很好地进行演示,仪器装置十分庞大,实验步骤相当繁琐,而且不便于学生操作,并且实验用药剂量大,并在开放的环境里做,造成氯气外逸危害师生的健康。因此,让学生利用微型实验装置来做氯气的制备和性质实验,速度快、试剂用量少、现象明显、而且污染小。
二、微型化学实验取材广泛,制作方便
通过氯气微型实验的启发,班上的同学,运用生活中废弃的塑料杯和医用橡胶管组合成一套简易的微型实验仪器来制备并探究氯气的化学性质,具体如下:
按图1 连接好装置。向六个小杯子中分别加入:
1 号杯:加入少量的高锰酸钾固体(垫上锡箔防腐蚀);
2 号杯:加入少量的浓硫酸;
3 号杯:放入一片干燥的红纸片;
4 号杯:放入一片湿润的红纸片;
5 号杯:放入一片湿润的碘化钾淀粉试纸;

图1
6 号杯:加入适量的氢氧化钠溶液。
最后向1 号杯滴入几滴浓盐酸,观察所发生的现象。
基于氯气实验的思考,教师积极引导学生对SO2的综合实验进行思考,提出改进方案,学生根据微型实验设计出实验装置。
(一)该装置的优点
1.用量少,污染小。 SO2是有刺激性气味的有毒气体,常规实验试管口是敞开的,逸散出来,污染空气;
2.现象明显,直观,实验周期短。
(二)该装置的不足之处
不能很好的证明SO2对品红溶液漂白的暂时性和可逆性。 鉴于此,师生提出以下实验:
1.准备阶段
如图2 装置A,连接装置,锥形瓶中加入20mL被SO2漂白后的品红溶液,用注射器a 预先吸入2mL滴有酚酞的红色的氢氧化钠稀溶液,用针尖扎在胶塞上,最后将带有注射器和玻璃导管的胶塞塞紧锥形瓶口,保证气密性完好后备用。
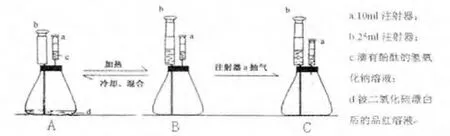
图2
2.操作步骤及现象
(1)SO2的暂时性漂白实验
用酒精灯火焰加热锥形瓶中的无色溶液,可以看到瓶内有气泡产生,溶液颜色逐渐变红。产生的气体充满整个锥形瓶内,随着气体产生量的增多,瓶内压强不断增大,对瓶内的溶液产生压力,进而将瓶中的溶液通过导管压入注射器b 中,同时推动注射器b 的活塞移动。 直到锥形瓶中的溶液全部进入注射器时(如图2B 所示)停止加热。
(2)SO2使品红溶液褪色实验
图2B 装置静置冷却一段时间后, 将注射器b的活塞往里推,让b 中液体进入锥形瓶中,并与瓶内SO2反应,反复推拉几次,直到溶液颜色褪去(如图2A 所示)。 这样又可以重复操作(1)。
(3)验证产生的气体是SO2
重复操作(1)后,这时装置处于图B 状态,把注射器a 的针尖刺穿胶塞,抽取锥形瓶中的气体,直至注射器a 中红色的氢氧化钠溶液变为无色(如图2C所示)。
3.实验反思
(1)探究干燥的SO2气体本身是否能漂白品红
【操作及现象】:按图3 装置进行实验,实验中控制SO2的速度,以每秒钟3 个气泡为宜通入品红的酒精溶液,半小时后,品红酒精溶液不褪色,说明二氧化硫本身与氯气一样,不能直接用于漂白。
(2)探究湿润的SO2气体能否漂白品红
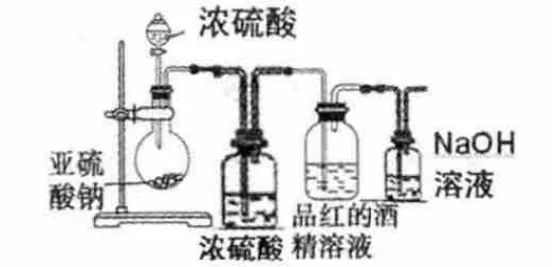
图3
【操作及现象】:实验中控制SO2的速度,以每秒钟3 个气泡为宜通入品红的水溶液,半小时后,品红溶液褪色,说明湿润二氧化硫能直接用于漂白。
(3)探究SO2能使品红溶液褪色的微粒是H2SO3,中的哪一种。
【学生实验】取等体积、相同浓度的品红水溶液于两支试管中,分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,由此,两组同学得出结论:使品红褪色的微粒是不是H2SO3。
【学生实验结果分析】
两组同学分别采用单一变量法进行探究,可是两组同学均忽略了两种盐的水解问题,在两种盐溶液中均有只是量的相对多少而已。
【师生共同设计探究实验】
师生做了进一步探究,具体做法如下:分别取相同浓度的品红水溶液各20mL 于两只小烧杯中,两只烧杯中同时一次性各加入20mL 0.1mol/L 的亚硫酸钠溶液和20mL 0.1mol/L 的亚硫酸氢钠溶液,发现加入亚硫酸钠溶液的品红褪色较快。
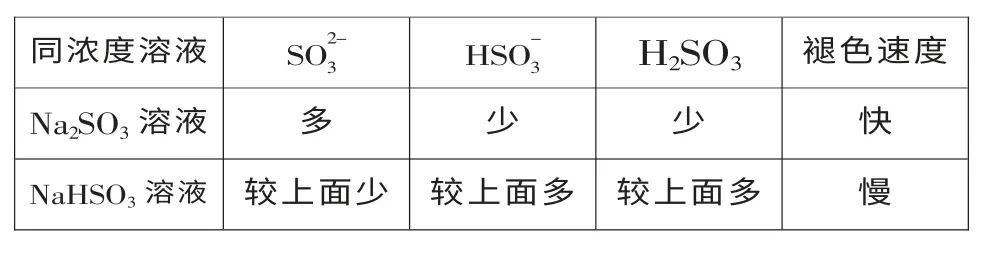
微粒浓度(多少)与褪色快慢的关系如下表所示
三、微型化学实验助推教师专业发展
教师可以在探索的微型实验过程中,加深对实验的综合理解,丰富自我的经验。 教师研制一套微型装置,来反应制取乙烯,用乙烯利溶液为原料制备乙烯。
乙烯利,易溶于水,甲醇,微溶于甲苯,不溶于石油醚。 乙烯利化学名称为2-氯乙基膦酸,在pH 小于3 的酸性溶液中稳定存在,在pH 大于3.5 以及碱性溶液中分解放出乙烯。 乙烯利水解反应方程式为:
【实验结论】
乙烯既能被高锰酸钾氧化,又能与溴发生加成反应,说明乙烯分子中含有不饱和键。
【实验反思】
能使溴水褪色, 一定就能说明乙烯与溴水发生了加成反应吗? 难道没有发生取代反应的可能吗?
【设计思考】比较乙烯和Br2反应的两种反应类型的方程式
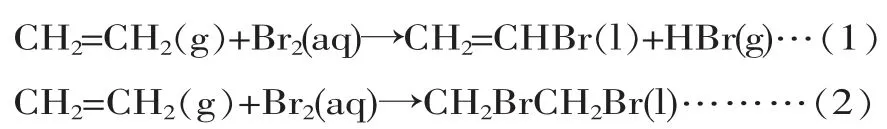
对比结果:
方程式(1)取代反应后溶液呈酸性;反应前后无压强差。 方程式(2)加成反应后溶液接近中性;且反应后有压强差的存在。
【实验设计】
根据反应后溶液的酸碱性不同进行设计。
(1)操作:将干燥的PH 试纸放于表面皿的上,用洁净干燥的玻璃棒蘸取反应后的溶液,点在PH试纸的中央,迅速与标准比色卡对照,观察PH 试纸颜色对应的溶液酸碱性。
(2)现象及结论:PH 呈现出浅绿色;证明溶液接近中性。
(3)实验反思:该实验中如果Br2如果有大量剩余,那必然会干扰溶液酸碱性的检测,所以实验过程中尽量确保Br2尽可能反应充分。 此外,证明溶液显酸性的方法很多,只要言之有理,行之有效均可。
