小鼠卵母细胞减数分裂期间组蛋白乙酰化及其对卵母细胞成熟质量的影响
2014-07-07李静心孟春花朱前明曹少先王慧利
王 婧, 李静心, 孟春花, 朱前明, 刘 勇, 曹少先, 王慧利
(1.南京农业大学动物科技学院,江苏 南京 210095;2.江苏省农业科学院畜牧研究所,江苏 南京 210014;3.阜阳师范学院生命科学学院,安徽 阜阳 236041)
组蛋白乙酰化是表观遗传修饰的重要组成部分,在有丝分裂和减数分裂过程中发挥了重要的生物学功能[1-2]。组蛋白乙酰化与组蛋白去乙酰基酶(HDACs)密切相关,HDACs分为 I、II、III、IV 4 类亚型[3],主要负责组蛋白去乙酰化,并在活性受到抑制后乙酰化水平升高。哺乳动物中的研究多集中于广谱性HDACs抑制剂处理卵母细胞改变乙酰化状态[4-7],对减数分裂过程中具体调控组蛋白乙酰化的HDACs亚型知之不多。
哺乳动物中,生发泡(Germinal vesicle,GV)期卵母细胞组蛋白均高度乙酰化,但对于减数分裂过程中是否存在组蛋白乙酰化/去乙酰化的动态变化,不同研究间存在矛盾[4-11]。此外,利用HDACs抑制剂处理卵母细胞来研究组蛋白乙酰化对发育的影响,不同学者得到的结论并不相同[12-17],分析发现,上述研究所用HDACs抑制剂均为广谱性药物,是否因为这种广谱性抑制导致了对发育影响的不确定性?因此,有必要进一步研究HDACs特异性抑制后组蛋白乙酰化对卵母细胞发育的影响。
本试验以组蛋白H4K12乙酰化为标记,利用免疫荧光技术,首先对小鼠卵母细胞减数分裂过程中组蛋白乙酰化的表达模式进行研究,然后分别利用广谱及特异性HDACs抑制剂处理减数分裂中的卵母细胞,以确定调控组蛋白乙酰化的HDACs亚型。在此基础上,进一步明确减数分裂期间组蛋白乙酰化/去乙酰化的动态变化规律,最后就组蛋白乙酰化对卵母细胞成熟质量的影响进行探讨,以期为阐明哺乳动物卵母细胞减数分裂过程中组蛋白乙酰化的调控机制提供理论基础。
1 材料与方法
试验所需试剂除特殊说明外均购自Sigma试剂公司。
1.1 卵母细胞获取及培养
试验所用6~8周龄ICR小鼠均购自南京市青龙山动物繁殖场,经促性腺激素超排后(10 IU/ml PMSG 48 h),脱颈椎法杀鼠并摘除卵巢,于实体镜下刺破卵泡,收集生发泡(GV)期卵母细胞,M2洗涤后转移到成熟培养液中依试验设计进行培养。成熟培养液为TCM-199(Gibco)添加3.05 mmol/L葡萄糖、0.1%牛血清白蛋白(BSA)、0.91 mmol/L丙酮酸钠、10 ng/ml表皮生长因子(EGF)、0.5 IU/ml促卵泡激素(FSH)、0.5 IU/ml黄体生成素(LH)。培养条件为37℃,5%CO2,100%湿度。
1.2 卵母细胞免疫荧光检测
卵母细胞依试验设计处理完毕后,自培养液中取出并脱去卵丘,4%多聚甲醛室温固定1 h,0.2%Triton X-100(D-PBS配制)处理10~15 min,封闭液(D-PBS含0.2%BSA+0.01%Tween-20)处理1 h,一抗(封闭液稀释)4℃孵育过夜,二抗(封闭液稀释)37℃处理2 h,10μg/ml Hoechst 33342室温染色5 min以标记卵母细胞染色体DNA,染色完毕后将卵母细胞压片经荧光显微镜观察结果并采集图片。其中组蛋白H4K12乙酰化抗体购自Upstate公司,一抗为Rabbit polyclonal anti-acetyl-H4-Lys12,二抗为 FITC-conjugated goat-anti-rabbit IgG,纺锤体微管抗体为FITC-conjugated anti-α-tubulin monoclonal antibodies。
1.3 试验设计
1.3.1 减数分裂期间组蛋白乙酰化状态 超排后获取的GV期卵母细胞放入成熟培养液中,于培养0 h、6 h、16 h将卵母细胞进行免疫荧光染色,分别检测GV、MI、MII期卵母细胞的H4K12乙酰化状态。1.3.2 减数分裂期间调控组蛋白乙酰化的HDACs亚型 超排后获取的GV期卵母细胞分别放入添加广谱及亚型特异性HDACs抑制剂的成熟培养液中,于培养16 h将卵母细胞进行免疫荧光染色,通过检测抑制剂处理后MII期卵母细胞H4K12乙酰化的变化,确定减数分裂期间调控组蛋白乙酰化的HDACs亚型。
1.3.3 减数分裂期间组蛋白乙酰化/去乙酰化间的动态变化规律 在确定调控减数分裂期间组蛋白乙酰化的HDACs亚型的基础上,通过2种方法检测减数分裂期间组蛋白乙酰化/去乙酰化的变化规律:①先正常培养卵母细胞,然后利用亚型特异性HDACs抑制剂处理;②先利用亚型特异性HDACs抑制剂处理卵母细胞,然后撤掉抑制剂进行正常培养。随后通过免疫荧光染色检测相应处理后卵母细胞H4K12乙酰化的变化,确定减数分裂期间组蛋白乙酰化/去乙酰化的动态变化规律。
1.3.4 组蛋白乙酰化对卵母细胞成熟质量的影响
超排后获取的GV期卵母细胞放入对照组和试验组培养液中,对照组不添加HDACs抑制剂,试验组分别添加亚型特异性和广谱性HDACs抑制剂以增加组蛋白乙酰化水平。经培养16 h后,将卵母细胞取出,通过观察第一极体排出情况,检测成熟率的变化;通过纺锤体微管免疫荧光染色,检测纺锤体形态的变化;通过Hoechst 33342染色,检测染色体排列方式的变化。根据上述3个指标的变化,探讨组蛋白乙酰化对卵母细胞成熟质量的影响。
1.4 数据统计
每组试验至少重复3次,每次用卵不少于30枚。试验数据利用SPSS统计软件(SPSS 11.5)的ANOVA模块分析。数据先经LSD转换(百分数t检验)后,进行单因素方差分析。
2 结果
2.1 减数分裂期间组蛋白乙酰化状态
结果(图1)显示,以组蛋白H4K12乙酰化为标记,不同减数分裂阶段的卵母细胞具有不同的乙酰化状态。GV期卵母细胞呈现高度的乙酰化状态,而随减数分裂启动,GV期染色质凝集为致密的染色体,同时发生去乙酰化,在MI期和MII期卵母细胞中均表现为去乙酰化状态。

图1 GV、MI、MII期卵母细胞中组蛋白H4K12的乙酰化状态Fig.1 Acetylation of histone H4K12 in germinal vesicle,metaphase I,melaphase II oocytes
2.2 减数分裂期间调控组蛋白乙酰化的HDACs亚型
以组蛋白H4K12乙酰化为标记,经不同类型HDACs抑制剂处理后,M II期卵母细胞呈现不同的乙酰化状态(图2)。对照组卵母细胞未经抑制剂处理,呈现去乙酰化状态;而利用广谱性HDACs抑制剂TSA(可同时抑制I和II型HDACs,100 nmol/L)处理后,卵母细胞发生乙酰化,表明I和(或)II型HDACs负责卵母细胞乙酰化;进一步利用I型HDACs特异性抑制剂VPA(1 mmol/L)处理后,结果与对照组相同,卵母细胞去乙酰化,表明I型HDACs不参与组蛋白乙酰化;而经II型HDACs特异性抑制剂MC1568(20 μmol/L)处理后,与TSA处理相同,卵母细胞发生乙酰化,这表明II型HDACs负责减数分裂过程中组蛋白乙酰化的调控。
2.3 减数分裂期间组蛋白乙酰化/去乙酰化的动态变化规律
通过2种方法检测卵母细胞减数分裂期间组蛋白乙酰化/去乙酰化的动态变化规律。方法一:获取的新鲜GV期卵母细胞先正常培养12 h,然后经MC1568处理4 h。结果(图3)显示,GV期卵母细胞中组蛋白高度乙酰化,培养12 h后,卵母细胞发生去乙酰化,而在培养12 h后再利用MC1568处理4 h,卵母细胞则重新乙酰化。方法二:获取的新鲜GV期卵母细胞先经MC1568处理12 h,然后撤掉MC1568正常培养4 h。结果(图3)显示,GV期卵母细胞中组蛋白高度乙酰化,MC1568处理12 h后卵母细胞仍然保持乙酰化,而在撤掉MC1568后正常培养4 h,卵母细胞则发生去乙酰化。上述2种方法得到的结果表明,在小鼠卵母细胞减数分裂过程中,存在组蛋白乙酰化/去乙酰化的动态变化。
2.4 组蛋白乙酰化对卵母细胞成熟质量的影响
采用3个指标(成熟率、纺锤体形态和染色体排列方式)反映组蛋白乙酰化对卵母细胞成熟质量的影响。结果显示:培养液中添加20μmol/L MC1568后,卵母细胞的成熟未受影响,成熟率均超过90%(图4);卵母细胞经MC1568处理后,纺锤体形态并未发生明显改变,均表现为典型的纺锤体形态(图5);卵母细胞经MC1568处理后,染色体的排列方式未受影响,呈典型的中期排列形态(图6)。说明II型HDACs特异性抑制剂MC1568处理并未对卵母细胞的成熟质量产生影响。
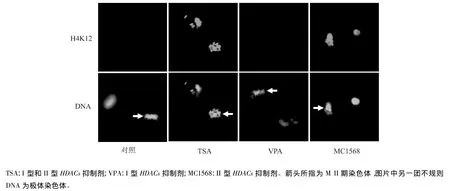
图2 不同种类HDACs抑制剂处理后M II期卵母细胞中组蛋白H4K12的乙酰化状态Fig.2 Acetylation of histone H4K12 in melaphase II oocytes treated with different HDACs inhibitors

图3 减数分裂期间组蛋白乙酰化/去乙酰化的动态变化Fig.3 Dynamic changes in histone acetylation/deacetylation during meiosis

图4 组蛋白乙酰化对卵母细胞成熟率的影响Fig.4 Effects of histone acetylation on rates of oocyte maturation
进一步利用广谱性HDACs抑制剂TSA替代MC1568处理卵母细胞,发现100 nmol/L TSA处理后,卵母细胞的成熟能力和纺锤体结构均未受显著影响,但与对照组及MC1568处理组相比,约有30%的卵母细胞染色体排列方式发生了改变,结构比较松散,分布面积变大(图6)。说明广谱性HDACs抑制剂处理影响了卵母细胞的成熟质量。

图5 组蛋白乙酰化对卵母细胞纺锤体形态的影响Fig.5 Effects of histone acetylation on spindle morphology of oocytes

图6 组蛋白乙酰化对卵母细胞染色体排列的影响Fig.6 Effects of histone acetylation on chromosome alignment of oocytes
3 讨论
组蛋白乙酰化有利于核小体DNA与组蛋白八聚体的解离,使染色体结构松弛,从而促进基因的转录,而组蛋白去乙酰化则可导致组蛋白与DNA紧密结合,染色体致密卷曲,抑制基因转录。本研究中,减数分裂启动后,小鼠卵母细胞由GV期的乙酰化转变为M I和M II期的去乙酰化,并且这种转变伴随着相对松散的染色质凝集为致密的染色体,以及基因转录活动的中止[18],这正体现了组蛋白乙酰化/去乙酰化对染色质(体)结构及基因表达的调控。
研究者多利用广谱HDACs抑制剂处理哺乳动物卵母细胞,通过抑制整个HDACs酶家族的活性,使组蛋白乙酰化水平升高[6-7,11],但对于酶家族内具体发挥作用的HDACs亚型及分子知之不多,目前仅见Endo等初步鉴定了猪卵母细胞中调控组蛋白乙酰化的HDACs类型,发现I型HDACs并非组蛋白去乙酰化所必需[19]。本研究也发现小鼠卵母细胞减数分裂过程中I型HDACs不参与组蛋白的去乙酰化,并且进一步证明II型HDACs发挥了去乙酰化功能。
组蛋白乙酰化/去乙酰化,分别由组蛋白乙酰基转移酶(HATs)和HDACs所催化。HATs和 HDACs存在动态的平衡,当HDACs受到抑制,HATs活化,组蛋白乙酰化;当HATs受到抑制,HDACs活化,组蛋白去乙酰化。本研究通过2种方法从不同侧面确认了小鼠卵母细胞减数分裂过程中存在组蛋白乙酰化/去乙酰化间的动态变化,表明卵母细胞中的HATs和HDACs均具有活性,协同调控组蛋白乙酰化/去乙酰化的变化。但Kim等发现,小鼠卵母细胞正常培养14 h后用TSA处理3 h,组蛋白未重新乙酰化,表明HATs没有活性[7]。我们推测,原因可能在于TSA处理时间较短,HDACs受到抑制后HATs活化需要时间。在进一步重复Kim等的试验后,我们发现TSA处理3 h后,组蛋白乙酰化的确不明显,但延长至4 h,组蛋白重新乙酰化,与本研究结果一致。
利用II型HDACs抑制剂MC1568处理增加乙酰化水平后,小鼠卵母细胞的成熟率、纺锤体结构及染色体排列方式均未受影响,但经广谱抑制剂TSA处理后,染色体的结构变得松散,并且分布面积变大。这在一定程度上验证了前言中的推测,即广谱HDACs抑制剂导致整个HDACs酶家族活性受到抑制,包括与组蛋白乙酰化无关的HDACs酶活性也受到抑制,这可能导致对卵母细胞有益和有害的HDACs分子间存在不同程度的相互抵消,因此产生了对成熟和发育影响的不确定性,导致不同研究者间结论的差异。在进一步明确卵母细胞中发挥作用的HDACs亚型后,就本试验的成熟质量指标而言,特异性升高组蛋白乙酰化对发育并无损害。
综上所述,本研究确定了小鼠卵母细胞中调控组蛋白乙酰化的HDACs亚型,揭示了减数分裂期间存在组蛋白乙酰化/去乙酰化的动态变化,并明确了组蛋白乙酰化对卵母细胞成熟质量的影响,这为提高哺乳动物胚胎体外生产效率及阐明组蛋白乙酰化调控的分子机制提供了参考。
[1] DE LA FUENTE R.Chromatin modifications in the germinal vesicle(GV)of mammalian oocytes[J].Dev Biol,2006,292:1-12.
[2] KOUZARIDEST.Chromatin modifications and their function[J].Cell,2007,128:693-705.
[3] BLACKWELL L,NORRISJ,SUTOCM,et al.The use of diversity profiling to characterize chemical modulators of the histone deacetylases[J].Life Sci,2008,82:1050-1058.
[4] AKIYAMA T,KIM J M,NAGATA M,et al.Regulation of histone acetylation during meiotic maturation in mouse oocytes[J].Mol Reprod Dev,2004,69:222-227.
[5] BUI H T,VAN THUAN N,KISHIGAMI S,et al.Regulation of chromatin and chromosomemorphology by histone H3 modifications in pig oocytes[J].Reproduction,2007,133:371-382.
[6] ENDO T,NAITOK,AOKIF,et al.Changes in histone modifications during in vitro maturation of porcine oocytes[J].Mol Reprod Dev,2005,71:123-128.
[7] KIM JM,LIUH,TAZAKIM,et al.Changes in histone acetylation during mouse oocyte meiosis[J].JCell Biol,2003,162:37-46.
[8] KAGEYAMA S,LIU H,KANEKO N,et al.Alterations in epigenetic modifications during oocyte growth in mice[J].Reproduction,2007,133:85-94.
[9] MAALOUF W E,ALBERIO R,CAMPBELL K H.Differential acetylation of histone H4 lysine during development of in vitro fertilized,cloned and parthenogenetically activated bovine embryos[J].Epigenetics,2008,3:199-209.
[10] TANG L S,WANGQ,XIONGB,et al.Dynamic changes in histone acetylation during sheep oocyte maturation[J].J Reprod Dev,2007,53:555-561.
[11] WANG Q,YINS,AIJS,et al.Histone deacetylation is required for orderly meiosis[J].Cell Cycle,2006,5:766-774.
[12] DE LA FUENTE R,VIVEIROSM M,WIGGLESWORTH K,et al.ATRX,a member of the SNF2 family of helicase/ATPases,is required for chromosome alignment and meiotic spindle organization in metaphase II stage mouse oocytes[J].Dev Biol,2004,272:1-14.
[13] AKIYAMA T,NAGATA M,AOKIF.Inadequate histone deacetylation during oocyte meiosis causesaneuploidy and embryo death in mice[J].Proc Natl Acad Sci USA,2006,103:7339-7344.
[14] MENG Q,POLGARZ,LIUJ,et al.Live birth of somatic cell-cloned rabbits following trichostatin A treatment and cotransfer of parthenogenetic embryos[J].Cloning Stem Cells,2009,11:203-208.
[15] SHI L H,MIAO Y L,OUYANG Y C,et al.Trichostatin A(TSA)improves the development of rabbit-rabbit intraspecies cloned embryos,but not rabbit-human interspecies cloned embryos[J].Dev Dyn,2008,237:640-648.
[16] IAGER A E,RAGINA N P,ROSSP J,et al.Trichostatin A improves histone acetylation in bovine somatic cell nuclear transfer early embryos[J].Cloning Stem Cells,2008,10:371-379.
[17] ZHAO J,ROSSJ W,HAO Y,et al.Significant improvement in cloning efficiency of an inbred miniature pig by histone deacetylase inhibitor treatment after somatic cell nuclear transfer[J].Biol Reprod,2009,81:525-530.
[18] BACHVAROVA R.Gene expression during oogenesis and oocyte development in mammals[J].Dev Biol,1985,1:453-524.
[19] ENDO T,KANO K,NAITO K.Nuclear histone deacetylases are not required for global histone deacetylation during meiotic maturation in porcine oocytes[J].Biol Reprod,2008,78:1073-1080.
