N+注入诱变选育纤维素酶高产菌株及发酵产酶营养因子优化研究
2014-07-05张宁蒋剑春杨静卫民赵剑童娅娟
张宁,蒋剑春,杨静,卫民,赵剑,童娅娟
(中国林业科学研究院林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局林产化学工程重点开放性实验室;江苏省生物质能源与材料重点实验室,江苏南京 210042)
N+注入诱变选育纤维素酶高产菌株及发酵产酶营养因子优化研究
张宁,蒋剑春*,杨静,卫民,赵剑,童娅娟
(中国林业科学研究院林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局林产化学工程重点开放性实验室;江苏省生物质能源与材料重点实验室,江苏南京 210042)
应用低能氮离子(N+)注入技术对纤维素酶产生菌里氏木霉(Trichoderma reesei)进行诱变选育,在能量为10 keV,注量为150×1014和200×1014N+/cm2的条件下分别筛选得到3株纤维素酶高产菌株,连续5代遗传稳定性实验结果表明,所得到的高产菌株遗传稳定性较好,羧甲基纤维素酶活力均提高到3.300 IU/mL以上,较出发菌株(2.698 IU/mL)提高了20.0%以上。采用Plackett-Burman实验设计法和旋转中心组合设计法系统地研究高产菌株150-1-1发酵营养因子组成,得到了纤维素酶产量随葡萄糖、麸皮和微晶纤维素等营养因子的变化规律及相应的响应面分析图。实验结果表明,葡萄糖、麸皮和微晶纤维素浓度与纤维素酶活存在显著的相关性,当葡萄糖浓度为4.9 g/L,麸皮浓度为23.0 g/L,微晶纤维素浓度为7.7 g/L时,150-1-1纤维素酶滤纸酶活力达到2.439 IU/mL,较优化前(2.000 IU/mL)提高了22.0%。
N+离子注入;里氏木霉;纤维素酶
纤维素酶在食品、酿造、纺织、饲料、造纸、石油开采和资源再生等方面具有广泛应用和发展前景。近年来,随着能源和环境问题日益严峻,利用纤维素酶降解纤维素原料生产燃料乙醇新型能源[1]、利用纤维素酶辅助秸秆还田[2]等命题也日益受到关注。然而,目前纤维素酶产酶菌株的活力还较低,导致纤维素酶生产成本过高,限制了其广泛而有效的应用。因此,选育高产、酶性质优良的纤维素酶产酶菌株始终是人们关注的热点。里氏木霉(Trichoderma reesei)是一种高产纤维素酶的丝状真菌,它对人无毒性,在产酶条件下也不产生真菌毒素和抗生素,因其纤维素酶产量高,易于培养和控制,产纤维素酶稳定性好,产生的胞外纤维素酶易于分离纯化,培养及代谢产物安全无毒等特点,常作为生产纤维素酶的菌种。本研究利用低能N+注入诱变技术[3-5]筛选得到3株纤维素酶高产突变株,其产酶能力得到显著提高,并对其发酵产酶营养因子进行优化研究。
1 实验
1.1 菌种
里氏木霉T.reesei CICC 40358购买于中国工业微生物菌种保藏中心。CK-1、CK-2、CK-3和CK-4为T.reesei CICC 40358复壮分离得到的菌株。
1.2 培养基
1.2.1 固体培养基 马铃薯葡萄糖琼脂(PDA)培养基[6]:马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,pH值自然。
1.2.2 种子培养基 马铃薯200 g/L,葡萄糖20 g/L,pH值自然,于121℃灭菌30 min,冷却备用。
1.2.3 选择出发菌株发酵培养基 葡萄糖10.0 g/L,磷酸二氢钾8.0 g/L,磷酸氢二钾3.0 g/L,蛋白胨2.0 g/L,硫酸胺1.5 g/L,酵母膏0.5 g/L,氯化钙0.3 g/L,硫酸镁0.3 g/L,土温-80 0.2 g/L,于121℃灭菌30 min,冷却备用。
1.2.3 筛选高产菌株发酵培养基 麸皮40.0 g/L,微晶纤维素10.0 g/L,葡萄糖10.0 g/L,磷酸二氢钾8.0 g/L,磷酸氢二钾3.0 g/L,蛋白胨2.0 g/L,硫酸胺1.5 g/L,酵母膏0.5 g/L,氯化钙0.3 g/L,硫酸镁0.3 g/L,土温-80 0.2 g/L,于121℃灭菌30 min,冷却备用。
1.3 培养方法
1.3.1 种子培养方法 在250 mL摇瓶中装入50 mL种子培养基,并将培养好的固体培养基上的孢子制备成孢子悬液,接种3 mL(约2.0×108个孢子)到种子培养基中,于28℃,150 r/min震荡培养24 h,制成种子培养液。
1.3.2 发酵方法 在250 mL摇瓶中装入50 mL发酵培养基,将培养好的种子培养液以10%(体积分数)的接种量接种到发酵培养基中,于28℃,150 r/min震荡培养96 h,得到纤维素酶发酵液。
1.4 高产菌株的筛选方法
1.4.1 筛选高产菌株 以N+作为注入离子,以10 keV为注入能量(低能离子束能量范围为10~100 keV),150×1014N+/cm2为注量,对出发菌株进行注入处理。处理后的孢子用无菌生理盐水洗脱,涂布到固体培养基上,在28℃下培养1~2 d,挑选单菌落分别转接到固体培养基上继续培养5~7 d,用于种子培养及纤维素酶发酵实验。发酵结束后测定羧甲基纤维素酶活力,筛选单位体积发酵液中羧甲基纤维素酶活力高的菌株。
1.4.2 遗传稳定性考察 为了确保筛选到的高产菌的遗传稳定性,对其遗传稳定性进行考察。每代实验过程为:高产菌株自然分离→选单菌落→斜面培养→种子培养→发酵,测定纤维素酶的活力。共传5代,每代均做3个平行样。
1.5 羧甲基纤维素酶活力的测定及滤纸纤维素酶活力测定
将发酵液在4 000 r/min条件下离心10 min,分别取上清液1 mL,参考文献[7]方法测定羧甲基纤维素酶活力(CMCase)及滤纸纤维素酶活力(FPase)。其中CMCase反映纤维素酶内切酶活力,测定所需时间较短,所以在菌种诱变筛选过程中以此为测定指标,筛选CMCase高的菌株,提高筛选效率;FPase反映纤维素酶的总酶活,测定所需时间较长,将此作为营养因子优化的衡量指标,以提高纤维素酶的总活力。
2 结果与分析
2.1 出发菌株的选择
纤维素酶是诱导酶,必须在诱导剂的作用下才能大量表达,而葡萄糖作为非诱导剂,在培养基中可以促进菌体生长,但过量存在则会抑制纤维素酶的表达[8]。本研究在选择出发菌株时培养基中不加入诱导剂,以考察菌株在没有诱导的情况下自身产酶的能力,选择自身产酶能力高的作为出发菌株。从结果可以看出,原始出发菌株里氏木霉T.reesei CICC 40358经复壮后分离得到的菌株CK-1、CK-2、CK-3和CK-4的CMCase基本保持在0.50~0.80 IU/mL之间,FPase基本保持在0.07~0.10 IU/mL之间,见表1。实验选取酶活力最高的CK-2作为诱变选育的出发菌株。
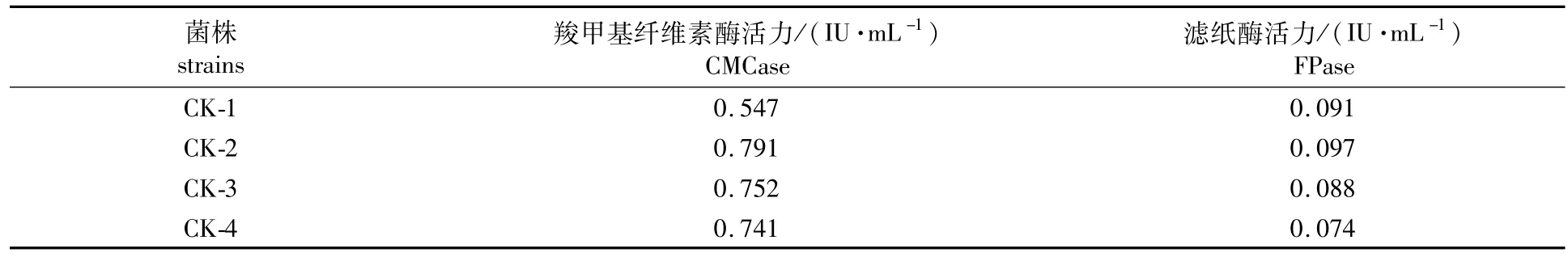
表1 出发菌株产酶活力比较Table 1 Comparison of cellulase activity produced by different original strains
2.2 高产菌株的筛选
2.2.1 筛选谱系 以CK-2作为诱变选育的出发菌株,在培养基中加入麸皮和微晶纤维素,诱导纤维素酶的表达。从实验结果可以看出,加入诱导剂后纤维素酶的活力显著提高。整个诱变过程的诱变筛选图谱见图1。图谱中菌种编号的首组数字表示N+注量,第2组数字表示诱变次数,接着是菌株的编号。如250-2-6表示在注量为250×1014N+/cm2条件下,在第2轮诱变中挑出的第6株高产突变株。经过3次反复注入诱变,获得3株高产突变菌株150-1-1,150-2-2和250-2-6(见粗箭头)。将菌株的羧甲基纤维素酶活力从2.698 IU/mL提高到3.300 IU/mL以上(见表2)。其中150-2-2是突变菌株150-1-1又经过N+注入得到的高产菌株,说明N+注入不仅可以作为诱变技术诱变筛选高产菌株,还可以作为筛选手段维持菌株的遗传稳定性。

图1 纤维素酶高产突变株诱变筛选图谱Fig.1 The mutational spectrum of high-yielding cellulase producing strains
2.2.2 高产菌株的遗传稳定性 在工业生产中所用的菌株,必须具备稳定的遗传特性。对诱变选育得到3株高产突变株进行连续5代遗传稳定性实验,结果见表2。结果表明,3株菌均很好的保持了稳定高产的能力,羧甲基纤维素酶活力维持在3.300 IU/mL以上,较出发菌株CK-2增加了20%以上。

表2 高产突变菌株遗传稳定性结果Table 2 Stability of cellulase production(IU·mL-1)in screened mutants during five generations
2.2.3 高产菌株的发酵特性 高产突变菌株与出发菌株的发酵曲线见图2。发酵前期(0~24 h)原始出发菌株与突变菌株的发酵水平相当,突变菌株产酶能力略高于出发菌株;但发酵中后期高产突变菌株产酶能力表现突出,明显高于原始出发菌株,在96~120 h达到发酵终点,羧甲基纤维素酶活力维持在3.300 IU/mL以上。
2.3 发酵产酶营养因子优化
2.3.1 Plackett-Burman实验设计 以筛选得到的高产菌株里氏木霉T.reesei 150-1-1为实验菌株,采用未经优化的培养基(1.2.3节)发酵此菌株,所得到的滤纸酶活力维持在2.000 IU/mL。根据经验数据[9]选择发酵培养基中微晶纤维素(X1)、麸皮(X2)、磷酸二氢钾(X4)、磷酸氢二钾(X5)、蛋白胨(X6)、硫酸铵(X8)和葡萄糖(X9)7个因素进行考察,而其他成分由于用量较少不在本研究中进行优化。每个因素取-1和1两个水平,高水平取低水平的2倍,进行实验次数N=12的实验,响应值为滤纸酶活力。另设2个虚拟列X3和X7,对应表3中的第3列和第7列,以考察实验误差。

图2 高产突变菌株与出发菌株的发酵曲线Fig.2 Fermentation curves of mutant stains and original strain
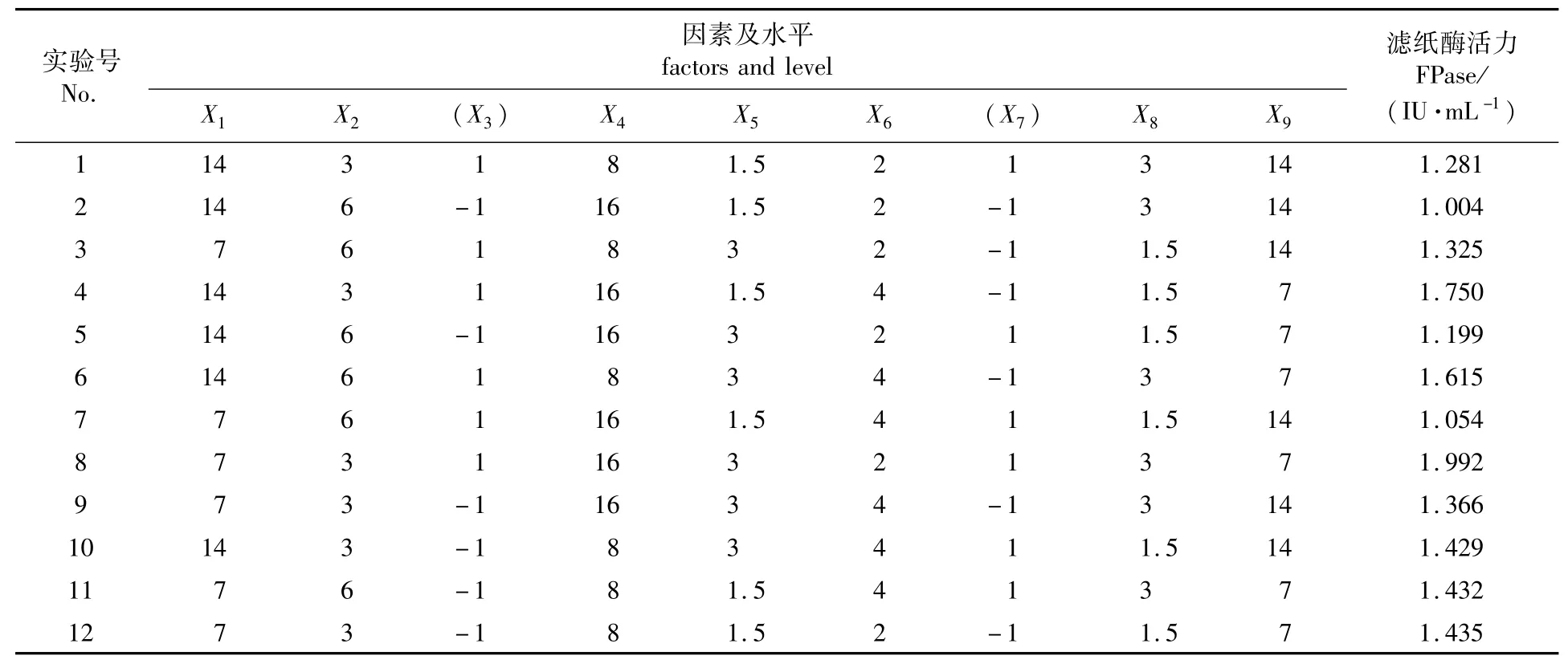
表3 N=12的Plackett-Burman实验设计与结果1)Table 3 Plackett-Burman design and its results
2.3.2 Plackett-Burrman实验筛选影响产酶主要营养因子 根据里氏木霉生长所需营养要素的基本原则和发酵影响因素的一般规律,结合相关的文献报道[10]和作者的前期实验结果选取微晶纤维素、麸皮等7个因素进行Plackett-Burman实验,并对实验结果进行分析,得出各因素的T值和可信度水平[11]。实验设计及实验结果见表3,各因素主效应分析结果见表4。由表4的显著性分析结果可知,在T.reesei产纤维素酶过程中,葡萄糖、麸皮和微晶纤维素对产酶影响显著,可考虑作为主要因素进行下一步实验;此外在上述7个影响产酶的相关因素中,只有磷酸氢二钾呈正效应,在下一步实验中,将其取值固定在高水平,其他因素取值则固定在低水平。
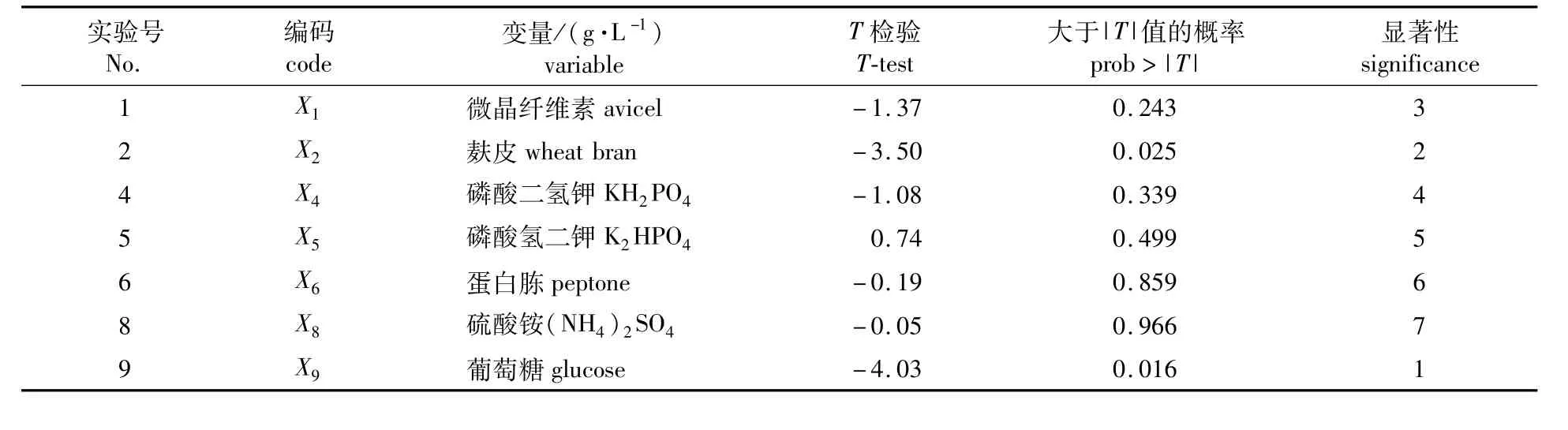
表4 Plackett-Burman实验设计的因素水平及效应分析Table 4 Level,code of variable and results of Plackett-Burman design
2.3.3 最陡爬坡实验 根据Plackett-Burrman实验结果设计主要影响因素的最陡爬坡路径,其中葡萄糖、麸皮和微晶纤维素均呈负效应(见T检验结果),应减小。根据这3个因素效应大小的比例设定它们的变化方向及步长进行实验,设计及结果如表5所示。由结果可知,最优发酵条件可能在实验3与实验4之间,故以实验3的条件为响应面实验的中心点。

表5 最陡爬坡实验设计及其实验结果Table 5 Path of the steepest ascent experiment design and its result
2.3.4 响应面分析实验优化发酵培养基营养因子组成 依据Plackett-Burrman实验和最陡爬坡实验确定的显著影响T.reesei产酶发酵的因子及水平,采用旋转中心组合实验设计法对其显著影响因子进行3因素5水平的响应面分析实验,以葡萄糖(X′1)、麸皮(X′2)和微晶纤维素(X′3)浓度为自变量,以滤纸酶活为响应值,实验设计及结果见6。
分析后的实验结果以如下的二阶经验模型对变量的相应行为进行表征:
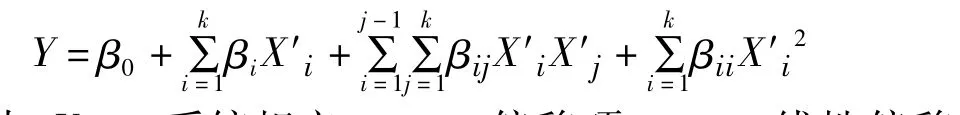
式中:Y——系统相应;β0——偏移项;βi——线性偏移系数;βii——二阶偏移系数;βij——交互效应系数;X′i——各因素水平值。
按照上述设计的方案进行2组实验,取滤纸酶活的平均值作为实验结果。应用Statistica软件,将表中16个实验点的结果进行回归分析,确定葡萄糖、麸皮和微晶纤维素浓度3个因子对T.reesei 150-1-1产酶的影响,方程如下:

式中:X′1——葡萄糖的编码水平;——麸皮的编码水平;——微晶纤维素的编码水平。上述回归方程式中、和的系数均为负值,抛物线的开口朝下,具有极大值点。对方程进行方差分析,经F检验,回归方程中一次项、二次项对纤维素酶产量影响显著(大于F值的概率小于0.05),另外,回归方程的R2=0.966 3,表明了96%的实验数据变异性可用此回归模型来解释,说明所拟合的回归方程拟合度良好,失拟较小,可以用该方程替代实验点结果进行分析。通过上述回归方程绘制三维响应面图,见图3,图中所示的响应面证实了拟合面有真实的最大值,即各具体因子都有一个最适宜的浓度。对上述滤纸酶活的二次回归方程取一阶偏导,令其等于零并整理得:X′1=-0.556,X′2=-0.695,X′3=0.871,即当葡萄糖质量浓度4.9 g/L,麸皮23.0 g/L和微晶纤维素7.7 g/L时,理论最大滤纸酶活为2.450 IU/mL。

表6 纤维素酶发酵培养基旋转中心组合实验设计及其结果Table 6 Experimental design and results of central composite rotatable design(CCRD)for cellulase fermentation medium

图3 各因素交互作用交互对滤纸酶活力的影响Fig.3 Effects of interaction of several factors on FDase
2.3.5 纤维素酶最优发酵营养因子组成及验证实验 根据优化实验结果得到最优的发酵营养因子组成为:葡萄糖4.9 g/L,麸皮23.0 g/L,微晶纤维素7.7 g/L,磷酸二氢钾8.0 g/L,磷酸氢二钾3.0 g/L,蛋白胨2.0 g/L,硫酸铵1.5 g/L,酵母膏0.5 g/L,氯化钙0.3 g/L,硫酸镁0.3 g/L,土温-80 0.2 g/L。在此优化条件下进行验证实验,3批摇瓶发酵实验测得的纤维素酶滤纸酶活力分别为2.43、2.48和2.41 IU/mL,平均值为2.44 IU/mL,实验值与模拟值相差0.45%,可见该模型可以较好的预测实际发酵情况;优化后T.reesei 150-1-1滤纸酶活力较优化前(2.00 IU/mL)提高了22.0%,从而也证明了响应面优化纤维素酶发酵条件的可行性。
3 结论
低能离子注入技术对纤维素酶产生菌T.reesei具有较好的诱变效果,合适的注量可以使纤维素酶产生菌的产酶能力得到明显的提高。
3.1 应用低能N+注入技术对纤维素酶产生菌T.reesei进行诱变选育,在能量为10 keV,注量为150×1014和250×1014N+/cm2的条件下分别筛选得到3株纤维素酶高产菌株,即150-1-1、150-2-2和250-2- 6;连续5代遗传稳定性实验结果表明,所得到的高产菌株遗传稳定性较好,羧甲基纤维素酶活力均提高到3.300 IU/mL以上,较出发菌株(2.698 IU/mL)提高20%以上。
3.2 应用Plackett-Burman实验设计法和旋转中心组合设计法优化高产菌株150-1-1发酵营养因子组成,最优的发酵营养因子组成为:葡萄糖4.9 g/L,麸皮23.0 g/L,微晶纤维素7.7 g/L,磷酸二氢钾8.0 g/L,磷酸氢二钾3.0 g/L,蛋白胨2.0 g/L,硫酸铵1.5 g/L,酵母膏0.5 g/L,氯化钙0.3 g/L,硫酸镁0.3 g/L,土温-80 0.2 g/L,在此优化条件下T.reesei 150-1-1滤纸酶活力达到2.439 IU/mL,较优化前(2.000 IU/mL)提高22.0%。
[1]SASSNER P,GALBE M,ZACCHI G.Techno-economic evaluation of bioethanol production from three different lignocellulosic materials[J].Biomass Bioenergy,2008,32(5):422-430.
[2]韩玮,聂俊华,李飒.外源纤维素酶在秸秆还田上的应用研究[J].河南农业科学,2005,(11):70-73.
[3]刘国生,赵婷,王秀强,等.N+注入诱变筛选阿拉伯糖利用缺陷型肌苷高产菌株[J].中国医药工业杂志,2008,39(7):504-506.
[4]张敏,赵丛,路福平,等.N+注入中性蛋白酶高产菌株诱变选育的研究[J].浙江大学学报,2008,34(3):245-248.
[5]靳孝庆,周华,吴薛明,等.丙酮-丁醇发酵生产菌的快速筛选方法[J].过程工程学报,2008,8(6):1185-1198.
[6]微生物学实验[M].北京:高等教育出版社,2007:241-242.
[7]GHOSE T.Measurement of cellulase activities[J].Pure and Applied Chemistry,1987,58(2):257-268.
[8]刘松,李祝,周礼红,等.响应面法优化黑曲霉产纤维素酶的发酵条件[J].食品科学,2013,34(17):225-229.
[9]苗长林,罗文,吕鹏梅,等.脂肪酶产生菌微波-亚硝基胍复合诱变及培养条件优化高产纤维素酶菌株的筛选及其产酶条件研究[J].林产化学与工业,2013,33(5):30-34.
[10]谭非,林咏梅,王素梅,等.响应面法优化磷酸法酸析造纸黑夜中的木质素[J].生物质化学工程,2014,48(2):8-12.
[11]张宗和,闵凡芹,秦清,等.超声波辅助提取五蒬子单宁酸的响应面优化实验[J].生物质化学工程,2012,46(6):17-20.
Screening of High-producing Cellulase Strain by Low Energy N+Implantation and Optimization of Fermentation Nutrient Factors
ZHANG Ning,JIANG Jian-chun,YANG Jing,WEI Min,ZHAO Jian,TONG Ya-juan
(Institute of Chemical Industry of Forest Products,CAF;National Engineering Lab.for Biomass Chemical Utilization;Key and Open Lab.of Forest Chemical Engineering,SFA;Key Lab.of Biomass Energy and Material,Jiangsu Province,Nanjing 210042,China)
Cellulase producing strain Trichoderma reesei was mutated by low energy N+implantation.When the implantation energy was 10 keV,and the implantation doses were 150×1014and 200×1014N+/cm2,three high yield mutant strains were obtained.Their cellulase yield reached 3.300 IU/mL,and improved over 20.0%than that of original strain(2.698 IU/mL).Furthermore,mutant strains had better heredity stability after five passages.Plackett-Burman and central composite rotatable design experiment were applied to optimize the concentration of nutrient factors for cellulase production.The changing patterns of glucose,wheat bran and microcrystalline cellulose were obtained,and the corresponding response surface analysis diagram were also obtained.Experimental results showed that glucose,wheat bran and microcrystalline cellulose had an individual significant influence on cellulose production.The optimum concentration of nutrient factors for cellulase production was 4.9 g/L of glucose,23.0 g/L of wheat bran,and 7.7 g/L of microcrystalline cellulose.Under the optimized conditions,the cellulase yield of T.reesei 150-1-1 reached 2.439 IU/mL,with a 22%increase than that before optimization.
N+ion implantation;Trichoderma reesei;cellulase
TQ 352;Q815
A
1673-5854(2014)04-0028-07
10.3969/j.issn.1673-5854.2014.04.006
2014-01-23
国家自然科学基金资助项目(31100429)
张宁(1978—),女,吉林白城人,副研究员,博士,主要从事生物质能源及工业微生物研究工作
*通讯作者:蒋剑春(1955—),男,研究员,博士,博士生导师,从事林产化学加工和生物质能源开发技术研究;E-mail:bio-energy@163.com。
