脓毒症致大鼠急性肾损伤中炎症介质的变化及机制探讨
2014-07-05李徽徽汪华学柴继侠
李徽徽 汪华学 柴继侠 高 琴
(1蚌埠医学院组织学与胚胎学教研室;2蚌埠医学院第一附属医院重症医学科,安徽 233004;3生理学教研室,安徽 233030)
脓毒症(Sepsis)是严重创伤、休克等常见的并发症,进一步发展可导致脓毒性休克、多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),病死率高达30-50%。肾脏是脓毒症患者最易受损的脏器之一,易引起急性肾损伤(acute kidney injury,AKI)的发生[1]。脓毒症致 AKI的病理生理机制可能与缺血/再灌注损伤、炎症瀑布效应、细胞凋亡等损伤密切相关。因此本研究通过盲肠结扎穿孔法(cecal ligation and puncture,CLP)建立脓毒症致AKI大鼠模型,探讨不同病程阶段大鼠血清和肾脏组织中炎症介质的变化,并观察肾脏组织中NF-κB的表达,为临床防治脓毒症致AKI提供新的治疗靶点。
材料和方法
1.试剂与材料
健康雄性SD(Sprague Dawley)大鼠,体重250-300g,由蚌埠医学院实验动物中心提供,动物合格证号:0005237,许可证号:SCXK2009(苏)-0001。NF-κB p65兔抗鼠多克隆抗体、免疫组化SP试剂盒、DAB显色剂均购自武汉博士德生物科技有限公司。大鼠TNF-α和IL-6定量ELISA试剂盒购自美国R&D公司;Trizol试剂盒购自Invitrogen公司;逆转录试剂盒和PCR试剂盒购自MBI Fermentas公司;引物(TLR4、HMGB1、β-actin)均由上海生物工程公司合成。引物序列见表1。
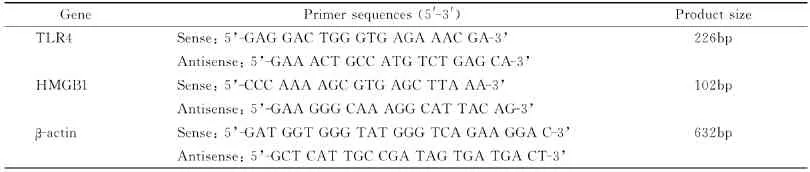
表1 各种基因引物序列Table1 The primer squences for each gene
2.动物模型建立与分组
2.1 分组
健康雄性SD鼠36只。适应性饲养1周后随机分为假手术组(Sham组)和盲肠结扎穿孔组(CLP组)。每组各18只,再随机分为3个时间点(6h、12 h和24h),每组每时间点各6只。各时间点采集大鼠血液及肾脏组织标本,各个时间点之前死亡的大鼠排除在外。
2.2 大鼠脓毒症模型的建立
雄性SD大鼠,术前禁食12h,自由饮水。4%水合氯醛1ml/100g腹腔注射麻醉,固定、消毒、铺巾,采用Rittirsch D等[2]的方法,腹部正中切开1.5cm,轻柔地找出盲肠,CLP组用3-0丝线结扎盲肠根部(避免结扎回肠及盲肠系膜血管),并用无菌18G针头对穿两次,轻挤出少量肠内容物以保证戳孔的通畅性。之后,按生理位置还纳盲肠,逐层缝合关闭腹腔。术毕,立即给大鼠皮下注射生理盐水2ml/100g抗休克。术后大鼠允许自由饮水、进食。Sham组除不结扎和穿孔盲肠外,其余操作均同CLP组。
3标本的采集及检测方法
3.1 血标本的采集
右侧颈总动脉采血4ml,台式离心机4℃,3000 rpm/min离心15min后,收集血清,-80℃冰箱保存。ELISA检测大鼠血清TNF-α和IL-6水平。
3.2 RT-PCR检测大鼠肾脏组织中TLR4和HMGB1mRNA表达
肾脏组织(皮质兼髓质)100mg,采用Trizol一步法提取总RNA,取总RNA 4μg,反转录合成cDNA,以cDNA 1μl为模板,进行PCR扩增。扩增条件:95℃预变性3min,随后①95℃50s变性,②β-actin退火温度59.4℃50s;TLR4退火温度59.3℃50s;HMGB1退火温度56.0℃50s,③72℃60s,反应30个循环,最后一轮延伸10min。将4μl PCR扩增产物与1μl溴酚兰混匀,于质量浓度为15g/L的琼脂糖凝胶电泳,溴化乙锭(EB)显色。在GIS凝胶处理系统中拍摄记录,使用图像分析软件对凝胶中每一泳带进行半定量分析,以目的基因与内参对照的吸光度比值(TLR4/β-actin;HMGB1/β-actin)表示mRNA相对表达量。
3.3 免疫组化测定肾小管中NF-κB p65的表达
取部分肾脏组织(皮质兼髓质)置于4%多聚甲醛固定液中固定。石蜡包埋,切成5μm薄片,脱蜡、水化,枸橼酸盐高温修复抗原,过氧化氢封闭。一抗4℃过夜。二抗室温孵育,DAB显色,苏木精复染细胞核,盐酸乙醇分化,氨水反蓝,脱水、透明、封片。高倍显微镜下随机观察十个视野,肾小管细胞核中出现NF-κB p65棕色颗粒的细胞数占肾小管细胞总数的百分比为NF-κB p65核阳性率。以NF-κB p65核阳性率反映NF-κB的活化程度。
4统计分析
实验数据以均数±标准差(±s)表示,采用方差分析,q检验和t检验进行统计学分析。
结 果
1.各组大鼠血清 TNF-α和IL-6水平
随时间延长,Sham组大鼠血清TNF-α和IL-6水平无明显差异(P>0.05),CLP组大鼠血清TNF-α和IL-6水平先有明显升高,然后迅速降低(P<0.01)。与同时间点Sham组比较,CLP组6h和12h大鼠血清TNF-α和IL-6水平明显升高(P<0.01),24h大鼠血清 TNF-α和IL-6水平差异无统计学意义(P>0.05)(表2)。
表2 各组大鼠血清TNF-α和IL-6水平(ni=6;±s)Table2 The levels of TNF-αand IL-6in serum of different groups(ni=6;±s)
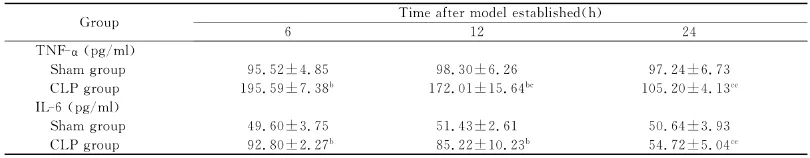
表2 各组大鼠血清TNF-α和IL-6水平(ni=6;±s)Table2 The levels of TNF-αand IL-6in serum of different groups(ni=6;±s)
b,与同时间点Sham组比较,p<0.01;c,与同组6h组比较,p<0.01;e,与同组12h组比较,p<0.01。b,versus time-matched Sham group,p<0.01;c,versus group-matched 6hgroup,p<0.01;e,versus group-matched 12hgroup,p<0.01.
Group Time after model established(h)6 12 24 TNF-α(pg/ml)Sham group 95.52±4.85 98.30±6.26 97.24±6.73 CLP group 195.59±7.38b 172.01±15.64bc 105.20±4.13ce IL-6(pg/ml)Sham group 49.60±3.75 51.43±2.61 50.64±3.93 CLP group 92.80±2.27b 85.22±10.23b 54.72±5.04ce
2.各组大鼠肾脏组织中TLR4mRNA表达
随时间延长,Sham组大鼠肾脏组织中TLR4 mRNA的表达无显著差别(P>0.05),CLP组大鼠肾脏组织中TLR4mRNA先升高,至12h达到高峰,随后开始下降(P<0.01~P<0.05)。与同时间点Sham组比较,CLP组各时间点大鼠肾脏组织中TLR4mRNA的表达均高于Sham组(P<0.01)(表3,图1)。
表3 各组大鼠肾脏组织中TLR4mRNA和HMGB1mRNA的表达(ni=6;±s)Table3 The expressions of TLR4mRNA and HMGB1mRNA in kidney tissue of different groups(ni=6;±s)

表3 各组大鼠肾脏组织中TLR4mRNA和HMGB1mRNA的表达(ni=6;±s)Table3 The expressions of TLR4mRNA and HMGB1mRNA in kidney tissue of different groups(ni=6;±s)
与同时间点Sham组比较,b P<0.01;与同组6h组比较,c P<0.01;与同组12h组比较,d P<0.05,e P<0.01。b P<0.01versus time-matched Sham group;c P<0.01versus group-matched 6hgroup;d P<0.05versus group-matched 12hgroup;e P<0.01versus group-matched 12hgroup.
Group Time after model established(h)6 12 24 TLR4/β-actin Sham group 0.18±0.02 0.17±0.02 0.17±0.03 CLP group 0.31±0.06b 0.57±0.90bc 0.48±0.06bcd HMGB1/β-actin Sham group 0.30±0.06 0.31±0.06 0.29±0.04 CLP group 0.34±0.07 0.48±0.05bc 0.62±0.06bce
3.各组大鼠肾脏组织中HMGB1mRNA表达
随时间延长,Sham组大鼠肾脏组织中HMGB1 mRNA的表达无显著差别(P>0.05),CLP组大鼠肾脏组织中HMGB1mRNA的表达逐渐升高(P<0.01)。与同时间点Sham组比较,CLP组12h和24h大鼠肾脏组织中HMGB1mRNA的表达明显高于Sham组(P<0.01)(表3,图2)。
4.各组大鼠肾小管中NF-κB p65的表达
Sham组各时间组大鼠肾小管中NF-κB p65的表达均位于胞浆中,淡染,为弱阳性表达,胞核中极少或没有阳性表达(P>0.05)。CLP组随时间延长大鼠肾小管中NF-κB p65棕色颗粒逐渐出现在细胞核中,NF-κB p65核阳性率逐渐升高。与同时间点Sham组比较,CLP组6h、12h和24h大鼠肾小管中NF-κB p65核阳性率高于Sham组(P<0.05~P<0.01)(表4,图3)。
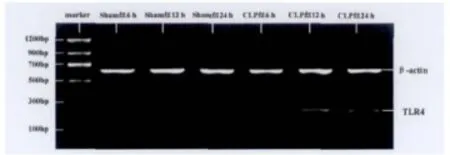
图1 各组大鼠肾脏组织中TLR4mRNA琼脂糖凝胶电泳图Fig.1 TLR4mRNA agarose gel electrophoresis of different groups
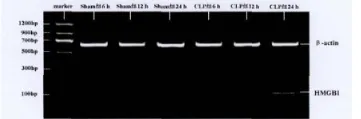
图2 各组大鼠肾脏组织中HMGB1mRNA琼脂糖凝胶电泳图Fig.2 HMGB1mRNA agarose gel electrophoresis of different groups
表4 各组大鼠肾小管中NF-κB p65核阳性率(ni=6;±s)Table4 The nuclear positive rates of NF-κB p65in renal tubules of different groups(ni=6;±s)
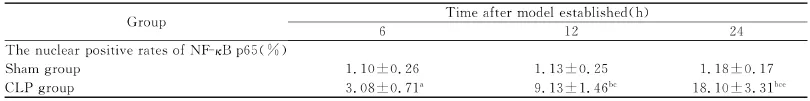
表4 各组大鼠肾小管中NF-κB p65核阳性率(ni=6;±s)Table4 The nuclear positive rates of NF-κB p65in renal tubules of different groups(ni=6;±s)
a,b,与同时间点Sham组比较,p<0.05,p<0.01;c,与同组6h组比较,p<0.01;e,与同组12h组比较,p<0.01。a,versus time-matched Sham group,p<0.05;b,versus time-matched Sham group,p<0.01;c,versus group-matched 6hgroup,p<0.01;e,versus group-matched 12hgroup,p<0.01.
Group Time after model established(h)6 12 24 The nuclear positive rates of NF-κB p65(%)Sham group 1.10±0.26 1.13±0.25 1.18±0.17 CLP group 3.08±0.71a 9.13±1.46bc 18.10±3.31bce
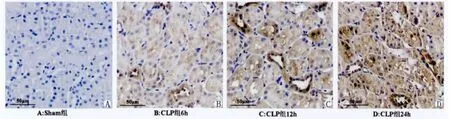
图3 各组大鼠肾小管中NF-κB p65的表达(SP×400)A:Sham组大鼠肾小管中NF-κB p65的表达;B:CLP组6h大鼠肾小管中NF-κB p65的表达;C:CLP组12h大鼠肾小管中NF-κB p65的表达;D:CLP组24h大鼠肾小管中NF-κB p65的表达。Fig.3 The expression of NF-κB p65in rat renal tubules of different groups(SP×400)A:The expression of NF-κB p65in rat renal tubules of Sham group;B:The expression of NF-κB p65in rat renal tubules of CLP group at 6hour;C:The expression of NF-κB p65in rat renal tubules of CLP group at 12hour;D:The expression of NF-κB p65in rat renal tubules of CLP group at 24hour.
讨 论
脓毒症是机体在感染因素的作用下产生的失控的自我放大和自我破坏的全身炎症反应综合征。盲肠结扎穿孔(CLP)是复制脓毒症模型的经典方法之一,通过有菌的肠内容物从盲肠穿孔处溢出,污染腹腔造成弥漫性腹膜炎,诱发机体全身性、破坏性炎性反应,复制出多种微生物感染的脓毒症模型[3],是迄今为止最贴近临床脓毒症病理生理过程的动物模型[4],被认为是脓毒症研究动物模型的“金标准”。肾脏是脓毒症最常受累的器官之一,有实验证实CLP术后可以引起大鼠血清肌酐和尿素氮显著增高,肾小体中血管球淤血、皱缩,肾小囊腔扩大,肾小管上皮细胞肿胀,肾脏组织中炎性细胞浸润等,导致急性肾损伤[5]。
脓毒症的核心是全身炎症反应与代偿性抗炎反应的失衡,炎症介质在其发病机制中起着关键作用。早期释放的炎症介质如TNF-α,IL-6等可以引起机体损伤和死亡,对判断脓毒症的严重程度起到重要作用。脓毒症感染时所释放的毒素以及活化的炎症细胞释放的炎症介质都可以作用于机体的防御系统,激活具有信号转导功能的TLR4,经过一系列级联信号传递,激活NF-κB及丝裂原活化蛋白激酶(MAPK)等细胞内信号转导通路,继而启动TNF-α、IL-1β、IL-6、IL-8等促炎细胞因子和黏附分子等基因的转录。这些炎症介质又可以进一步激活机体的防御系统,二者互为因果,形成炎症瀑布(inflammatory cascade),造成炎症介质持续过度释放,最终导致以细胞自身破坏为特征的全身性炎症反应综合征 (systemic inflammatory response syndrome,SIRS)。本研究中观察到脓毒症致AKI早期,大鼠血清TNF-α水平明显升高,并刺激机体释放IL-6,扩大生物学效应,6~12h大鼠血清TNF-α和IL-6水平达到一个峰值,随着大鼠腹腔感染的进一步加重,TNF-α和IL-6水平并未持续升高,反而迅速降低,至24h逐渐恢复至正常水平,而此时正是腹腔感染的高峰期。由于TNF-α和IL-6具有释放早,恢复快的特性,作为早期炎症介质难以用于临床监测。而且这些促炎细胞因子表达水平的变化不能完全客观的反映机体脓毒症的严重状况,也不适用于疗效的观察和预后的判断。
1999年Wang等首次提出.HMGB1作为关键的晚期炎症介质参与了脓毒症的发病过程,且比早期炎症介质如TNF-α和IL-6等具有更大的临床意义。Janus激酶/信号转导与转录激活子(Janus kinase/signal transducers and activators of transcription,JAK/STAT)信号通路是HMGB1转录的重要通路。有研究表明[6],脓毒症感染时所释放的毒素及炎症介质都可以通过激活TLR4,进而经过JAK,IFN-β,STAT-1等生物分子传递信号,通过 TLR4/IFN-β/STAT-1信号轴最终引起 HMGB1的释放。本研究中也观察到伴随脓毒症致AKI大鼠肾脏组织中TLR4mRNA表达的升高,肾脏组织中HMGB1mRNA表达逐渐升高,当TLR4mRNA表达升高达到高峰后,随后开始下降,而HMGB1 mRNA表达依然升高,可能与HMGB1和单核/巨噬细胞分泌TNF-α和IL-6等炎症介质相互诱导,正反馈式扩大全身炎症反应有关。同时也证实了HMGB1作为关键性晚期炎症介质,相对于TNF-α、IL-6等早期炎症介质而言,具有释放晚、维持峰值时间长等特点[7],为临床的监测和治疗提供了新的“靶点”和“时间窗”。
NF-κB在肾小体中系膜细胞、内皮细胞,肾小管上皮细胞和由血循环浸润的血液免疫细胞均存在转录调控。脓毒症感染时,释放的毒素以及炎症介质,通过激活TLR4介导的细胞内传导,使无活性的p50/p65/IκB三聚体上IκB发生构象改变,被IκB抑制的NF-κB游离出来,成为有活性的NF-κB。同时HMGB1可与晚期糖基化终末产物受体(receptor for advanced glycation end-products,RAGE)结合,激活受体酪氨酸激酶途径(Ras)和丝裂原活化蛋白激酶途径(MAPK),导致NF-κB活化。激活的NF-κB迅速穿过核孔,进入细胞核,启动 TNF-α,IL-6等细胞因子的基因表达,这些细胞因子又进一步激活NF-κB,使其活性进一步增强,形成正反馈的级联放大效应。因此,NF-κB的激活是触发过度炎症反应的关键环节,在脓毒症的发病过程中起着重要作用。本次研究观察到,Sham组各组大鼠肾小管中NF-κB p65在静息状态下,以无活性复合物形式存在于细胞质中,着色较浅,胞核中极少或没有NF-κB p65阳性表达,CLP组由于腹腔的感染、毒素的刺激、TNF-α水平和 HMGB1表达升高等因素,NF-κB被激活,移位进入细胞核内,NF-κB p65核阳性率逐渐增加。且随着病程延长,肾小管中NF-κB p65的核阳性率明显增加,并与肾脏组织中HMGB1mRNA表达呈正相关,提示肾脏组织内的NF-κB与HMGB1密切相关,可能参与了脓毒症致AKI的病变过程。
脓毒症感染释放的毒素,炎症介质等都可激活TLR4介导的炎症通路,通过激活髓样分化因子88(myeloid differentiation factor,Myd88)依赖性和非依赖性信号转导通路,从而激活下游的MAPK信号转导通路和 NF-κB信号通路[8-9],激活 NF-κB,诱导TNF-α和IL-6等炎症介质的释放。此外激活的TLR4通过JAK/STAT信号通路引起HMGB1释放,释放的HMGB1可以与RAGE结合,活化NF-κB,加速炎症介质的过度释放,这些炎症介质又能与HMGB1相互诱导,正反馈式扩大全身炎症反应,出现炎症瀑布,在炎症反应后期对维持炎症反应起到了重要的作用。因此,探索TLR4信号通路介导的脓毒症致AKI大鼠血清和肾脏组织中炎症介质的改变和肾脏组织中NF-κB的表达,为研究脓毒症致AKI的病理生理过程奠定了基础,为临床上治疗脓毒症致AKI提供了实验依据。
[1]Zarjou A,Agarwal A.Sepsis and acute kidney injury.J Am Soc of Nephrol,2011,22(6):999-1006
[2]Rittirsch D,Huber-Lang MS,Flierl MA,et al.Immu-nodesign of experimental sepsis by cecal ligation and puncture.Nat Protoc,2009,4(1):31-36
[3]Doi K,Hu X,Yuen PS,et al.AP214,an analogue of alpha-melanocyte-stimulating hormone, ameliorates sepsis-induced acute kidney injury and mortality.Kidney Int,2008,73(11):1266-1274
[4]Hubbard WJ,Choudhry M,Schwacha MG,et al.Cecal ligation and puneture.Shock,2005,24(SuPPl 1):52-57
[5]李徽徽,陈晓蓉,汪华学等.脓毒症大鼠肾脏结构和功能的改变及NF-κB的表达.蚌埠医学院学报,2013,38(5):524-527
[6]Kim JH,Kim SJ,Lee IS,et al.Bacterial endotoxin induces the release of high mobility group box 1via the IFN-beta signaling pathway.J Immunol,2009,182(4):2458-2466
[7]Wang H,Ward MF,Sama AE.Novel HMGB1-inhibiting therapeutic agents for experimental sepsis.Shock,2009,32(4):348-357
[8]Akira S,Takeda K.Toll-like receptor signaling.Nat Rev Immunol,2004,4(7):499-511
[9]Zhu XM,Yao YM,Liang HP,et al.High mobility group box-1protein regulate immunosuppression of regulatory T cells through toll-like receptor 4.Cytokine,2011,54(3):296-304
