母系遗传耳聋家系核心成员MTO1基因的突变筛查
2014-07-04耿雪侠张海军单祥年
耿雪侠,张 立,张海军,单祥年
(1.淮北师范大学 生命科学学院,安徽 淮北 235000;2.东南大学医学院,江苏 南京 210009)
A1555G突变是最早发现、最常见的与母系遗传非综合征耳聋相关的人类线粒体DNA突变[1-2].大量证据表明,A1555G突变携带者具有临床表型上的异质性,而临床表型的差异可用阈值模式来解释,即当环境因素、核修饰基因突变和线粒体基因突变3 者协同作用的结果达到或超过阈值时则表现出耳聋症状,反之则表型正常[1].虽然,已有学者在寻找核修饰基因方面做了许多有益的工作,但目前仍未找到一个可确证的核修饰基因[3-8].
2002年,Li和Guan等根据酵母的Mto1基因(mitochondrial translation optimization 1 homolog,MTO1)克隆并鉴定了人类的MTO1 基因.通过生化功能分析,他们认为MTO1 基因可能是影响线粒体12S rRNA A1555G突变的核修饰基因[9-10].但他人在西班牙、芬兰等A1555G突变相关母系遗传耳聋家系的研究中并未找到与耳聋表型相关的序列变化[11-12].
江苏省淮阴市方氏母系遗传非综合征耳聋大家系是目前世界范围内发现的最大遗传性耳聋家系之一[13-14].前期的研究表明认为线粒体DNA上1 555位点A→G的突变是该家系母系成员耳聋的重要原因之一[15-17].但在该家系中A1555G突变致聋的高外显率(57%)问题上仍无法得到圆满的解释[17].鉴于淮阴母系遗传非综合征耳聋大家系与国内外其他家系A1555G 突变的来源不同及非综合征耳聋的高度异质性[18],我们对淮阴母系遗传非综合征耳聋大家系10例母系成员(5例听力正常,5例具有严重耳聋症状)的MTO1基因进行研究,以期确认MTO1基因是否可以作为该家系的核修饰基因.
1 材料与方法
1.1 研究对象
选择该大家系中成员齐全、临床资料详尽、外显率最高的一分支家系为研究对象(见图1).根据纯音听阈、声导抗及听性脑干反应的检测结果,选择母系成员中5 例具有严重耳聋症状的个体(II4、III1、III5、III13和IV11,他们的PTA>90 dB)和5 例听力正常个体(IV6、IV10、IV13、IV14和V1,他们的PTA<20 dB)作为研究对象.用药史调查显示他们均未曾口服或肌肉注射过庆大霉素或链霉素等氨基糖甙类药物.
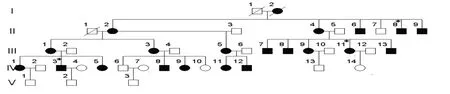
图1 核心家系图■ 男性耳聋患者;● 女性耳聋患者;□ 男性听力正常个体;○ 女性听力正常个体;* 氨基糖甙类药物后耳聋患者Fig.1 Nuclear pedigree of the Chinese extensive family with hearing loss■ male hearing loss;● female hearing loss;□ male normal hearing;○ female normal hearing;* exposure to aminoglycosides
1.2 MTO1基因突变的筛查
人类MTO1基因全长40 439 bp,包括12个外显子和11个内含子,外显子长度从118-522 bp不等,最短的内含子仅有92 bp,而最长的内含子可达9 614 bp.根据MTO1 基因序列(Genbank Accession No.NM_133645)及有关文献[10-11],用Oligo6软件设计并合成了8对引物,用于扩增MTO1基因的12个外显子及外显子与内含子交界区.引物序列及扩增片段长度见表1.PCR反应体系:10×PCR 缓冲液5.0 μL,25 mmol/L dNTPs 0.4 μL,25 mmol/L MgCl24.0 μL,25 mmol/L 上、下游引物各0.6 μL,DNA模板2.0 μL,补灭菌双蒸水至总体积 50.0 μL.PCR 反应条件:采用热启动并Touchdown 程序.94 ℃预变性4 min 后,加入高保真Taq DNA 聚合酶(TaKaRa公司)0.4 μL(2U),94 ℃ 50 sec,63 ℃ 50 sec,-0.5 ℃/循环,72 ℃ 1 min,12个循环;94 ℃ 50 sec,56 ℃ 50 sec,72 ℃ 1-1.5 min,25 个循环,72 ℃延伸10 min,4 ℃保存.1.0 %琼脂糖凝胶电泳检测扩增产物,纯化后PCR产物送上海生工生物科技测序.

表1 扩增MTO1基因引物Table 1 Primers used to PCR amplify the MTO1 gene
2 结果
2.1 MTO1基因的PCR扩增结果
PCR 产物电泳后显示扩增片段大小与预测结果一致,空白对照无相应扩增产物,排除了外源DNA的污染(见图2).
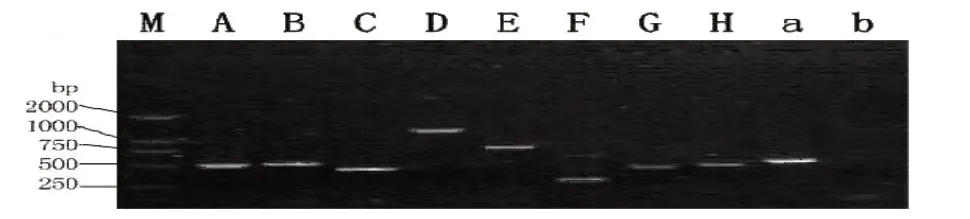
图2 MTO1基因的PCR扩增结果M,DL2000 marker;A-H为8对引物序号;a 阳性对照;b 阴性对照Fig.2 Gel image of PCR product for MTO1 geneM,DL2000 marker;A-H,8 pairs of PCR primers;a positive control;b negative control
2.2 测序结果
测序结果经DNAstar 软件中的Seqman 程序处理后,并与标准序列(Genbank Accession No.NM_133645)比对,发现5例具有严重耳聋症状患者的MTO1基因与5例听力正常个体的MTO1基因相应序列完全一致;且与MTO1标准序列相比,无任何序列变化.
3 讨论
人类MTO1基因是酵母Mto1基因的同源基因,为编码线粒体蛋白的核基因.在酵母细胞中,单独的线粒体15S rRNA上的PR454突变(C1477G)无明显异常的表型,只有当突变的核Mto1基因和突变的线粒体15S rRNA 上的PR454 突变(C1477G)同时存在时,酵母细胞才表现为呼吸功能缺陷.而15S rRNA 上的PR454突变(C1477G)与人类的12S rRNA上的A1555G突变相对应.同时,人类的MTO1基因cDNA可以补偿带有PR454突变(C1477G)和Mto1基因突变酵母细胞的呼吸功能缺陷.另外,虽然人类的MTO1基因在多种组织中都有表达,但在包括耳蜗在内的高耗能组织中表达量明显升高,且有多种不同的剪接方式.因此,他们认为人类的MTO1基因可能是影响12S rRNA A1555G突变的核修饰基因[9-10].
2003年,Finnila等对一芬兰A1555G突变相关耳聋家系成员的MTO1基因进行了研究,结果仅在外显子5和外显子6间的内含子区发现了一个A→G的同质型替换,且该序列变化在所有的家系成员中都存在,并不与耳聋表型共分离.因此,他们认为,人类的MTO1基因可能不是线粒体A1555G突变的核修饰基因[11].2004 年,Bykhovskaya 等在MTO1 基因两侧各选择了一个STR(D6S280、D6S1596)对西班牙、意大利和阿拉伯-以色列的31个A1555G 突变相关非综合征耳聋家系中的214 个个体进行了两点或多点非参数分析及连锁不平衡检验,结果显示MTO1基因与耳聋表型可能存在连锁关系(最高LOD值为2.84);结合MTO1基因参与线粒体RNA修饰及其存在不同剪接体等性质,Bykhovskaya等认为MTO1基因可能参与了线粒体A1555G突变的表型修饰.但遗憾的是他们并未找到与耳聋症状相关的突变或序列变化[12].
在本实验中,我们对来自淮阴线粒体A1555G 突变相关耳聋家系中的5例正常母系成员和5 例耳聋患者的MTO1基因进行了研究,但在MTO1基因的编码区及内含子与外显子交接区均未发现任何序列变化,推测MTO1基因可能不对该家系A1555G突变具有核修饰效应.
[1]PREZANT T R,AGAPIAN J V,Bohlman M C,et al.Mitochondrial ribosomal RNA mutation associated with both anti⁃biotic-induced and nonsyndromic deafness[J].Nat Genet,1993,4:289–294.
[2]张婷,曾爱平,郑静,等.与耳聋相关的线粒体12S rRNA突变[J].中国生物化学与分子生物学报,2012,28(4):316-325.
[3]刘日渊,赵辉.核修饰基因在线粒体遗传性聋发病中的作用及机制研究[J].中华耳科学杂志.2013,11(1):160-164.
[4]GUAN M X,FISCHEL-GHODSIAN N,ATTARDI G.Biochemical evidence for nuclear gene involvementin phenotype of non-syndromic deafness associated with mitochondrial 12S rRNA mutation[J].Human Molecular Genetics,1996,5:963-971.
[5]GUAN M X,FISCHEL-GHODSIAN N,ATTARDI G.Nuclear background determines biochemical phenotype in the deafness-associated mitochondrial 12S rRNA mutation[J].Hum Mol Genet,2001,10:573–580.
[6]BYKHOVSKAYA Y,SHOHAT M,EHRENMAN K,et al.Evidence for complex nuclear inheritance in a pedigree with non-syndromic deafness due to a homoplasmic mitochondrial mutation[J].American Journal of Medical Genetics,1998,77:421–426.
[7]BYKHOVSKAYA Y,YANG H,TAYLOR K,et al.Modifier locus for mitochondrial DNA disease:Linkage and linkage disequilibrium mapping of a nuclear modifier gene for maternally inherited deafness[J].Genetics in Medicine,2001,3:177–180.
[8]BYKHOVSKAYA Y,ESTIVILL X,TAYLOR K,et al.Candidate locus for a nuclear modifier gene for maternally inher⁃ited deafness[J].Am J Hum Genet,2000,66:1905-1910.
[9]LI XM,GUAN MX.A human mitochondrial GTP binding protein related to tRNA modification may modulate pheno⁃typic expression of the deafness-associated Mitochondrial 12S rRNA mutation[J].Mol Cell Biol,2002,22:7701 -7711.
[10]LI XM,LI RH,GUAN MX.Isolation and characterization of the putative nuclear modifier gene MTO1 involved in the pathogenesis of deafness-associated mitochondrial 12S rRNA A1555G mutation[J].J Biol Chem,2002,277:27256-27264.
[11]FINNILA S,MAJAMAA K.Lack of modulative factor in locus 8p23 in finnish family with nonsyndromic sensorineu⁃ral hearing loss associated with the 1555A>G mitochondrial DNA mutation[J].European Journal of Human Genet⁃ics,2003,11:652-658.
[12]BYKHOVSKAYA Y,MENGESHA E,WANG D.Phenotype of non-syndromic deafness associated with the mitochon⁃drial A1555G mutation is modulated by mitochondrial RNA modifying enzymes MTO1 and GTPBP3[J].Mol Genet Metab,2004,83(3):199-206.
[13]卜行宽.常染色体显性遗传性感音性聋的大家系听力学调查[J].中华耳鼻咽喉科杂志,1992,27:40.
[14]郭汉璧,谭振涛,林敏,等.显性遗传性聋—大家系研究[J].中国优生与遗传学杂志,1994,2(2):94-100.
[15]邢光前,卜行宽,严明,等.母系遗传性聋大家系听力学调查及线粒体DNA突变分析[J].中华耳鼻咽喉科杂志,2000,35(2):98-101.
[16]严明,刘宁生,单祥年,等.一个母系遗传非综合征耳聋大家系及mtDNA12SrRNA 基因突变研究[J].中华医学遗传学杂志,1999,16(5):321-325.
[17]ZHANG Haijun,XU Chunhong,ZHANG Yiju,et al.Sequence analysis of the mitochondrial genome from an exten⁃sive family with matrilineal nonsyndromic deafness in Huaiyin[J].Chin J Med Genet,2005,22(4):368-371.
[18]赵苏瑛,张海军,徐春宏,等.核基因参与人类线粒体12S rRNA突变相关非综合征耳聋的临床表型[J].分子细胞生物学报,2006,39(1):39-45.
