肥大细胞在哮喘气道损伤及重塑中的作用机制
2014-07-02张慧云钱久荣沈道明张应爱何韶衡
张慧云,钱久荣,沈道明,张应爱,何韶衡
(1.苏州市相城人民医院中心实验室,江苏苏州 215131;2.海南医学院病理生理学教研室,海南海口 571101;3.海口市人民医院中心实验室,海南海口 570000;4.南京医科大学第一附属医院临床实验研究中心,江苏南京210029)
·综述·
肥大细胞在哮喘气道损伤及重塑中的作用机制
张慧云1,2,钱久荣1,沈道明1,张应爱3,何韶衡4
(1.苏州市相城人民医院中心实验室,江苏苏州 215131;2.海南医学院病理生理学教研室,海南海口 571101;3.海口市人民医院中心实验室,海南海口 570000;4.南京医科大学第一附属医院临床实验研究中心,江苏南京210029)
过敏性哮喘是机体将原本正常的免疫识别过程无限放大的过敏性炎症反应所导致的疾病。由于气道的损伤及重塑既是哮喘的特征又直接关系到哮喘的发展和预后。本文就过敏性炎症效应阶段的核心细胞-肥大细胞在哮喘时气道损伤和重塑中的作用机制做一综述。
肥大细胞;哮喘;气道重塑;过敏
过敏性哮喘的病理生理学基础是过敏性炎症,而发生过敏性炎症的一个重要原因就是机体将原本正常的免疫识别过程无限的放大,从而导致疾病甚至迅速死亡。过敏性炎症传统的免疫识别过程(图1)为:过敏原→抗原提呈细胞→T细胞活化→B细胞活化→特异性IgE分泌增加→IgE与肥大细胞(嗜碱性粒细胞?)表面的FCεRI受体结合|←诱导阶段‖效应阶段→|再次进入体内的过敏原与肥大细胞表面的IgE结合→肥大细胞脱颗粒→启动病理过程。从这个过程来看,只有效应细胞被激活,过敏性疾病才会发生,而肥大细胞无可争议的是过敏性炎症效应阶段的核心细胞,被称为初始效应细胞(Primary effector cells)。

图1 过敏性炎症传统的免疫识别过程
1 气道的损伤及重塑在哮喘发病机制中的作用
气道的损伤及重塑在哮喘气道过敏性炎症发生过程中的重要作用早在20年前就已经被发现。损伤主要由初始效应细胞即肥大细胞、次级效应细胞嗜酸性粒细胞及中性粒细胞、巨噬细胞、激活的T细胞,及“结构”细胞如上皮细胞、成纤维细胞、平滑肌细胞等释放出的炎症性介质、细胞因子、趋化因子引起;主要表现为血管通透性增强、黏液分泌增加、上皮脱落、气道狭窄[1]。重塑主要表现在支气管黏膜增厚、上皮下纤维化、血管增生、平滑肌层增厚,从而引起不可逆的肺功能丧失和气道高反应性[2-3]。但迄今为止人们对哮喘气道损伤及重塑的发生发展过程及机制的认识还十分有限。
2 肥大细胞在哮喘中气道损伤与重塑中的作用
2.1 肥大细胞在气道损伤中的作用由于气道的损伤及重塑直接关系到哮喘的发展和预后,基于了解其发生机制而开发必要的干预策略的研究成为受关注的热点。近年来,多项研究成果使人们认识到肥大细胞在哮喘的慢性气道炎症、重塑、临床症状形成中起重要作用[4]。人们先后发现[2,5-36],肥大细胞的数量在哮喘气道中明显增加,且有脱颗粒现象;肥大细胞特异性分泌产物肝素、组胺、类胰蛋白酶、类糜蛋白酶、白三烯C4、前列腺素D2以及非特异性分泌产物血小板活化因子(PAF)、激肽酶原等均具有强力的增强血管通透性的作用;组胺、类胰蛋白酶、类糜蛋白酶、PAF、前列腺素D2以及肥大细胞分泌的多种细胞因子IL-3、4、5、8、13、17、22、25、29、31、33,肿瘤坏死因子(TNF),胸腺间质来源的淋巴生成素(TSLP),粒-巨噬细胞集落刺激因子(GM-CSF),嗜酸细胞活化趋化因子(Eotaxin),正常T细胞表达和分泌因子(RANTES),基质金属蛋白酶(MMP)能诱导嗜酸性粒细胞、中性粒细胞等炎症性细胞募集;类糜蛋白酶、组胺、白三烯C4具有刺激支气管上皮细胞间杯状细胞黏液分泌增强的作用;类胰蛋白酶和类糜蛋白酶具有诱导上皮损伤的作用。上述研究表明肥大细胞积极参与哮喘时气道损伤的病理生理过程,见表1。

表1 肥大细胞介质、细胞因子促进气道损伤的作用
2.2 肥大细胞在哮喘气道重塑中的作用
2.2.1 肥大细胞参与哮喘气道重塑的病理生理过程有关肥大细胞参与哮喘气道重塑的研究[2,36-43]显示,肥大细胞具有促进过敏原诱导的哮喘鼠气道黏膜下组织纤维化的作用,并能刺激人皮肤纤维细胞增殖、胶原合成增加,提示在肥大细胞与哮喘的气道重塑间有密切的联系。哮喘患者气道平滑肌间肥大细胞的浸润与气道功能障碍有关;与非哮喘者相比,死于哮喘的患者气道平滑肌间有明显肥大细胞浸润和肥大细胞脱颗粒;哮喘患者黏膜下腺体间脱颗粒的肥大细胞数量增加与腺体增大有关。上述研究提示肥大细胞与气道平滑肌增生、黏液腺增大有直接联系。同时,肥大细胞分泌的多种产物如介质、细胞因子等都积极参与哮喘气道重塑的病理生理过程(见表2)。
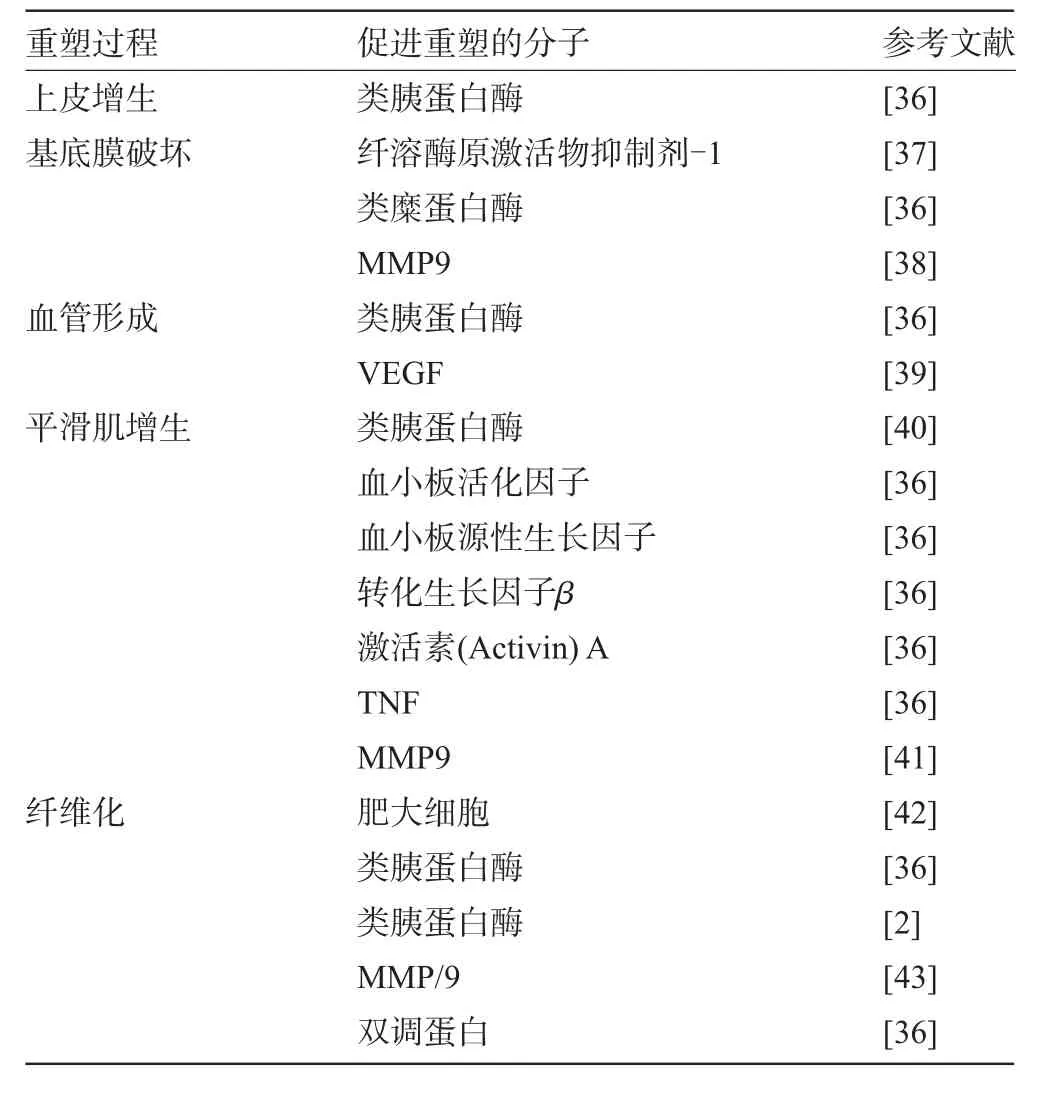
表2 肥大细胞介质、细胞因子促进气道重塑的作用
2.2.2 肥大细胞与气道平滑肌相互作用参与哮喘气道重塑关于肥大细胞参与哮喘气道重塑的机制研究[36,40,41]发现人肺肥大细胞在气道平滑肌分泌的趋化因子的作用下向气道平滑肌迁移,哮喘患者肺肥大细胞表面表达的最丰富的趋化因子受体是CXCR3 (平滑肌间肥大细胞表达率达100%,黏膜下肥大细胞表达率达47%),气道平滑肌培养物能够通过激活人肺肥大细胞CXCR3使之迁移。肥大细胞一旦迁移到气道平滑肌细胞间,便与气道平滑肌细胞发生粘附使肥大细胞停留于此并与气道平滑肌细胞发生相互作用。研究显示原代培养肥大细胞紧密地粘附于单层培养的气道平滑肌细胞上,且不被ICAM-1、VCAM-1、CD8、整合素α-4和整合素β-1等粘附分子抗体阻断。
关于肥大细胞如何诱导气道平滑肌细胞肥大和增生的机制研究[36]显示,肥大细胞特异性分泌产物类胰蛋白酶能够促进气道平滑肌细胞增生进而参与气道重塑。哮喘患者肺肥大细胞分泌的激活素(Activin)能够促进人气道平滑肌细胞增生。肥大细胞产生的血小板源性生长因子(PDGF)和转化生长因子β也能促进气道平滑肌细胞增生。
2.2.3 肥大细胞与气道杯状细胞相互作用参与哮喘气道重塑有关肥大细胞促进杯状细胞增生的机制研究[42-44]显示,在小鼠体内,过敏原诱导产生的IL-4,13、9,解聚素(Disintegri),金属蛋白酶(Metalloprotease)和表皮生长因子(EGF)能够上调黏蛋白基因表达;但在人体内,仅肥大细胞分泌的IL-9和EGF家族成员-双调蛋白(Amphiregulin,AREG)能够上调上皮细胞黏蛋白基因表达,AREG还具有促进哮喘患者支气管黏膜杯状细胞增生和人肺成纤维细胞增生的作用。
3 肥大细胞激活的自身放大机制假说
2004年,我们提出了《肥大细胞激活的自身放大机制假说》[45],其具体内容为人体内肥大细胞被过敏原激活后,释放出肥大细胞特异性类胰蛋白酶和组胺[46],被释放出的类胰蛋白酶再通过其特异性受体,蛋白酶激活受体-2激活相邻的肥大细胞[47];而组胺则通过它的H1和H2受体激活相邻的肥大细胞,从而产生肥大细胞脱颗粒的“瀑布效应”(图2)。为解释微量的过敏原进入体内即可引起严重的过敏反应提供了新的思路。此外,我们还发现哮喘病人支气管肺泡灌洗液中的肥大细胞与非哮喘者肺及大肠的肥大细胞相比,对过敏原刺激的敏感性增强100倍[48]。从而进一步揭示了哮喘易感病人的发病基础,为理解肥大细胞在哮喘发病机制中的作用提供了新信息。尽管我们的这篇文章已经被他人引用160余次,近年来的研究也越来越多的支持我们的假说,但是到目前为止,这个假说的内容还很肤浅,有待在今后的工作中得到进一步证实。

图2 肥大细胞激活的自身放大机制假说
4 结语
终上所述,人们对肥大细胞在哮喘气道损伤及重塑中的作用已经有了一些认识,但是远远没有发现其作用的规律及机制。掌握肥大细胞在哮喘气道损伤及重塑中的作用机制,有助于对此类疾病的理解,开发出行之有效的新疗法。
[1]Royce SG,Tang ML.The effects of current therapies on airway remodeling in asthma and new possibilities for treatment and prevention[J].Curr Mol Pharmacol,2009,2(2):169-181.
[2]Amin K.The role of mast cells in allergic inflammation[J].Respir Med,2012,106(1):9-14.
[3]Yu M,Tsai M,Tam SY,et al.Mast cells can promote the development of multiple features of chronic asthma in mice[J].J Clin Invest,2006,116(6):1633-1641.
[4]Chiappara G,Gagliardo R,Siena A,et al.Airway remodelling in the pathogenesis of asthma[J].Curr Opin Allergy Clin Immunol,2001, 1(1):85-93.
[5]Carroll NG,Mutavdzic S,James AL.Increased mast cells and neutrophils in submucosal mucous glands and mucus plugging in patients with asthma[J].Thorax,2002,57:677-682.
[6]Ward C,Pais M,Bish R,et al.Airway inflammation,basement membrane thickening and bronchial hyperresponsiveness in asthma [J].Thorax,2002,57(4):309-316.
[7]He S,Walls AF.Human mast cell tryptase:a stimulus of microvascular leakage and mast cell activation[J].Eur J Pharmacol,1997, 328(1):89-97.
[8]He S,Walls AF.The induction of a prolonged increase in microvascular permeability by human mast cell chymase[J].Eur J Pharmacol,1998,352(1):91-98.
[9]Hui Y,Cheng Y,Smalera I,et al.Directed vascular expression of human cysteinyl leukotriene 2 receptor modulates endothelial permeability and systemic blood pressure[J].Circulation,2004,110(21): 3360-3366.
[10]Nishimura H,Tokuyama K,Inoue Y,et al.Acute effects of prostaglandin D2 to induce airflow obstruction and airway microvascular leakage in guinea pigs:role of thromboxaneA2 receptors[J].Prostaglandins Other Lipid Mediat,2001,66(1):1-15.
[11]Schwartz LB.Mediators of human mast cells and human mast cell subsets[J].AnnAllergy,1987,58(4):226-235.
[12]Foster AP,Cunningham FM.Histamine-induced adherence and migration of equine eosinophils[J].Am J Vet Res,1998,59(9): 1153-1159.
[13]He S,Peng Q,Walls AF.Potent induction of a neutrophil and eosinophil-rich infiltrate in vivo by human mast cell tryptase:selective enhancement of eosinophil recruitment by histamine[J].J Immunol,1997,159(12):6216-6225.
[14]He S,Walls AF.Human mast cell chymase induces the accumulation of neutrophils,eosinophils and other inflammatory cells in vivo [J].Brit J Pharmacol,1998,125(7):1491-1500.
[15]Ishiura Y,Fujimura M,Nobata K,et al.In vivo PAF-induced airway eosinophil accumulation reduces bronchial responsiveness to inhaled histamine[J].Prostaglandins Other Lipid Mediat,2005,75(1-4):1-12.
[16]Malaviya R,Abraham SN.Role of mast cell leukotrienes in neutrophil recruitment and bacterial clearance in infectious peritonitis[J]. J Leukoc Biol,2000,67(6):841-846.
[17]Whelan CJ.Evidence that 13-14 di-hydro,15-keto prostaglandin D (2)-induced airway eosinophilia in guinea-pigs is independent of interleukin-5[J].Inflamm Res,2009,58(2):103-108.
[18]Shakoory B,Fitzgerald SM,Lee SA,et al.The role of human mast cell-derived cytokines in eosinophil biology[J].J Interferon Cytokine Res,2004,24(5):271-281.
[19]Ozdemir C,Akdis M,Akdis CA.T-cell response to allergens[J]. Chem ImmunolAllergy,2010,95:22-44
[20]Molfino NA,Gossage D,Kolbeck R,et al.Molecular and clinical rationale for therapeutic targeting of interleukin-5 and its receptor [J].Clin ExpAllergy,2012,42(5):712-737.
[21]Chen R,Ning G,Zhao ML,et al.Mast cells play a key role in neutrophil recruitment in experimental bullous pemphigoid[J].J Clin Invest,2001,108(8):1151-1158.
[22]Venkayya R,Lam M,Willkom M,et al.The Th2 lymphocyte products IL-4 and IL-13 rapidly induce airway hyperresponsiveness through direct effects on resident airway cells[J].Am J Respir Cell Mol Biol,2002,26(2):202-208.
[23]Horvat JC,Starkey MR,Kim RY,et al.Chlamydial respiratory infection during allergen sensitization drives neutrophilic allergic airways disease[J].J Immunol,2010,184(8):4159-4169.
[24]Takahashi K,Hirose K,Kawashima S,et al.IL-22 attenuates IL-25 production by lung epithelial cells and inhibits antigen-induced eosinophilic airway inflammation[J].J Allergy Clin Immunol,2011, 128(5):1067-1076.
[25]Wisniewski JA,Borish L.Novel cytokines and cytokine-producing T cells in allergic disorders[J].Allergy Asthma Proc,2011,32(2): 83-94.
[26]He S,Zhang H,Chen H,et al.Expression and release of IL-29 by mast cells and modulation of mast cell behavior by IL-29[J].Allergy,65(10):1234-1241.
[27]Cornelissen C,Lüscher-Firzlaff J,Baron JM,et al.Signaling by IL-31 and functional consequences[J].Eur J Cell Biol,2012,91 (6-7):552-566.
[28]Eiwegger T,Akdis CA.IL-33 links tissue cells,dendritic cells and Th2 cell development in a mouse model of asthma[J].Eur J Immunol,2011,41(6):1535-1538.
[29]Willart MA,Hammad H.Alarming dendritic cells for allergic sensitization[J].Allergol Int,2010,59(2):95-103.
[30]Nakae S,Suto H,Berry GJ,et al.Mast cell-derived TNF can promote Th17 cell-dependent neutrophil recruitment in ovalbumin-challenged OTII mice[J].Blood,2007,109(9):3640-3648.
[31]Bischoff SC,Ulmer FA.Eosinophils and allergic diseases of the gastrointestinal tract[J].Best Pract Res Clin Gastroenterol,2008,22 (3):455-79.
[32]Ozaki A,Fukushima A,Fukata K,et al.Mast-cell activation augments the late phase reaction in experimental immune-mediated blepharoconjunctivitis[J].Graefes Arch Clin Exp Ophthalmol, 2003,241(5):394-402.
[33]He S,Zheng J.Stimulation of mucin release from airway epithelial cells by mast cell chymase[J].Acta Pharmacol Sin,2004,25(6): 827-832.
[34]Takeyama K,Tamaoki J,Nakata J,et al.Effect of oxitropium bromide on histamine-induced airway goblet cell secretion[J].Am J Respir Crit Care Med,1996,154(1):231-236.
[35]Shimizu T,Hirano H,Majima Y,et al.A mechanism of antigen-induced mucus production in nasal epithelium of sensitized rats.A comparison with lipopolysaccharide-induced mucus production[J]. Am J Respir Crit Care Med,2000,161(5):1648-1654.
[36]Okayama Y,Ra C,Saito H.Role of mast cells in airway remodeling [J].Curr Opin Immunol,2007,19(6):687-693.
[37]Oh CK.Mast cell mediators in airway remodeling[J].Chem ImmunolAllergy,2005,87:85-100.
[38]Suzuki R,Miyazaki Y,Takagi K,et al.Matrix metalloproteinases in the pathogenesis of asthma and COPD:implications for therapy[J]. Treat Respir Med,2004,3(1):17-27.
[39]Zanini A,Chetta A,Saetta M,et al.Chymase-positive mast cells play a role in the vascular component of airway remodeling in asthma[J].JAllergy Clin Immunol,2007,120(2):329-33.
[40]Berger P,Perng DW,Thabrew H,et al.Tryptase and agonists of PAR-2 induce the proliferation of human airway smooth muscle cells[J].JAppl Physiol,2001,91(3):1372-1379.
[41]Ceresa CC,Knox AJ,Johnson SR.Use of a three-dimensional cell culture model to study airway smooth muscle-mast cell interactions in airway remodeling[J].Am J Physiol Lung Cell Mol Physiol, 2009,296(6):1059-1066.
[42]Masuda T,Tanaka H,Komai M,et al.Mast cells play a partial role in allergen-induced subepithelial fibrosis in a murine model of allergic asthma[J].Clin ExpAllergy,2003,33(5):705-713.
[43]Margulis A,Nocka KH,Wood NL,et al.MMP dependence of fibroblast contraction and collagen production induced by human mast cell activation in a three-dimensional collagen lattice[J].Am J Physiol Lung Cell Mol Physiol,2009,296(2):L236-247.
[44]Garbuzenko E,Nagler A,Pickholtz D,et al.Human mast cells stimulate fibroblast proliferation,collagen synthesis and lattice contraction:a direct role for mast cells in skin fibrosis[J].Clin Exp Allergy,2002,32(2):237-246.
[45]He S.Key role of mast cells and their major secretory products in inflammatory bowel disease[J].World J Gastroenterol,2004,10(3): 309-318.
[46]He S,Gaca MDA,Walls AF.A role for tryptase in the activation of human mast cells:modulation of histamine release by tryptase and inhibitors of tryptase[J].J.Pharmacol[J].Exp Ther,1998,286: 289-297.
[47]He S,Aslam A,Gaca MD,et al.Inhibitors of tryptase as mast cell-stabilizing agents in the human airway:Effects of trypatse and other agonists of proteinase-activated receptor 2 on histamine release[J].J Pharmacol Exp Ther,2004,309:119-126.
[48]Xie H,He S,Chen P.Selectively enhanced sensitivity of bronchoalveolar lavage fluid(BALF)mast cells to IgE dependent stimulation in mild asthmatics[J].Asian Pac JAllergy,2003,21:83-88.
R562.2+5
A
1003—6350(2014)03—0376—04
2013-07-29)
10.3969/j.issn.1003-6350.2014.03.0144
国家自然科学基金资助项目(编号:81241135,81060250,81172836,81030054);苏州市科技计划项目(编号:SYS201272);海南省自然科学基金(编号:309115);海口市重点科技资助项目编号:(2009-SKG-18-046)
何韶衡。E-mail:shoahenghe@hotmail.com
