1株聚磷菌株的鉴定及其积累聚–β–羟基丁酸酯的条件
2014-07-02赵美金子靖李博刘哲君赵敏孙艺萍
赵美,金子靖,李博,刘哲君,赵敏,孙艺萍
(东北林业大学生命科学学院,黑龙江 哈尔滨150040)
1株聚磷菌株的鉴定及其积累聚–β–羟基丁酸酯的条件
赵美,金子靖,李博,刘哲君,赵敏*,孙艺萍
(东北林业大学生命科学学院,黑龙江 哈尔滨150040)
从SBR活性污泥中筛选、分离出1株有聚–β–羟基丁酸酯(PHB)积累能力的聚磷细菌(将其命名为“LB4”),通过形态、生理生化及16S rDNA方法分析,鉴定该聚磷细菌为鲍曼不动杆菌(Acinetobacter baumannii)。采用厌氧、好氧交替培养方法,研究影响其积累聚–β–羟基丁酸酯 (PHB)的因素。结果表明:在厌氧初始阶段,当pH为8.0,COD 为2 000 mg/L,培养温度为35 ℃时,通过批式补料方式短期限制磷元素对其进行培养,最有利于该菌株积累PHB,PHB的最高积累量可达菌体干重的32.6%。
聚磷细菌;聚–β–羟基丁酸酯 (PHB);鲍曼不动杆菌
聚–β–羟基丁酸酯(PHB)是许多细菌利用不平衡营养供给物生长时产生的碳源类贮藏物[1],因具有不可替代的生物可降解性、生物相容性和压电性,被用于生产优良的生物降解塑料、生物相容性材料和环保高分子材料[2–3],在农业、食品业和生物医药领域具有广阔的发展前景[4–5],但其广泛应用受到高生产成本的限制。马忠友等[6]以工厂污水为原料,利用丝状细菌生产PHB,PHB含量达细胞干重的37.24%,不仅大大降低了PHB的生产成本,还使污泥得到了合理利用。调节活性污泥中溶解氧的浓度,可使PHB含量由26%提高到37%[7]。以食品工业废水为原料,通过优化碳氮比,PHB含量可达到菌体干重的33%[8]。聚磷菌是污水处理中起脱氮除磷作用的主要菌群。PHB作为活性污泥中聚磷菌细胞内积累的能源物质,在生物除磷过程中起着“能量转换器”的关键作用[9]。如果能利用脱磷工艺剩余污泥中的聚磷菌群来累积PHB,不仅能节省大量发酵培养菌群的费用,还可为剩余污泥的处置提供新方法。笔者以1株从活性污泥中获得的具有PHB合成能力的聚磷菌为对象,研究其积累PHB的部分影响因素,旨在为实现剩余污泥的资源化和降低PHB生产成本提供依据。
1 材料与方法
1.1 材 料
取哈尔滨文昌污水处理厂的活性污泥,通过序批式活性污泥法驯化,待其成熟后进行分离、纯化,获得菌株。
1.2 方 法
1.2.1 菌株的培养及培养基和模拟废水的配制
将保存的菌株经斜面活化后,采用厌氧、好氧序批式活性污泥法[10]培养,所得菌体用于测定菌体干重和PHB积累量。
斜面培养基的配制:称取酵母膏10 g,蛋白胨10 g,牛肉膏5 g,(NH4)2SO45 g,琼脂20 g,加入1 L蒸馏水,调pH至7.0,121 ℃灭菌20 min。
种子培养基的配制:称取牛肉膏 8 g,胰蛋白胨5 g,NaCl 5 g,葡萄糖1 g,加入1 L蒸馏水,调pH至7.2~7.4,121 ℃灭菌20 min。
自配模拟废水:称取CH3COONa 1 335 mg,(NH4)2SO4280 mg,K2HPO4·3H2O 75 mg,NaCl 220 mg,CaCl2125 mg,MgSO4·7H2O 27 mg,FeCl3·3H2O 10 mg,加入1 L蒸馏水,121 ℃灭菌20 min。
1.2.2 菌种的鉴定
菌株的形态、生理生化鉴定参照文献[11–12]。
用16S rDNA测序进行分类学鉴定。参照文献[13],PCR扩增菌株的16S rDNA。运用Clustal.X1.8.1软件进行DNA序列同源性比较,比对结果采用Vector NTI软件进行系统发育分析。
1.2.3 影响菌株合成PHB能力的因素研究
以乙酸为碳源,在30 ℃条件下,研究初始pH、培养温度、初始COD浓度、营养条件对菌株生长及PHB积累的影响。
1.2.4 PHB的表征分析
PHB定量测定:按照文献[14]得到PHB产品,采用Law等的方法[15–16]测定样品中的PHB含量,用不含PHB的氯仿作空白对照。
元素分析:用元素分析仪(VarioEL Ⅲ型,德国Bruker公司)分析所提取样品中C、H元素的含量(质量百分比)。
紫外吸收光谱分析:在波长180~300 nm测定光密度。
红外光谱表征:在光谱分辨率2 cm–1下,于4 000~400 cm–1进行红外光谱(傅立叶变换红外光谱仪,AVATAR–360,美国Nicole公司)检测。
2 结果与分析
2.1 聚磷菌株的鉴定结果
菌落为圆形,中央较厚,边缘圆整,呈淡黄色,不透明,表面光滑;菌株不具有运动性,无鞭毛;革兰氏阴性,无芽孢;扫描电镜下观察菌体呈球杆状,两端钝圆,细胞大小为(0.9~1.6) µm×(1.5~2.5) µm(图1)。菌株的生理生化特性见表1。
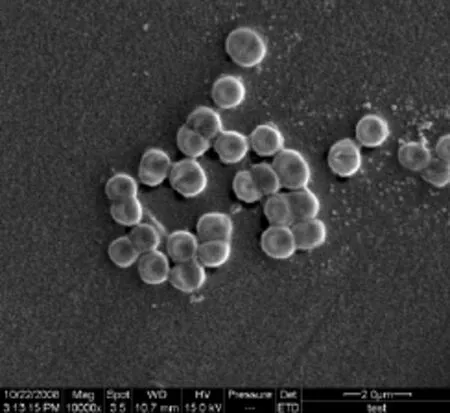
图1 菌株的电镜观察结果(×20 000)Fig. 1 Electron micrograph of the strain (×20 000)
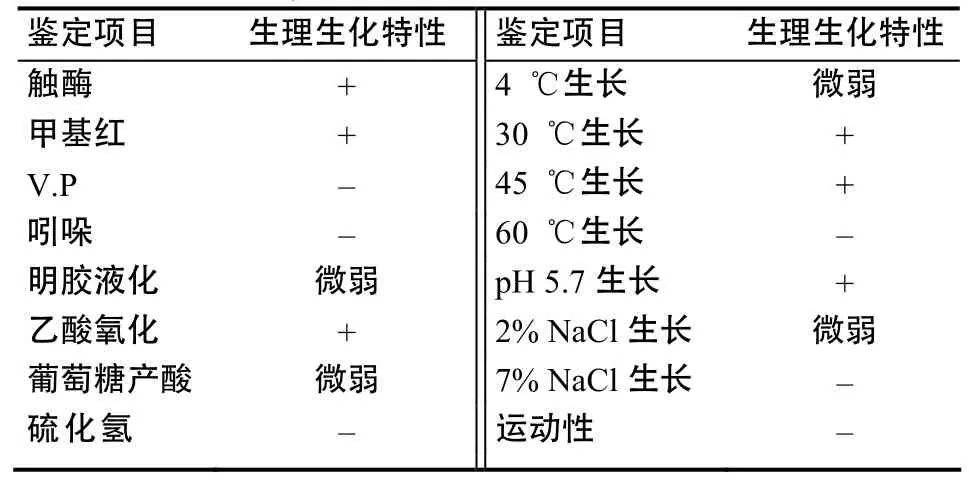
表1 菌株的生理生化特性Table 1 Physiological and biochemical characteristics of the strain
菌株 16S rDNA 序列分析结果(图2)表明,该聚磷菌与序列号为EU760628和EU760625的不动杆菌属菌株的同源性高达99%。结合菌株形态特征和生理生化鉴定结果,鉴定菌株LB4为鲍曼不动杆菌(Acinetobacter baumannii),并命名为Acinetobacter baumannii LB4。
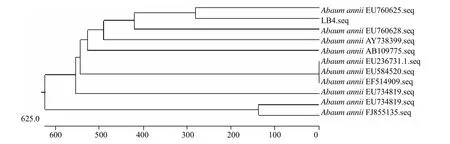
图2 LB4菌株的系统发育树Fig.2 Phylogenetic tree of the strain LB4
2.2 聚磷菌合成PHB能力的影响因素
2.2.1 pH对合成PHB能力的影响
由表2可以看出,初始pH 8.0最利于LB4积累 PHB,积累量达 229.6 mg/L,占细胞干重的19.2%。可见,控制初始pH微碱性,对A. baumannii LB4合成PHB有利。
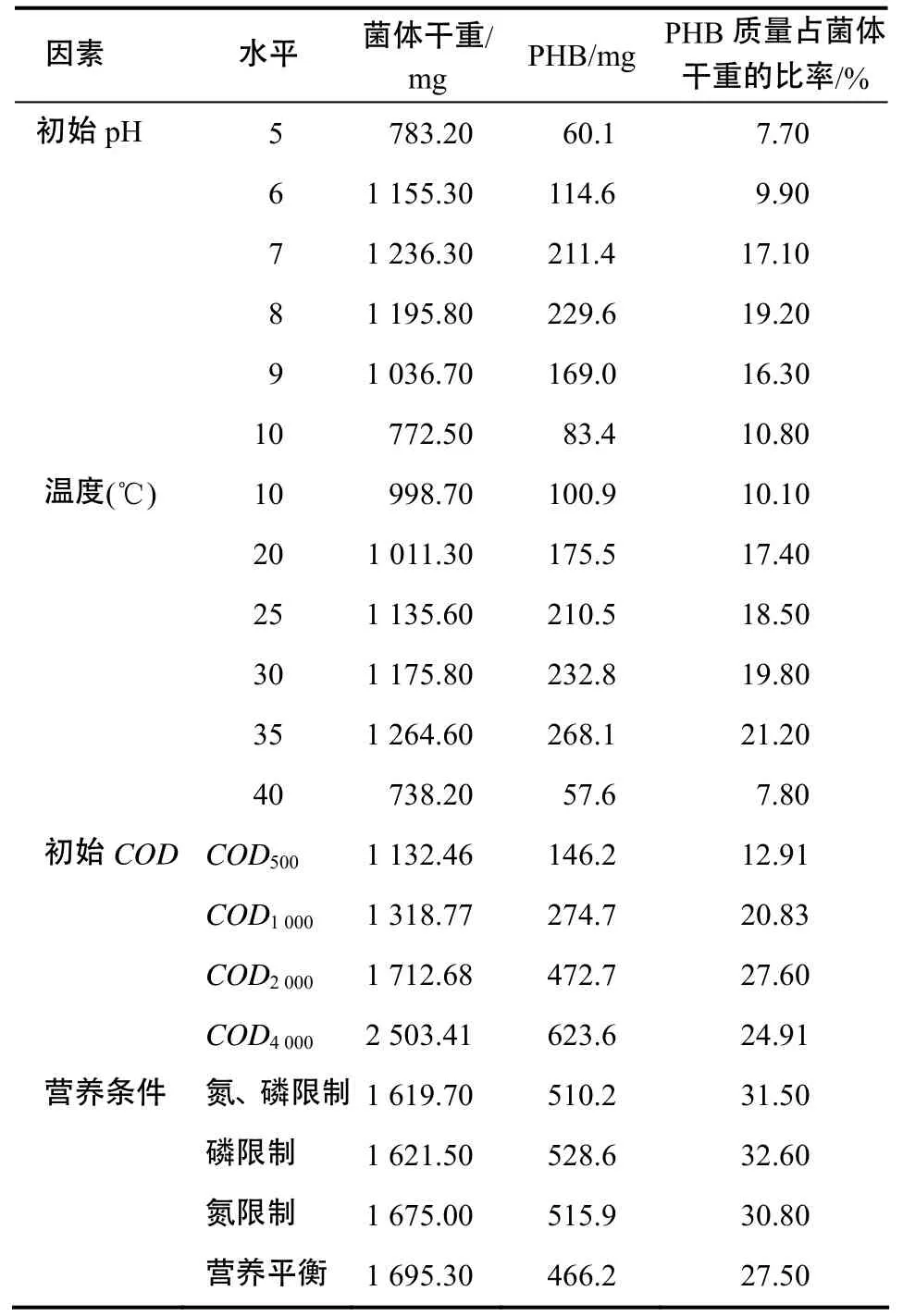
表2 不同条件下LB4的菌体(1 L)的干重和PHB质量Table 2 Strain dry weight and PHB mass under 1 L of LB4 with different conditions
2.2.2 温度对合成PHB能力的影响
由表2可知,培养温度为35 ℃时,PHB浓度达到最大值(268.1 mg/L),同时,PHB占细胞干重的比率也达到最大值(21.2%);当温度继续上升时,两者均呈急剧下降趋势。这是因为温度升高,菌株细胞的生长速率和代谢活动随之增加,但当温度高到一定程度时会出现酶活性降低等现象,从而使细胞代谢功能急剧下降,影响菌体的生长和 PHB的积累。
2.2.3 碳源浓度对合成PHB能力的影响
由表2可知,初始COD4 000系统内的PHB积累量最大,为623.6 mg/L,但其积累的PHB(占细胞干重的24.9%)较COD2 000系统的(27.6%)少,这是由于COD4 000的细胞浓度较大,所以,采用COD 为2 000的碳源浓度最有利于积累PHB。
2.2.4 营养条件对合成PHB能力的影响
由表2可知,营养条件改变后,经过9 h的厌氧反应,氮磷限制、磷限制、氮限制条件下的PHB积累量均较营养平衡情况下有所增加,其中,短期磷限制最利于提高PHB的积累。
2.3 PHB的表征分析结果
对所提取的 PHB样品的元素进行分析,结果表明,元素 C、H的质量分数分别为 56.66%和7.19%,而PHB中元素C、H的理论质量分数分别为55.81%和7.02%,可见,样品测定值与理论计算值的相对误差较小。
由图3可见,所提取的PHB样品在225 nm处有强吸收峰,与标准品的峰十分接近, 纯度较高。
由图4可见,所提取的样品在1 724 cm–1处有强吸收峰,与标准品的特征峰较一致(此峰为PHB的羰基吸收峰[17]),说明样品中含有PHB。
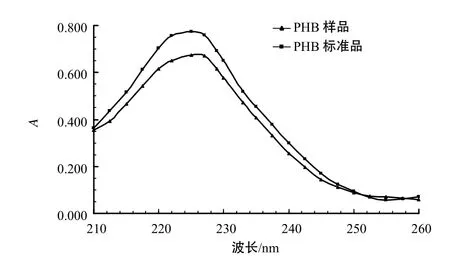
图3 PHB样品和标准品的紫外吸收光谱分析结果Fig.3 UV absorption spectra of PHB sample and reference substance
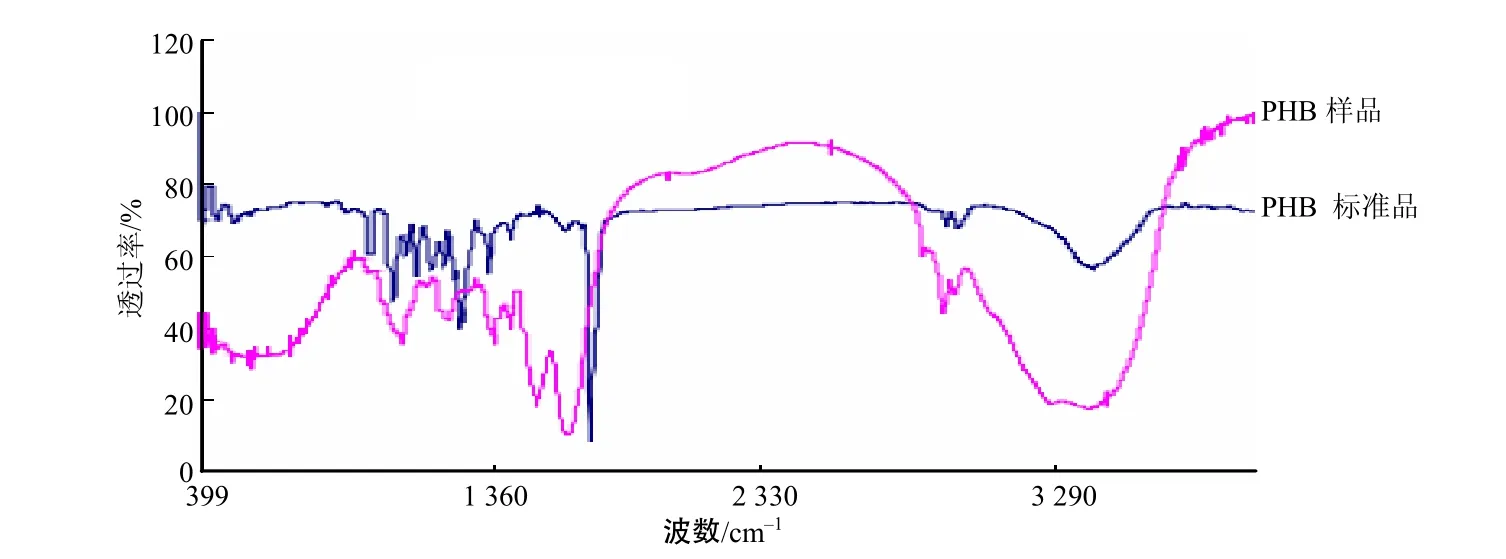
图4 PHB标准品和提取样品的红外光谱分析结果Fig. 4 Infrared spectra of PHB reference substance and PHB sample
3 结论与讨论
微生物的生命活动和物质代谢都与 pH密切相关。pH值的变化会引起细胞膜电荷的变化和代谢过程中酶活性的变化,从而影响到微生物对营养物质的吸收[18]。目前,关于pH对SBR系统影响的研究多数是通过批式试验全程控制pH进行的,但全程控制pH在实际运行过程中并不容易实现,pH通常随着反应的进行而改变,全程控制pH得出的结论只能反映pH冲击负荷对系统的影响,而不能反映系统稳定的运行状态。本试验中通过控制起始pH考察稳定运行的PHB积累系统受pH的影响,结果表明,初始pH 8.0最利于LB4积累PHB,积累量达229.6 mg/L,所以控制初始pH微碱性,对A. baumannii LB4合成PHB有利。这与Dionisi的研究结果[19]相符。
聚磷菌在好氧条件下正常生长,所吸收的有机物用来合成蛋白质、核酸等新的细胞物质和PHB、糖原、多聚磷酸盐等储藏性物质。为了提高胞内PHB的积累量,必须使细胞将所吸收的有机物尽可能地转化为PHB,减少其他物质的合成,因此,限制N、P等提供条件,使菌体中非PHB成分的生成减少,理论上能提高PHB的含量[20]。本试验中短期磷限制最有利于提高菌株LB4对PHB的积累量。这与王婧等[21]的研究结论相符。通过营养平衡主体反应器驯化,得到能够正常生长并积累PHB较多的微生物种群,再采用批式补料方式短期限制营养条件对其进行单独处理,更有利于PHB的积累。
利用聚磷菌纯培养合成 PHB离实际应用和工业化生产还存在较大距离。将具有积累 PHB的不同聚磷菌进行混合培养,或采用废水除磷工艺剩余活性污泥中的聚磷菌群直接积累生产PHB,均具有很强的可行性,有待研究。
[1] 丁多霖.利用活性污泥合成PHB的实验研究[J].科技资讯,2013(8):120.
[2] 钱永雨,赵敏,潘俊波,等.新型可降解塑料聚–β–羟基丁酸(PHB)的研究进展[J].黑龙江医药,2010,23(6):895–898.
[3] 何竹青.PHB的提取方法[J].现代农业科技,2012(6):29.
[4] Xu Ai-ling,Lao Yan-yan,Zhang Qing,et al.Extraction andcharacterization of PHB from Acidiphilium cryptum DX1–1 [J].Journal of Wuhan University of Technology:Materials Science,2010,25(6):938–943.
[5] Burns K L,Oldham C D,May S W.Bacterial productionof poly(3–hydroxybutyrate):An undergraduate student laboratory experiment[J].Journal of Chemical Education, 2009,86(5):603–605.
[6] 马忠友,汪建飞,祝嫦巍,等.活性污泥中1株产PHB丝状细菌的分离与鉴定[J].食品与发酵工业,2012,38(5):101–105.
[7] 曲波,刘俊新.溶解氧对活性污泥合成可生物降解塑料PHB的影响[J].环境工程学报,2008,12(2):1585–1588.
[8] Kumar S M,Mudliar N S,Chakrabarti T.Production of biodegradable plastics from activated sludge generated from a food processing industrial wastewater treatment plant[J].BioresourceTechnology,2004,95(3):327–330.[9] Mino T,Heijnen J J.Microbiology and biochemistry of the enhanced biological phosphate removal process[J]. Water Research,1998,32 (11):3193–3207.
[10] Toshiyuki N,Mayumi N,Koji S,et al.Photometric estimation of intracellular polyphosphate content by staining with basic dye[J].Analytical Sciences,2001,17(9):1675–1678.
[11] 布坎南R E,吉本斯N E.伯杰氏细菌鉴定手册[K].北京:科学出版社,1984:636–669.
[12] 东秀珠,蔡妙英.常见细菌系统鉴定手册[K].北京:科学出版社,2001:144–147,354–379.
[13] 李淑彬,陈振军,丘李莉,等.蜡状芽孢杆菌菌株Jp–A的分离鉴定及其降解苯酚特性[J].应用生态学报,2006,17(5):920–924.
[14] 刘哲君,赵敏,潘俊波,等.从活性污泥中提取聚–β–羟基丁酸酯的方法和条件的研究[J].现代化工,2009,29(2):214–217.
[15] Law J H,Slepecky P A.Assay of poly–β–hydroxybutyric acid[J].Journal of Bacteriology,1961,82 (1):33–36.
[16] 陈玲,李礼尧,王武.聚–β–羟丁酸酯紫外检测方法的改进[J].无锡轻工大学学报,1997,16(2):27–31.
[17] Naumann D,Fijala V,Labischinsk H,et al. Microbiological characterizations by FR–IR spectroscopy[J]. Nature,1991,351 (2):81–82.
[18] 毛清黎,朱旗.红茶发酵中pH调控对多酚氧化酶活性及茶黄素形成的影响[J].湖南农业大学学报:自然科学版,2005,31(5):524–526.
[19] Dionisi D,Majone M,Papa V,et al.Biodegradable polymers from organic acids by using activated sludge enriched by aerobic periodic feeding[J].Biotechnology and Bioengineering,2004,85 (6):569–578.
[20] 吴光学,管运涛.SRT及碳源浓度对厌氧、好氧交替运行SBR工艺中PHB的影响[J].环境科学,2005,26(2):126–130.
[21] 王婧,李清彪,何宁,等.营养条件与间歇曝气方式对活性污泥累积聚–3–羟基丁酸酯的影响[J].现代化工,2007,27(5):45–48
责任编辑:王赛群
英文编辑:王 库
Identification of a phosphate-accumulating bacteria strain and influencing factors on poly-β-hydroxybutyrate accumulation
ZHAO Mei, JIN Zi-jing, LI Bo, LIU Zhe-jun, ZHAO Min*, SUN Yi-ping
(College of Life Sciences, Northeast Forestry University, Harbin 150040, China)
LB4, a phosphate-accumulating strain with the ability of poly–β–hydroxybutyrate(PHB) granules accumulation, was isolated from activated sludge of SBR in treatment equipment of wastewater. Through the analysis from morphological, biochemical characteristics, and identification using 16S rDNA sequence approach, LB4 was proved to be a subspecies of Acinetobacter baumannii. The influence factors for PHB accumulation were investigated by alternative cultivation of anaerobic-aerobic cycle. The results showed that the favourite conditions for the strain to accumulate PHB at the beginning of anaerobic phase was at temperature 35 ℃, pH 8.0, COD 2 000 mg/L, and with short-term phosphorus inhibition, the maximum accumulation of PHB could reach to that of 32.6% dry weight of the strain.
phosphate-accumulating bacteria; poly-β-hydroxybutyrate (PHB); Acinetobacter baumannii
S216.3
A
1007−1032(2014)02−0202−05
10.13331/j.cnki.jhau.2014.02.019
投稿网址:http://www.hunau.net/qks
2014–01–04
国家自然科学基金项目(J1210053)
赵美(1987—),女,山东省泰安市人,硕士研究生,主要从事污染物降解微生物学研究,zmzr2009@163.com,*通信作者,82191513 @163.com。金子靖同为第一作者。
