发酵五味子药渣对断奶仔猪小肠黏膜的形态及免疫的影响
2014-07-02贺晓玉罗杰李英伦
贺晓玉,罗杰,李英伦
(四川农业大学动物医学院,四川 雅安 625014)
发酵五味子药渣对断奶仔猪小肠黏膜的形态及免疫的影响
贺晓玉,罗杰,李英伦*
(四川农业大学动物医学院,四川 雅安 625014)
选用 90头DLY(杜×长×大)断奶仔猪(28日龄),随机分为5组:空白对照组,饲喂基础日粮;阳性对照组(0.5% SC组),饲喂基础日粮+0.5%北五味子;0.1% FSD组,饲喂基础日粮+0.1%发酵五味子药渣;0.3% FSD 组,饲喂基础日粮+0.3%发酵五味子药渣;0.5% FSD组,饲喂基础日粮+0.5%发酵五味子药渣。每天记录5组猪的腹泻情况以及采食量,计算腹泻率和料肉比,并于试验第7、14、21天,分别采集空白对照组、0.5% SC组、5% FSD组仔猪的十二指肠、空肠、回肠中段组织以及空肠黏膜,测定肠绒毛高度,隐窝深度,肠上皮内杯状细胞、淋巴细胞数量,以及空肠黏膜分泌型免疫球蛋白A(SIgA)含量。结果表明:0.1%FSD组、0.3%FSD组、0.5%FSD组仔猪的腹泻率分别比空白对照组低13.87%、30.82%、41.72%;料肉比分别比空白对照组仔猪低1.7%、4.02%、8.6%;与空白对照组相比,0.5% SC和0.5% FSD组仔猪的小肠绒毛较完整;0.5% FSD组仔猪的十二指肠、空肠、回肠绒毛高度显著增加(P<0.05),隐窝深度显著降低(P<0.05),绒毛高度与隐窝深度比值(V/C)提高;0.5% FSD组仔猪肠上皮内杯状细胞及淋巴细胞数量均高于空白对照组,肠黏膜SIgA含量极显著高于空白对照组(P<0.01),0.5% FSD组与0.5% SC组各项指标的差异均没有统计学意义。
断奶仔猪;发酵;五味子药渣;蛹虫草菌;黏膜上皮形态;黏膜免疫
目前,中药提取工艺比较单一,导致药渣中还残留许多药用活性成分。据报道,中成药制药过程中有效成分的提取率一般为30%~70%,部分有效成分仍残留在药渣中[1]。研究[2–4]表明,中药渣可作为动物饲料添加剂,提高动物免疫力,促进动物生长。但是,多数研究停留在将中药渣直接添加到饲料中。本试验采用药用真菌双向性固体发酵工程[5–7],将五味子药渣用蛹虫草菌(Cordyceps militaris)发酵,并将发酵产物添加到断奶仔猪日粮中,检测饲喂发酵五味子药渣后仔猪小肠黏膜上皮形态以及黏膜免疫系统的变化,旨在为发酵五味子药渣的临床应用及中药渣的回收再利用提供参考依据。
1 材料与方法
1.1 发酵五味子药渣的制备
将雅安三九药业提供的五味子药渣烘干(50 ℃),粉碎过850 μm孔径筛。然后,称取40 g置于虫草发酵瓶中,加入70 mL蒸馏水,高压蒸汽灭菌后,接入9 mL蛹虫草菌菌液(山东省东方虫草科技园产品),于25 ℃下避光培养15 d 后,将整个培养基质50 ℃烘干,粉碎,制成发酵五味子药渣,备用。
1.2 动物分组及饲养管理
选用90头体重为(7.13±0.22) kg 的28日龄“杜× 长×大”三元杂交断奶仔猪,按性别、体重和窝源基本一致原则随机分为5组,每组3个重复。各组分别饲喂基础日粮(空白对照组)、基础日粮+0.5%北五味子(0.5% SC组)、基础日粮+0.1%发酵五味子药渣(0.1% FSD组)、基础日粮+0.3%发酵五味子药渣(0.3% FSD组)、基础日粮+0.5%发酵五味子药渣(0.5% FSD组)。试验期为21 d。基础日粮参照NRC(1998)[8]猪的营养需要以及试验猪场的饲粮配方,配成全价粉状料。试验在同一栋双列封闭式猪舍内进行。自由采食,自由饮水。免疫消毒程序按猪场常规方法进行。每天9:00~19:00观察仔猪的排粪情况,统计仔猪腹泻头数。在试验初期和结束时对各组仔猪称重,记录各组饲料消耗量。
1.3 样品采集与处理
于试验第7、14、21天,分别从空白对照组、0.5% SC 组、0.5% FSD组中随机选取3头仔猪,经前腔静脉放血处死,剖解后取十二指肠、空肠、回肠中段3~5 cm肠管,迅速置于10%中性福尔马林溶液中固定,用于制作组织切片,测量绒毛高度、隐窝深度,统计上皮内杯状细胞及淋巴细胞数量。同时,取空肠起始端至回盲括约肌肠管,纵向剪开肠管,暴露黏膜面,用磷酸缓冲液(PBS,pH7.2)流动冲洗后平铺于滤纸上,用清洁载玻片轻轻刮取肠黏膜[9],置于EP管中,–20 ℃保存,用于检测SIgA含量。
1.4 测定指标及方法
1.4.1 腹泻率及料肉比
计算腹泻率和料肉比(FCR)。腹泻率=腹泻头数/仔猪总头数×100%;FCR=消耗饲料总量/增重总量。
1.4.2 肠道黏膜上皮形态
肠道组织固定48 h后,经水洗、脱水、透明、浸蜡、包埋处理后,连续切片(5 µm),以苏木精–伊红(HE)和AB–PAS染色法[10]对切片进行染色,封片。用显微镜观察肠黏膜结构,并以Motic Med 6.0图像软件分析。在HE染色切片上,选择5个典型视野(绒毛完整,走向平直)测量每个视野中最长绒毛处的绒毛高度、隐窝深度,并计数每200个柱状上皮细胞间的淋巴细胞。在AB–PAS染色切片上,计数每100个柱状上皮细胞间的杯状细胞[11–12]。
1.4.3 黏膜SIgA含量
取1 g肠黏膜样品置于9 mL蒸馏水中,用微型搅拌器捣碎,匀浆5 min。以3 000 r/min离心20 min,取上清液,用酶联免疫法(ELISA)测定SIgA含量。操作步骤按猪分泌型免疫球蛋白A(SIgA)ELISA Kit(成都康迪生物技术有限公司)说明书进行。
1.5 数据处理及分析
采用SPSS19.0软件进行数据处理分析。
2 结果与分析
2.1 发酵五味子药渣对仔猪腹泻率及料肉比的影响
从表1可以看出,0.1% FSD,0.3% FSD组仔猪与空白对照组相比,腹泻率和料肉比均有降低趋势,但差异均没有统计学意义(P<0.05)。0.5% FSD组仔猪腹泻率和料肉比与空白对照组相比,均极显著降低(P<0.01),说明添加一定量发酵五味子药渣能够防治仔猪腹泻,改善肠道消化吸收功能,提高饲料利用率,且添加0.5%时效果最佳。0.5% FSD组与0.5% SC组仔猪的腹泻率及料肉比的差异不显著,说明发酵五味子药渣防治断奶仔猪腹泻、促进饲料转化的效果与五味子相当。
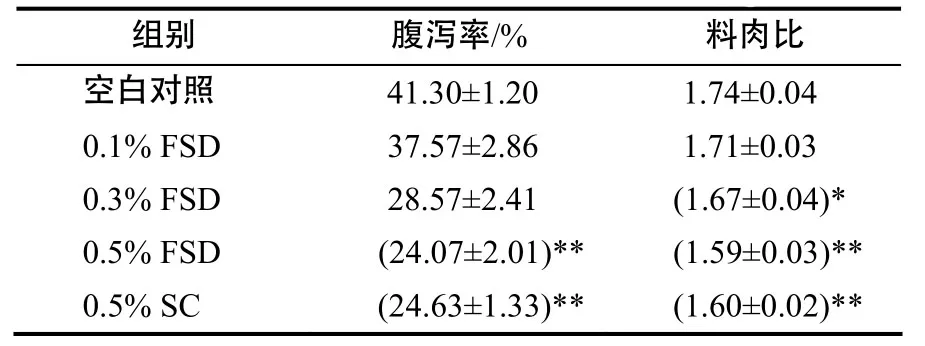
表1 断奶仔猪的腹泻率及料肉比Table 1 Diarrhea rates and FCR of weaned piglets
2.2 发酵五味子药渣对仔猪肠道黏膜形态的影响
通过肠道组织切片观察,空白对照组仔猪绒毛萎缩、脱落、排列紊乱,且有折断、扭曲与变形,而0.5% FSD组及0.5% SC组绒毛较完整(图1~3)。试验第7、14、21天各组仔猪小肠绒毛高度、隐窝深度及V/C值的比较见图4~6。从图4~6中可以看出,
0.5 % FSD组仔猪十二指肠、空肠、回肠的绒毛高度较空白对照组高,隐窝深度较空白对照组低,绒毛高度和隐窝深度比值(V/C)显著高于空白对照组(P
<0.05)。0.5% FSD组仔猪肠道的绒毛高度、隐窝深度与0.5% SC组的相比,差异没有统计学意义。

图1 各组仔猪十二指肠绒毛形态Fig.1 Villus morphology of duodenum from piglelts of different groups

图2 各组仔猪回肠绒毛形态Fig.2 Villus morphology of jejunum from piglelts of different groups
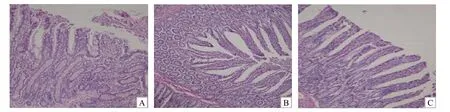
图3 各组仔猪空肠绒毛形态Fig.3 Villus morphology of ileum from piglelts of different groups
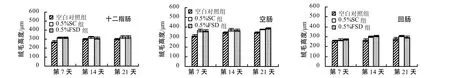
图4 不同试验期仔猪小肠的绒毛高度Fig. 4 Intestinal villus height of weaned piglets from each group at different sampling times

图5 不同试验期仔猪小肠的隐窝深度Fig.5 Intestinal crypt depth of weaned piglets from each group at different sampling times

图6 不同试验期仔猪小肠的V/C值Fig.6 V/C value of weaned piglets from each group at different sampling times
2.3 发酵五味子药渣对上皮内杯状细胞及淋巴细胞数量的影响

图7 肠道上皮内的杯状细胞及淋巴细胞Fig.7 Intestinal epithelial goblet cells and intestinal intraepithelial lymphocytes of weaned piglets
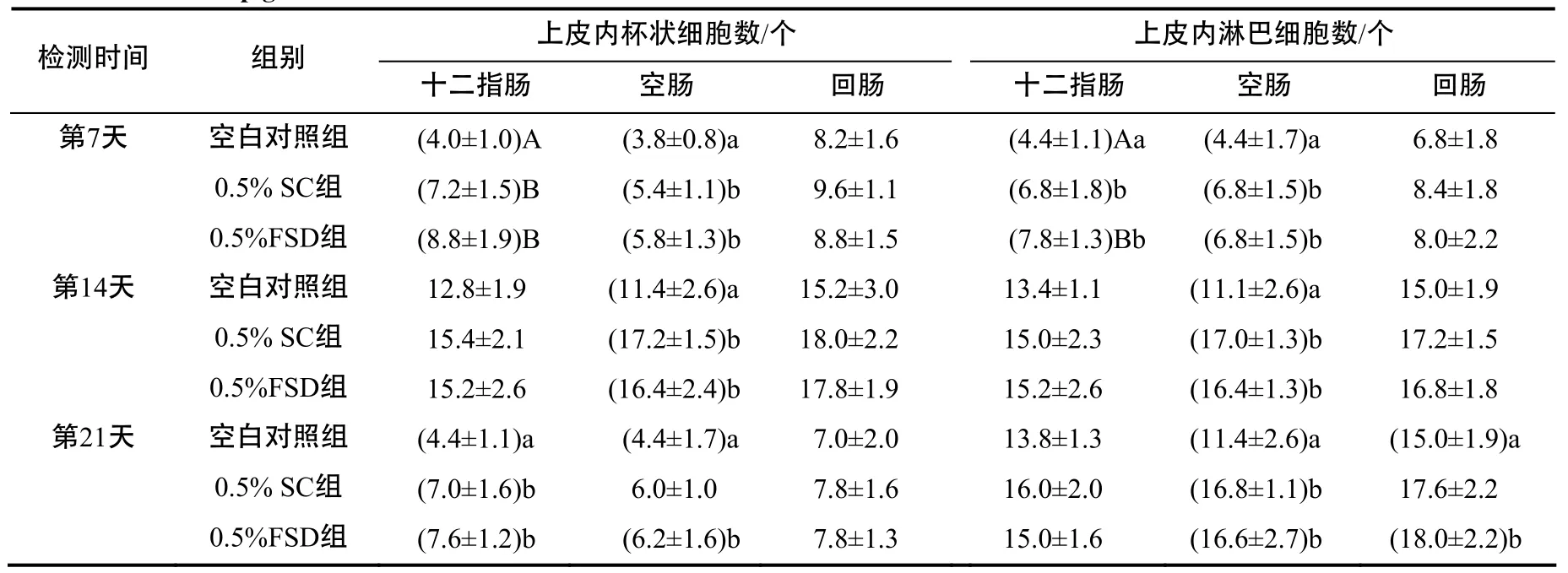
表2 断奶仔猪肠道上皮内淋巴细胞及杯状细胞的检测结果Table 2 Effects of fermented dregs of S. chinensis on the number of intestinal intraepithelial goblet cells and intraepithelial lymphocytes of weaned piglets
各组仔猪小肠黏膜上皮内杯状细胞及淋巴细胞形态相似(图7),其计数结果见表2。0.5% FSD组第7、14、21天仔猪的十二指肠以及第7、14天的空肠上皮内杯状细胞数显著高于空白对照组(P<0.05)。 0.5% FSD组第7、14、21天的空肠以及第21天的回肠上皮内淋巴细胞数均显著高于空白对照组(P<0.05)。0.5% FSD组与0.5% SC组相比,差异没有统计学意义。以上结果表明,日粮中添加0.5%的发酵五味子药渣可以增加断奶仔猪肠道黏膜上皮内杯状细胞及淋巴细胞的数量。
2.4 发酵五味子药渣对断奶仔猪肠黏膜中 SIgA含量的影响
各组仔猪小肠黏膜SIgA含量检测结果见表3。随着试验时间的推移,各组仔猪黏膜SIgA含量均逐渐升高。在试验期内,0.5% FSD组和0.5% SC组仔猪小肠黏膜的SIgA含量显著或极显著高于空白对照组(P<0.05或P<0.01),且0.5% FSD组高于0.5% SC组,在第21天时两组差异显著(P<0.05),表明在断奶仔猪日粮中添加发酵五味子药渣可以增加肠道黏膜中SIgA含量,且作用效果优于五味子。

表3 断奶仔猪肠黏膜的SIgA 含量Table 3 Effects of fermentaed dregs of S. chinensis on SIgA content in intestinal mucosa of weaned piglets
3 结论与讨论
小肠的绒毛高度、隐窝深度、绒毛高度与隐窝深度比值(V/C)是衡量小肠消化吸收的重要指标。肠道上皮结构的完整性是构成肠道黏膜免疫屏障的基础。小肠黏膜上皮内淋巴细胞、杯状细胞以及黏膜SIgA是肠道黏膜免疫系统中的重要组成部分[13–16]。本研究用蛹虫草菌发酵五味子药渣,将其添加到仔猪日粮中,发现饲喂添加了0.5%发酵五味子药渣的仔猪,其小肠绒毛高度提高,隐窝深度降低,V/C值提高,肠道上皮结构完整,肠上皮内杯状细胞、淋巴细胞的数量以及黏膜SIgA的含量均增加。表明发酵五味子药渣能促进小肠消化吸收功能,提高饲料报酬和仔猪的免疫功能。
五味子属于收涩药,具有止泻、提高机体免疫力、保肝、抗氧化作用[17]。蛹虫草菌菌丝体具有免疫调节、抗菌、抗炎、抗肿瘤等作用[18–19]。本试验所用发酵五味子药渣是将五味子药渣用作蛹虫草菌的培养基,发酵培养一段时间后将整个发酵基质烘干、粉碎制成。在这一过程中,蛹虫草菌利用自身产生的各种酶,如纤维素酶、半纤维素酶、蛋白酶、果胶酶等分解和利用五味子药渣中的营养成分生长成菌丝体,同时在酶的分解作用下,残留在五味子药渣中的有效成分溶出增加[5]。前期测定发现发酵五味子产物中虫草素含量高达0.51%,多糖含量达2.87%(数据待发表),因此,试验仔猪消化、免疫能力的提高既有发酵基质中五味子有效成分的作用,又有蛹虫草菌菌丝体的有效成分的作用。
断奶应激对仔猪肠道屏障的破坏,造成仔猪肠道免疫功能受损[20],进而造成仔猪食欲不振、消化不良、增重缓慢、腹泻等现象。断奶应激对仔猪肠黏膜形态有很大影响,包括绒毛萎缩,高度下降,隐窝加深等[21–23],因此,蛹虫草菌发酵五味子药渣有望用于改善仔猪的断奶应激。
[1] 马逊风,马宏军,唐占辉,等.中药渣剩余成分分析及利用途径研究[J].东北师大学报:自然科学版,2006,36(2):108–111.
[2] 陈晓明,李肖梁,汤丽萍,等.中草药渣对断奶仔猪生长、肠道菌群和免疫的影响[J].浙江农业学报,2007,19(1):50–54.
[3] 李艳军,谷子林,刘亚娟,等.中药渣对獭兔生产性能和营养消化率的影响[J].饲料研究,2010(8):39–40,41.
[4] 李肖梁,余东游,钱娅,等.“十全大补”药渣对肥育猪生长、胴体特性和肉质的影响[J].浙江大学学报:农业与生命科学版,2006,32(4):433–437.
[5] 庄毅,洪净.药用真菌双向性固体发酵工程与中成药药渣再开发[J].中国中药杂志,2006,31(22):1918–1919.
[6] 游明乐.中国食(药)用真菌发酵工程研究进展[J].微生物学通报,2007,34(2):327–311.
[7] 王蕾,罗巍,胡瑕,等.虫草素高产菌株的筛选及不同添加物对虫草素产量的影响研究[J].菌物学报,2012,31(3):382–388.
[8] NRC.Nutrient requirements of swine[M]. 10thedn. Washington D C:National Academy Press,1998.
[9] 王希春,吴金节,陈亮,等.高锌日粮对断奶仔猪肠道黏膜免疫及黏膜上皮形态的影响[J].中国兽医学报,2010,30(10):1371–1376.
[10] 刘虎传,张敏红,李素霞,等.益生菌制剂对早期断奶仔猪肠道pH、黏膜形态结构和挥发性脂肪酸含量的影响[J].动物营养学报,2012,24(7):1329–1335.
[11] Shan Y,Shann A,Li J,et al.Dietary supplementation of arginine and glutamine enhances the growth and intestinal mucosa development of weaned piglets[J]. Livestock Science,2012,150(1/3):369–373.
[12] 赵玉蓉,王红权,贺建华,等.谷氨酰胺对断奶仔猪肠道微生物和小肠黏膜形态的影响[J].湖南农业大学学报(自然科学版),2009,35(2):158–161.
[13] 王子旭,佘锐萍,陈越,等.日粮锌、硒水平对肉鸡肠道黏膜屏障结构的影响[J].动物医学进展,2003,24(4):99–102.
[14] 陈付菊,陈耀星,王子旭,等.不同月龄山羊小肠黏膜免疫相关细胞的数量变化[J].畜牧兽医学报,2007,38(12):1362–1367.
[15] 孙丽华,蒋宗勇,林映才,等.早期断奶仔猪肠黏膜免疫功能研究进展[J].东北农业大学学报,2009,40(1):138–144.
[16] Walker W A.Development of the intestinal mucosal barrier[J].J Pediatr Gastroenterol Nutr,2002,34(1):S33–S39.
[17] 李建平,单安山.五味子的生物学作用与应用[J].中国畜牧兽医,2006,33(4):21–24.
[18] 胡丰林,李增智.虫草及相关真菌的次生代谢产物及其活性[J].菌物学报,2007,26(4):607–632.
[19] 樊惠婷,林洪生.蛹虫草化学成分及药理作用研究进展[J].中国中药杂志,2013,38(5):2549–2551.
[20] 王静华,汪以真.仔猪早期断奶对肠道免疫功能的影响[J].养猪,2003(3):13–15.
[21] Vente–Spreeuwenberg M A M,Verdonk J M A J,Koninkx J F J G,et al.Dietary protein hydrolysates vs. the intact proteins do not enhance mucosal integrity and growth performance in weaned piglets[J].Livestock Production Science.2004,85(2/3):151–164.
[22] 顾宪红,张宏福,佘锐萍,等.断奶日龄对仔猪肠黏膜形态的影响[J].畜牧兽医学报,2001,32(4):306–313.[23] 陶新,徐子伟.断奶应激引发仔猪肠道损伤及重建机制研究进展[J].中国畜牧杂志,2012,48(15):75–78.
责任编辑:罗 维
英文编辑:罗 维
Effects of fermented dregs of Schisandra chinensis on intestinal morphology and mucosal immunity of weaned piglets
HE Xiao-yu, LUO Jie, LI Ying-lun*
(College of Veterinary Medicine, Sichuan Agricultural University, Ya’an, Sichuan 625014, China)
Ninety 28-day-old weaned piglets were divided randomly into 5 groups. In blank control group, piglets were fed with basal diet; in positive control group (0.5% SC group), piglets were fed with basal diet supplemented with 0.5% Schisandra chinensis (S. chinensis); in 0.1%, 0.3% and 0.5% FSD groups, piglets were fed with basal diet respectively supplemented with 0.1%, 0.3%, 0.5% fermentated dregs of Schisandra chinensis. Diarrhea and feed intake data of piglets from the 5 groups were recorded for calculation of diarrhea rate and feed conversion ratio. Tissues from the middle part of duodenum, jejunum and ileum and jejunum mucosal of piglets from the control group, 0.5% SC group and 0.5% FSD group were collected 7, 14 and 21 days post-experiment for determination of the villus height, crypt depth, the number of intestinal epithelium cells and goblet cells and content of SIgA. The results showed that the diarrhea rate of 0.1% FSD group, 0.3% FSD group and 0.5% FSD group were respectively 13.87%, 30.82% and 41.72% lower than that of the control group; the FCR of 0.1% FSD group, 0.3% FSD group and 0.5% FSD group were respectively 1.7%, 4.02%, 8.6% lower than that of the control group. Compared to the control group, intestine villus of piglets from 0.5% SC group and 0.5% FSD group was complete;the villus height of duodenum, jejunum and ileum in piglets from 0.5% FSD group increased (P<0.05) while the crypt depth decreased (P<0.05), and the ratio of villus height to crypt depth was increased. The number of goblet cells and lymphocyte cells were higher, and the SIgA levels were extremely higher (P<0.01) in
intestine of piglets from 0.5% FSD group compared with the control group. And there had no significant difference in indexes mentioned above between 0.5% SC group and 0.5% FSD group.
weaned piglets; fermentation; Schisandra chinensis dregs; Cordyceps militaris; morphology of musocal epithelium; mucosal immunity
S816.7;S853.72
A
1007−1032(2014)02−0196−06
10.13331/j.cnki.jhau.2014.02.018
投稿网址:http://www.hunau.net/qks
2013–11–23
四川省科技支撑计划(2013NZ0019)
贺晓玉(1988—),女,四川简阳人,从事兽医药理及毒理研究,hexy881001@163.com;*通信作者,liyinglun01@163.com
