颈椎后纵韧带骨化症与BMP-2、BMP-4基因多态性的关联性研究
2014-07-02耀魏威陈春悦叶
周 耀魏 威陈春悦叶 杨
1浙江省奉化市中医医院 奉化 315500 2浙江省中西医结合医院
颈椎后纵韧带骨化症与BMP-2、BMP-4基因多态性的关联性研究
周 耀1魏 威2陈春悦2叶 杨2
1浙江省奉化市中医医院 奉化 315500 2浙江省中西医结合医院
目的探讨颈椎后纵韧带骨化症(OPLL)与BMP-2基因第3外显子的rs79417223和BMP-4基因第4外显子的rs147822607两个SNP位点的相关性。方法选取47例浙江地区汉族颈椎后纵韧带骨化症患者,以100名正常个体作为对照组,采用PCR+Sanger DNA测序,统计分析2个位点基因型的分布信息。结果BMP-2基因第3外显子的rs79417223G→A患者、BMP-4第4外显子的rs147822607A→C患者与正常组呈现明显差异(P<0.05,P<0.01)。结论BMP-2基因第3外显子的rs79417223G→A、BMP-4基因、第4外显子的rs147822607A→C,这2个多态性位点与OPLL的发病具有强烈相关性。
颈椎后纵韧带骨化症;单核苷酸多态性;易感基因;BMP-2基因;BMP-4基因
颈椎后纵韧带骨化症(ossification of the posterior longitudinal ligament,OPLL)属于一种骨成形病,表现为颈椎后纵韧带内异位骨的形成,主要压迫脊髓产生临床症状以及病理损害。OPLL为一种遗传因素和环境因素共同作用所致的复杂疾病(多基因疾病)[1-6],高发于日本人以及亚洲人。通过检索国内外相关文献,我们选取2个可疑的OPLL易感基因多态性SNP位点,BMP-2基因第 3外显子的 rs79417223和BMP-4基因第4外显子的rs147822607,进行多态性分析,以期获得这2个多态性位点与浙江地区汉族OPLL患者发病之间的关联性。
1 资料与方法
1.1临床资料 2010年7月—2013年9月就诊于浙江省奉化市中医院、浙江省中西医结合医院、解放军一一七医院等骨科的汉族OPLL患者47例,男30例,女17例,平均年龄(45.4±11.2)岁,病程0.3~8年,平均(4.1±1.2)年。根据颈部CT或者MRI明确诊断[7]。患者籍贯均在浙江地区。同时,以100名无血缘关系的浙江地区汉族正常个体作为对照组,男50名,女50名,平均年龄(43.1±7.3)岁。每位参与者均签署书面知情同意书。
1.2方 法 ①DNA制备:入组者均在无菌环境下抽取外周血10mL(EDTA抗凝)。用外周血DNA纯化试剂盒(德国Qiagen公司)提取和纯化基因组DNA。②PCR引物的合成:参考NCBI等人类基因组SNP数据库,用Primer Premier 5.0软件设计2个基因SNP位点的PCR引物序列。引物由上海生工生物工程公司合成,引物序列见表1。③DNA测序分型对各多态性SNP位点分别进行PCR扩增,通过Sanger DNA测序进行基因分型。PCR产物的DNA测序委托上海生工生物工程公司进行。根据基因分型结果,计算基因型频率和等位基因频率。
1.3统计学方法 应用SPSS13.0统计软件进行分析,采用χ2检验,P<0.05,表示具有统计学意义。
2 结 果
2个多态性SNP位点的基因型分布经χ2检验,符合Hardy-Weinberg遗传平衡[8]。BMP-2基因第3外显子的rs79417223G→A患者与正常组呈现明显差异(P<0.05)。BMP-4第4外显子的rs147822607A→C患者与正常组呈现明显差异(P<0.01)。各等位基因在患者组与正常对照组中的分布和分析结果,见表2。
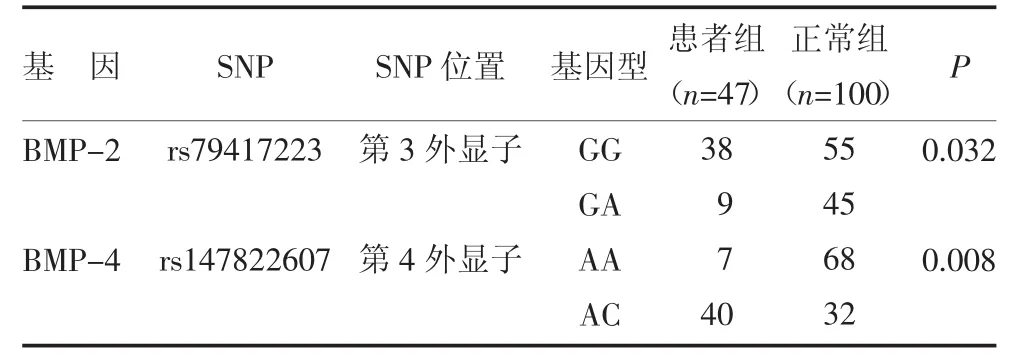
表2 两组rs79417223和rs147822607分布及比较 例
3 讨论
OPLL是一种高发于日本人以及亚洲人的常见病。日本人的发病率约为1.9%~4.3%,韩国人约为3.6%,我国台湾省约为2.8%,我国北方人群的OPLL发病率约为0.44%~8.92%,而北美白人仅为0.12%[1-3]。OPLL是引起脊髓病的重要原因,大部分可保持长期稳定状态,起病隐匿,进展缓慢,呈现恶性发展趋势,可引起脊髓不可逆性损害,其中部分患者的脊髓功能出现急剧恶化[1]。OPLL的致瘫风险显著高于其他颈椎退行性疾病,其原因包括缺乏有效的早期筛选方法和诊断方法,自然史不明,无法确定手术时机,术后骨化物持续生长等。目前,临床上尚无有效的方法延缓和改善OPLL的骨化过程,手术疗法仍然是最主要的治疗手段,但风险系数较高[1]。1989年,Terayama等发现,日本OPLL家系中先证者亲属的发病率显著高于普通人群[4]。在北美OPLL患者中,尽管大部分病例为散发性,但仍可见部分病例具有家族聚集性[5]。目前已经达成共识,OPLL是一种严重危害人体健康的复杂性多基因遗传病,其发病机制不详,迄今没有可靠的生物学识别指标[1-2]。许多学者已做了大量的医学研究来揭示OPLL发病的分子医学基础[9]。
骨形成蛋白(bone morphogenetic protein,BMP)为多功能蛋白,具有独特的骨形成作用和其他形态发生过程。BMP-2基因定位于20p12,而BMP-4基因位于14q22-q23。Kawaguchi等[10]曾发现某例OPLL患者术后标本中的BMP-2仅表达于骨质化的基质、软骨细胞以及邻近OPLL软骨的成纤维细胞中,而不在未骨质化的颈椎后纵韧带中表达。Kon等[11]对从OPLL和非OPLL患者的脊柱韧带中分离到的成纤维细胞进行体外培养后,也发现BMP-2优先诱导OPLL患者的成纤维细胞的成骨分化。Wang等[12]对192例汉族OPLL患者和304名健康对照的研究表明,具有BMP-2基因第3外显子SNP TC和CC基因型的男性更易罹患OPLL。Karasugi等[2]最新的一项对214例日本OPLL患病同胞对的大规模全基因组连锁分析研究显示,OPLL最有可能的易感基因区域位于20p12的微卫星标记D20S894附近(NPL= 3.43,P=0.000,27)。而Furushima等[13]对126例日本OPLL患病同胞对进行了的大规模候选基因筛查发现,仅BMP-4基因与OPLL显著关联(NPL=2.230,P=0.035)。本研究分别选取了BMP-2第3外显子的rs79417223和BMP-4第4外显子的rs147822607两个SNP位点进行分析,研究结果发现BMP-2基因第3外显子的rs79417223G→A患者与正常组呈现明显差异(P<0.05)。BMP-4第4外显子的rs147822607A→C患者与正常组呈现明显差异(P<0.01)。本研究提示BMP-2基因第3外显子的rs79417223G→A、BMP-4基因第4外显子的rs147822607A→C,这2个多态性位点与OPLL的发病具有强烈相关性。
由于取材等方面的原因,目前直接在人颈椎后纵韧带组织细胞水平上探讨OPLL的易感基因表达水平还比较困难,加之该病呈复杂性多基因遗传方式,并表现出强烈的遗传异质性和表型异质性,因而尚无法准确地确定致病基因,并阐释易感基因的基因-基因、基因-环境之间的相互作用及其在OPLL发病中的地位[1-3,9]。因此,对大样本患者群体进行可疑易感基因的SNP分型,寻找和鉴定相关的致病基因,是切实可行的研究方法之一。由于受时间、地点限制,本研究只收集到了47例浙江地区汉族OPLL患者,选择了2个基因多态性SNP位点进行了初步研究。研究结果提示此位点与OPLL的发病具有强烈相关性。但本研究的患者均来自于中国浙江地区,而且研究的样本数又相对偏小,所以研究结果与以前文献报道可能会存在有一些差异。在今后的研究中,可以将样本再扩大化,并且运用目前先进的外显子捕获二代测序技术运用于OPLL基因外显子组水平的分析研究,以获得OPLL发生的分子遗传学基础[9]。
[1]Saetia K,Cho D,Lee S,et al.Ossification of the posterior longitudinal ligament:a review[J].Neurosurg Focus,2011,30(3):E1.
[2]Karasugi T,Nakajima M,Ikari K,et al.A genome-wide sibpair linkage analysis of ossification of the posterior longitudinal ligament of the spine[J].J Bone Miner Metab,2013,31(2):136-143.
[3]魏威,张永华,石仕元.颈椎后纵韧带骨化症的易感基因研究现状[J].中国优生与遗传杂志,2010,18(4):11-13.
[4]Terayama K.Genetic studies on ossification of the posterior longitudinal ligament of the spine[J].Spine,1989,14(11):1184-1191.
[5]Tanabe J,Sarin H,Kindt G.Familial ossification of the posterior longitudinal ligament(OPLL)in the thoracic spine:Case report[J].Surg Neurol,2002,58(6):403-405.
[6]Washio M,Kobashi G,Okamoto K,et al.Sleeping habit and other life styles in the prime of life and risk for ossification of the posterior longitudinal ligament of the spine(OPLL):Acase-control study in Japan[J].J Epidemiol,2004,14(5):168-173.
[7]Tsuyama N.Ossification of the posterior longitudinal ligament of the spine[J].Clin Orthop Relat Res,1984,18(4):71-84.
[8]Guo SW,Thompson E.Performing the exact test of Hardy-Weinberg proportion for multiple alleles[J].Biometrics,1992,48:361-372.
[9]Wei W,He HL,Chen CY,et al.Whole exome sequencing implicates PTCH1 and COL17A1 genes in ossification of the posterior longitudinal ligament of the cervical spine in Chinese patients[J].Genet Mol Res,2014,(in press).
[10]Kawaguchi H,Kurokawa T,Hoshino Y,et al.Immunohistochemical demonstration of bone morphogenetic protein-2 and transforming growth factor-β in the ossification of the posterior longitudinal ligament of the cervical spine[J]. Spine,1992,17(Suppl 3):S33-S36.
[11]Kon T,Yamazaki M,Tagawa M,et al.Bone morphogenetic protein-2 stimulates differentiation of cultured spinal ligament cells from patients with ossification of the posterior longitudinal ligament[J].Calcif Tissue Int,1997,60(3):291-296.
[12]Wang H,Yang ZH,Liu DM,et al.Association between two polymorphisms of the bone morpho-genetic protein-2 gene with genetic susceptibility to ossification of the posterior longitudinal ligament of the cervical spine and its severity[J].Chin Med J,2008,121(18):1806-1810.
[13]Furushima K,Shimo-Onoda K,Maeda S,et al.Large-scale screening for candidate genes of ossification of the posterior longitudinal ligament of the spine[J].J Bone Miner Res,2002,17(1):128-137.
Relationship Between the Gene Polymorphisms of BMP-2 and BMP-4 with Ossification of Posterior Longitudinal Ligament of the Spine in a Chinese population
ZHOU Yao1,WEI Wei2,CHEN Chunyue2,YE Yang2. 1 Fenghua Chinese Medical Hospital of Zhejiang Province,Fenghua(315500),China;2 Integrated Chinese and Western Medicine Hospital of Zhejiang Province
ObjectiveTo explore the relationship between 2 single nucleotide polymorphisms(SNPs)of BMP-2 and BMP-4 and ossification of posterior longitudinal ligament of the spine(OPLL)in a Chinese population.MethodsForty-seven sporadic OPLL patients and 100 healthy controls in Zhejiang area were recruited for association analysis.The SNP regions of BMP-2 and BMP-4 genes were amplified by PCR and Sanger sequencing.Genotype frequencies of the SNPs were compared between the cases and control subjects with SPSS 13.0 software.ResultsBoth Of the rs79417223 G→A site in the exon 3 of BMP-2 and the rs147822607 A→C site in the exon 4 of BMP-4,the patient and normal control groups showed significant differences(P<0.05,P<0.01).ConclusionsThe rs79417223 and rs147822607 have a strong correlation to OPLL.
ossification of posterior longitudinal ligament;single nucleotide polymorphism;susceptibility gene;BMP-2 gene;BMP-4 gene
2013-12-01
浙江省医药卫生科技计划项目(No.2010KY168),浙江省宁波市科技计划项目(No.2013C50023)
叶杨,E-mail:dagou1234@163.com
