PRX2和AKR1B10在二阶段化学诱发小鼠肝癌形成过程中的表达及意义
2014-07-01雪谢裕安赵文洁
黄 雪谢裕安 杨 帆 骆 敏 赵文洁
作者单位:530021 南宁 广西肿瘤防治研究所实验研究部;△广西医科大学研究生学院
基础研究
PRX2和AKR1B10在二阶段化学诱发小鼠肝癌形成过程中的表达及意义
黄 雪△谢裕安 杨 帆 骆 敏 赵文洁
作者单位:530021 南宁 广西肿瘤防治研究所实验研究部;△广西医科大学研究生学院
目的 探讨PRX2和AKR1B10在二阶段化学诱发小鼠肝癌形成过程中的表达及意义。方法 90只C57BL/6J雄性小鼠随机分为实验组(60只)和正常对照组(30只),用DEN/CCl4/乙醇诱发小鼠肝癌。于第4周、第8周、第12周、第16周和第20周5个时点处死小鼠,观察其肝脏病理组织的改变,应用实时荧光定量PCR法、免疫组化SP法分别检测小鼠肝组织PRX2 mRNA和AKR1B10 mRNA及蛋白质的表达水平。结果 ①实验诱发小鼠肝癌过程中的第4周见肝细胞肿胀,炎细胞浸润,肝脏呈炎症病变;第8周见肝组织炎症病变加重,出现纤维组织增生及肝细胞再生;第12周见肝组织呈不典型增生;第16周有典型假小叶形成;第20周可见典型的小鼠肝癌病理改变。②化学诱癌的第4周至第20周实验组小鼠肝组织PRX2 mRNA和AKR1B10 mRNA和蛋白质的表达均高于正常对照组(P<0.05),且两者的表达水平随着时间的延长,均呈逐步升高的趋势;至第20周肝癌形成时,实验组两者的表达均显著高于癌前各时间点(P<0.05)。③在二阶段化学诱发小鼠肝癌形成过程中,PRX2 mRNA和AKR1B10 mRNA的表达水平呈正相关(r=0.674,P=0.05)。结论 在二阶段化学诱发小鼠肝癌形成过程中PRX2和AKR1B10的高表达是化学诱发小鼠肝癌形成的早期事件,PRX2和AKR1B10可能在化学诱发小鼠肝癌的发生、发展和促进过程中起重要作用。
肝肿瘤;小鼠肝癌;C57BL/6J小鼠;PRX2;AKR1B10
肝癌是世界上最常见的恶性肿瘤之一,其死亡率仅次于肺癌和胃癌,位于第三位[1]。肝癌的发生历经启动、促进、癌变和进展的过程,联合应用化学诱癌剂和致癌剂可建立小鼠肝癌类似的二阶段过程(激发期和促进期)。PRX2是新发现的过氧化物还原酶,具有抗氧化、参与细胞的增殖和分化及信号转导等作用。AKR1B10是一种醛糖还原酶,其通过调节脂肪代谢和消除羰基而促进细胞生存,调节维甲酸信号通路参与肿瘤的增殖和发展。两者在多种肿瘤组织中呈高表达。有学者利用蛋白质组学技术研究发现,PRX2和AKR1B10是与肝癌发生、发展有关的差异表达蛋白,在大鼠和人肝癌组织中的表达明显增高[2~4]。但在小鼠肝癌模型中未见报道,故本研究应用跨种属筛选肿瘤关键基因策略验证PRX2和AKR1B10在DEN/CCl4/乙醇诱发的二阶段化学诱发小鼠肝癌形成过程中的差异表达,旨在探讨PRX2和AKR1B10在二阶段化学诱发小鼠肝癌形成过程中的表达及意义。
1 材料与方法
1.1 主要试剂与材料
二乙基亚硝胺(DEN)购自美国Sigma公司;四氯化碳(CCl4)购自天津化学试剂研究所;乙醇、橄榄油和福尔马林均购自北京化学试剂公司;苏木精、伊红为上海化学试剂厂产品。总RNA提取试剂Trizol为美国Invitrogen公司产品;M-MuLV反转录试剂盒为加拿大 MBI Fermentas公司产品;RealMaster Mix(SYBR Green)为TAKARA公司产品;一抗兔抗鼠PRX2单克隆抗体、兔抗鼠AKR1B10多克隆抗体、免疫组化SP试剂盒和DAB显色液均购自美国Abgent公司;定量PCR仪为美国MJR公司产品;引物由上海生工生物工程有限公司合成。
1.2 二阶段小鼠肝癌模型的建立
动物实验已通过广西实验动物伦理委员会审批。动物生产许可证号为SCXK(湘)2009-0004,90只C57BL/6J雄性小鼠购自湖南斯莱克景达实验动物有限公司,符合国标GB14922-94 SPF级质量标准。小鼠鼠龄为6~8周,分笼饲养,体重为20~23 g,标准化光照和自由进食及饮水,适应环境7 d。将动物按体重随机分为两组,即实验组60只和正常对照组30只。实验组小鼠首先用DEN(100 mg/kg)一次腹腔注射,第2周再予腹腔注射一次DEN(100 mg/kg),第3周后开始以20%CCl4橄榄油溶液(0.05 ml/10 g)灌胃,2次/周,同时给予含10%乙醇水溶液连续饮用,第8周将CCl4加量至0.06 ml/10 g,第18周后停止给予CCl4和乙醇,继续观察到第20周实验结束,实验期间小鼠喂以颗粒饲料。正常对照组小鼠仅以小鼠颗粒饲料喂养,并自由饮用灭菌饮用水。观察小鼠的背毛、精神饮食和体重等一般情况的改变。于诱癌开始后每4周从实验组及对照组中随机各抽取6只小鼠,打开腹腔观察肝脏表面及色泽,并摘取肝脏组织进行后续实验。连续观察20周后处死所有小鼠。
1.3 免疫组化法检测
小鼠肝组织常规固定、石蜡包埋、切片、HE染色。免疫组化法按SP试剂盒说明书进行,PRX2和AKR1B10一抗抗体滴度分别为1∶100、1∶300。组织标本石蜡切片常规脱蜡去水;以柠檬酸缓冲液行高压抗原修复;一抗4°C培养过夜;二抗37°C培养20 min,DAB显色,苏木精衬染后常规脱水、透明封片。以PBS代替一抗作为阴性对照,以已知阳性标本作为阳性对照。以细胞质出现黄色或棕黄色颗粒为判断标准。在不同高倍视野下计数上中下左右各200个细胞,染色强度判定为:0分为无染色;1分为弱染色;2分为中等强度染色;3分为强染色。阳性细胞率:0分为<1%;1分为<5%;2分为<25%;3分为<50%;4分为≥75%。以染色强度与阳性细胞率之和计算评分,0~1分为阴性(-);2~3分为弱阳性(+);4~5分为阳性(++);6~7分为强阳性(+++)[5]。
1.4 实时荧光定量PCR检测
根据Genbank中PRX2和AKR1B10的mRNA序列设计特异性引物,以β-肌动蛋白(β-actin)作为内参照。见表1。取适量实验组及对照组的肝组织,以传统Trizol法提取总RNA,反转录合成cDNA。将cDNA1∶80稀释后作为PCR模板。实时荧光定量PCR反应在美国MJR公司的定量PCR检测仪上进行。反应体系为20 μl,cDNA为1 μl,上下游引物(10 μmol/L)各0.5 μl,RealMaster Mix(SYBR Green)为12 μl,ddH2O为9 μl。反应条件为94℃5 min,然后94℃30 s,60℃30 s,72℃30 s,共35个循环。每份cDNA样本均在相同反应条件下进行。每个样本均平行重复检测3次。由定量PCR仪采集荧光信号,电脑自动分析荧光信号并显示分析结果循环阈值(cycle threshold,Ct)和实时定量荧光值动态曲线。目的基因的表达以β-actin作内对照,采用2-△△Ct方法[6]分析比较目的基因在实验组和对照组肝组织中的表达差异。
1.5 统计学方法
采用SPSS 18.0软件对数据进行统计学分析。若各组数据服从正态分布、方差齐,则以s表示。计量资料的比较采用两个样本均数的t检验,两个因素的相关性分析采用Spearman相关分析。以P<0.05为差异有统计学意义。

表1 实时荧光定量PCR检测引物序列以及产物长度
2 结果
2.1 诱癌过程中小鼠肝脏的病理组织变化
实验成功建立了二阶段化学诱发小鼠肝癌模型。在诱癌过程中,实验组60只小鼠在第16周和第20周各死亡2只,死亡率为6.7%(4/60),对照组30只无死亡,至第20周实验结束时小鼠成瘤率为76.4%(26/34)。对照组小鼠肝脏表面光滑,色泽鲜艳,质软,显微镜下肝组织未见异常。实验组小鼠肝脏病变表现为:在诱癌的第4周(肝炎期)肝脏表面外观未见异常,显微镜下见肝小叶结构基本完整,肝窦扩张,肝细胞变性肿胀,炎症反应性细胞浸润;第8周(肝纤维化期)炎症反应加重,显微镜下肝小叶结构尚完整,出现纤维组织增生及肝组织再生;第12周(不典型增生期)小鼠肝脏表面开始变为粗糙,肝损伤继续加重,显微镜下肝细胞开始出现非典型增生;第16周(肝硬化期)小鼠肝脏表面变为更粗糙,出现直径<5 mm的灰白色类圆形病灶,显微镜下肝小叶结构不清晰,肝组织分隔成大小不一的结节状,呈现典型的假小叶形成;第20周(肝癌形成期)肝脏表面出现大小不一的灰白色结节,直径为2~10 mm。显微镜下出现肝癌细胞,肝细胞体积增大,呈多形性,细胞核大且深染,核质比增大,核仁显著,可见病理性核分裂相。见图1。
2.2 PRX2和AKR1B10的蛋白表达分析
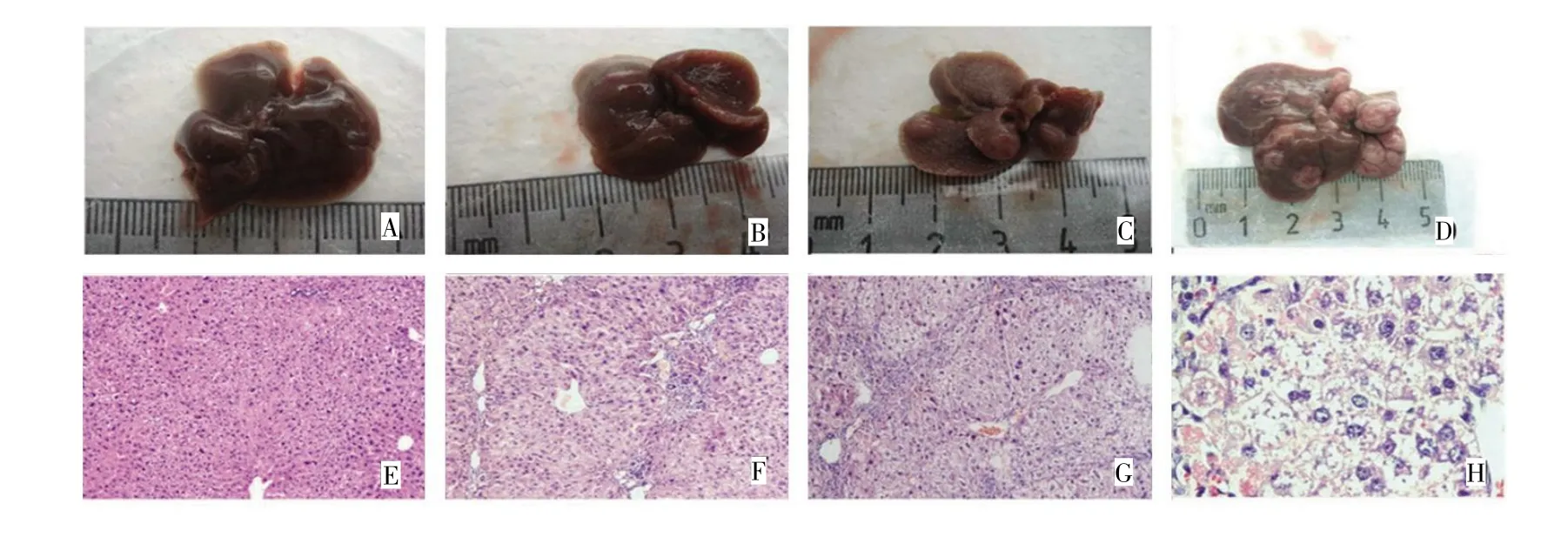
图1 不同诱癌时期小鼠肝组织表面观和显微镜下观察
PRX2和AKR1B10的蛋白阳性表达均定位于细胞质,主要沿汇管区和血管附近表达,在肝癌组织内可见PRX2和AKR1B10阳性细胞呈点状、弥漫性分布,在癌周肝硬化组织及异性增生性结节内可见散在、灶状及结节状PRX2和AKR1B10阳性细胞分布。正常对照组小鼠肝组织中PRX2和AKR1B10为阴性表达。实验组随着小鼠肝脏由炎症、肝纤维化、肝硬化,直至肝癌病变过程中,PRX2和AKR1B10的表达逐渐增加。在第4周至第8周的实验组小鼠肝组织中PRX2和AKR1B10的蛋白表达均为弱阳性;第12周实验组小鼠2只肝组织PRX2的表达呈弱阳性,4只为阳性,AKR1B10的蛋白表达均为阳性;第16周实验组小鼠5只肝组织中PRX2的蛋白表达呈阳性,1只为强阳性,4只小鼠AKR1B10的蛋白表达呈阳性,2只为强阳性;第20周46.9%(15/32)的小鼠肝组织中PRX2的蛋白表达呈强阳性,62.5%(20/32)的小鼠肝组织中AKR1B10的蛋白表达呈强阳性。见图2。
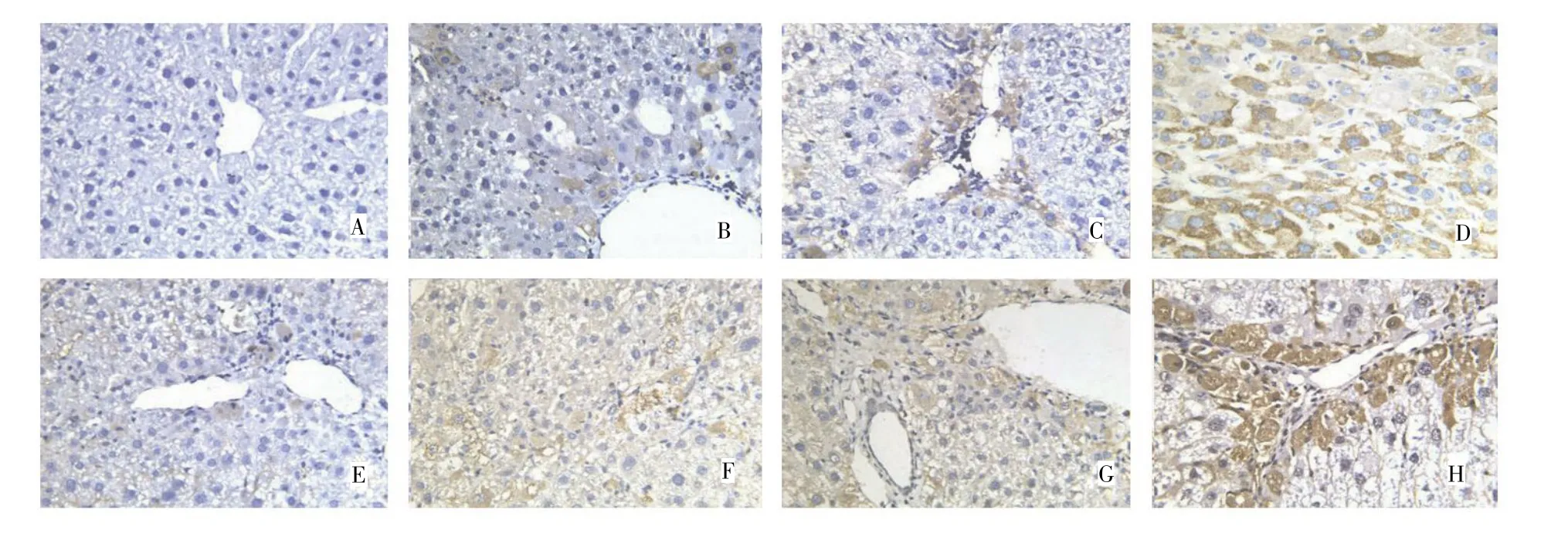
图2 不同诱癌时期小鼠肝组织PRX2和AKR1B10蛋白表达的水平(DAB×400)
2.3 PRX2 mRNA和AKR1B10 mRNA的表达分析
化学诱癌第4周至第20周实验组小鼠肝组织PRX2 mRNA和AKR1B10 mRNA均呈高表达,随着诱癌时间的延长,PRX2 mRNA和AKR1B10 mRNA的表达水平呈同步持续升高,在第20周时PRX2 mRNA和AKR1B10 mRNA的表达均达到最高水平,和对照组比较差异尤为显著。在第4周至第12周实验组之间PRX2 mRNA的差异表达均有统计学意义(P<0.05),在第16周和第12周的表达差异无统计学意义,第20周的表达明显高于第16周,差异有统计学意义(P<0.05);AKR1B10 mRNA在各个诱癌时间段实验组之间的差异表达均有统计学意义(P<0.05)。在二阶段化学诱发小鼠肝癌形成过程中PRX2 mRNA和AKR1B10 mRNA的表达水平呈明显正相关(r=0.674,P=0.05)。见表2。
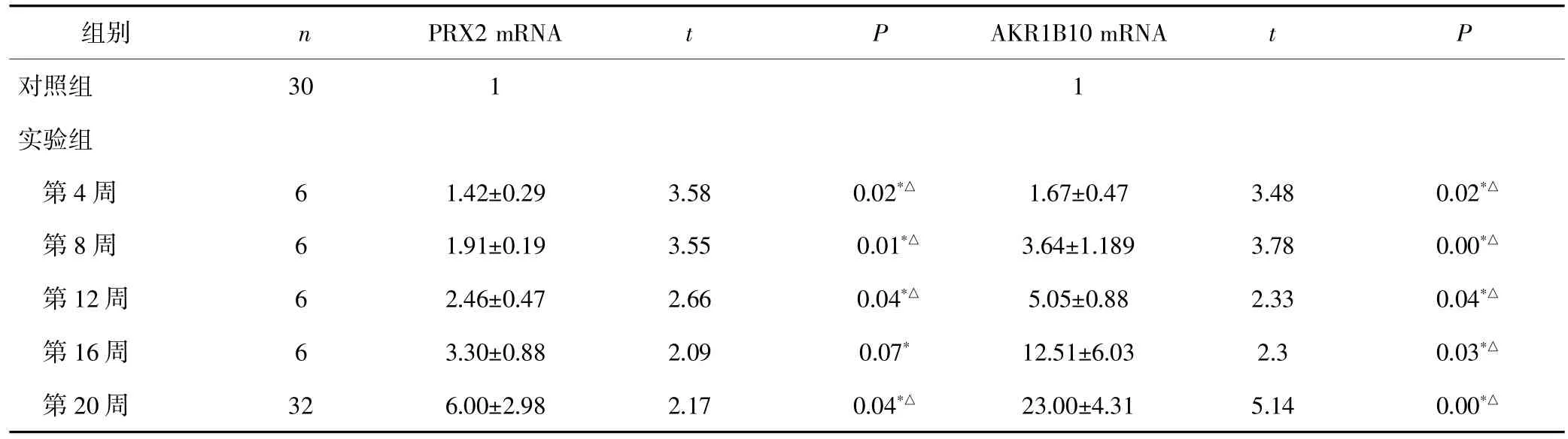
表2 不同诱癌时期小鼠肝脏PRX2 mRNA和AKR1B10 mRNA的表达水平(χ±s)
3 讨论
PRX2定位于细胞质,其功能主要是抗氧化和清除自由基,保护癌细胞免受自由基的损伤,进而刺激细胞增殖,并抑制细胞凋亡。AKR1B10是细胞质内可溶性的单体氧化还原酶,其通过对细胞内羰基的解毒、介导视黄醛的代谢及调节脂肪酸合成,从而促进细胞生存。研究表明,该蛋白主要存在于肝癌和胚胎肝中,在正常成年肝脏中不表达。两者与肿瘤的关系日益密切,目前已有PRX2在多种恶性肿瘤组织中表达升高的报道。在肝癌的报道中,继Fella等[2]通过建立大鼠肝癌模型发现PRX2在大鼠肝癌组织的表达升高之后,Takashima等[3]也发现PRX2在人肝癌组织中呈高表达。岳海英等[7]发现PRX2基因表达沉默后的人肝癌细胞生长和克隆形成能力均明显受到抑制,细胞凋亡率增加。AKR1B10在人体的过表达最早发现于肝癌[4]。有关研究发现,AKR1B10在54.0%的肝细胞癌、84.4%的肺鳞状细胞癌、29.2%的肺腺癌吸烟者中呈高表达,有望作为肿瘤诊断和(或)预后标志[8]。Sato等[9]在慢性丙型肝炎至肝癌的研究表明,AKR1B10不仅是预测肝癌的标志,在肝癌的早期阶段也发挥了重要作用。韦薇等[10]研究结果表明肝癌细胞中AKR1B10的表达被抑制后,其增殖相关基因的表达下降,而促凋亡基因的表达上升,提示可能通过影响相关基因的表达参与调控肝癌细胞的增殖和凋亡。Li等[11]应用蛋白质组学方法筛选出PRX2和AKR1B10作为肝癌发生的差异表达蛋白之一,并研究发现PRX2和AKR1B10在人肝癌组织中的表达为正常对照组、癌旁组织和肝癌组织依次上调。
在本研究中,我们成功应用DEN/CCl4/乙醇诱发小鼠肝癌模型,在小鼠诱癌过程中不同阶段的病理组织变化与人肝癌发生过程比较相似,均经历了从肝损伤、肝纤维化、非典型增生到肝癌的病理变化过程[12],与其他研究相比,该模型更为全面地观察了PRX2和AKR1B10在肝癌形成过程中的差异表达,这是研究人类肝癌发生、发展较好的一种动物模型。本实验在正常对照组小鼠肝组织中PRX2和AKR1B10的蛋白不表达。实验组小鼠在诱癌的第4周,由于肝脏细胞受到大剂量DEN的刺激,出现药物中毒性损伤,肝组织表现为充血水肿、变性坏死的炎性病变,小鼠肝组织中PRX2和AKR1B10的基因表达水平实验组高于对照组,提示PRX2和AKR1B10可能影响化学诱发小鼠肝癌的发生。CCl4自身溶酶的作用可以引起肝损伤,激活肝星状细胞而造成肝纤维化。长期给予乙醇也可造成肝损伤,包括脂肪肝、肝纤维化和肝癌等。所以在CCl4/乙醇长期联合刺激的作用下,至诱癌的第8周至第16周,小鼠肝组织炎性变性加重,随着肝纤维化、假小叶的形成,PRX2和AKR1B10呈持续高表达,说明PRX2和AKR1B10可能参与小鼠肝癌的形成。至诱癌的第20周,当小鼠肝脏出现癌结节之后,PRX2和AKR1B10的表达水平达高峰,实验组两者的表达第4周至第16周均明显高于对照组的表达,提示PRX2和AKR1B10的高表达可能参与小鼠肝癌的发展。同时,本研究也发现PRX2mRNA和AKR1B10 mRNA在小鼠肝癌发生过程中的表达呈正相关(r=0.674,P=0.05)。
综上所述,本研究显示在二阶段化学诱发小鼠肝癌形成过程中PRX2和AKR1B10呈高表达,这是化学诱发小鼠肝癌形成的早期事件。本研究实验结果与PRX2和AKR1B10在人、大鼠肝癌中呈高表达的结果基本一致,提示二者可能参与化学诱发小鼠肝癌的发生、发展过程。但PRX2和AKR1B10之间的协同作用机制尚不清楚,其是否可以成为早期诊断肝癌新的分子标志物或防治靶标,有待进一步研究和验证。
[1]FerlayJ,ShinHR,BrayF,et al.Estimates ofworldwideburdenof cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[2]Fella K,Glückmann M,Hellmann J,et al.Use of two-dimensional gel electrophoresis in predictive toxicology:identification of potential early protein biomarkers in chemically induced hepatocarcinogenesis[J]. Proteomics,2005,5(7):1914-1927.
[3] Takashima M,Kuramitsu Y,Yokoyama Y,et al.Proteomic analysis of autoantibodies in patients with hepatocellular carcinoma[J].Proteomics,2006,6(13):3894-3900.
[4]Cao D,Fan ST,Chung SS.Identification and characterization of a novel human aldose reductase-like gene[J].J Biol Chem,1998,273(19):11429-11435.
[5]于 萍,步 宏,王 华,等.免疫组化结果的图像分析与人工计数方法的对比研究[J].生物医学工程学杂志,2003,20(2):288-290.
[6] Schmittgen TD,Livak KJ.Analyzing real-time PCR data by the comparative C(T)method[J].Nature Protocols,2008,3(6):1101-1108.
[7] 岳海英,代 智,郭 坤,等.PeroxiredoxinⅡ基因在Hep3B细胞中的生物学功能和作用机制[J].中华肝脏病杂志,2008,16(6):435-439.
[8] Fukumoto S,Yamauchi N,Moriguchi H,et al.Overexpression of the aldo-keto reductase family protein AKR1B10 is highly correlated with smokers′non-small cell lung carcinomas[J].Clin Cancer Res,2005,11(5):1776-1785.
[9] Sato S,Genda T,Hirano K,et al.Up-regulated aldo-keto reductase family 1 member B10 in chronic hepatitis C:association with serum alpha-fetoprotein and hepatocellular carcinoma[J].Liver Int,2012,32(9):1382-1390.
[10]韦 薇,梁宏洁,崔杰锋,等.醛酮还原酶1B10基因沉默对MHCC97H细胞生长和基因表达的影响[J].中华肝脏病杂志,2010,18(9):666-671.
[11]Li Y,Qin X,Cui J,et al.Proteome analysis of aflatoxin B1-induced hepatocarcinogenesis in tree shrew(Tupaia belangeri chinensis)and functional identification of candidate protein peroxiredoxin II[J]. Proteomics,2008,8(7):1490-1501.
[12]孔 娜,匡志鹏,杨 帆,等.Axin-1在C57BL/6J小鼠肝癌模型发生过程中的表达及意义[J].中国癌症防治杂志,2014,6(1):7-11.
[2014-03-21收稿][2014-05-06修回][编辑 阮萃才]
Expression and significance of PRX2 and AKR1B10 during chemically induced hepatocarcinogenesis in mice
HUANG Xue△,XIE Yu-an,YANG Fan,LUO Min,ZHAO Wen-jie(Department of Research,Guangxi Cancer Institute;△Graduate School of Guangxi Medical University,Nanning,530021,P.R.China)
Corresponding auther:XIE Yu-an.E-mail:gxwskj@163.com
Objective To explore the expression and significance of PRX2 and AKR1B10 during chemically induced hepatocarcinogenesis in mice.Methods Primary hepatocellular carcinoma(HCC)was induced in 60 C57BL/6J mice by exposing them to a combination of diethylnitrosamines(DEN),carbon tetrachloride(CCl4)and ethanol.Another group of 30 mice
no drugs and served as a negative control.Mice were killed on weeks 4,8,12,16 and 20 and tissue samples were harvested for staining with hematoxylin and eosin.Samples were also analyzed by QPT-PCR and immunohistochemistry to detect changes in PRX2 and AKR1B10 mRNA and protein.Results In mice with chemically induced HCC,toxic hepatitis and acute hepatocellular necrosis were observed by week 4.By week 8,hepatocellular necrosis had gotten worse and liver fibrosis was detectable.Atypical hyperplasia was observable by week 12,pseudolobule by week 16 and hepatocellular carcinoma by week 20.Expression of PRX2 and AKR1B10 was significantly higher in the HCC animals than in control animals from week 4 to 20(P<0.05),and levels continued to increasewith time.Levels were significantly higher in the HCC animals by week 20 than before chemical induction of HCC(P<0.05).Expression of PRX2 mRNA positively correlated with that of AKR1B10 mRNA(r=0.674,P=0.05).Conclusion Overexpression of PRX2 and AKR1B10 may be early events during chemically induced hepatocarcinogenesis in mice and may promote hepatocarcinogenesis.
Liver neoplasm;Hepatocarcinogenesis in mice;C57BL/6J mice;PRX2;AKR1B10
R735.7
A
1674-5671(2014)02-06
10.3969/j.issn.1674-5671.2014.02.03
国家自然科学基金资助项目(81060203)【通信作者】谢裕安。E-mail:gxwskj@163.com
