钙释放激活钙通道调节分子1促进结肠癌细胞系SW480的迁移和侵袭*
2014-06-28康清杰彭旭东邓大炜汤为学
康清杰 向 征 彭旭东 邓大炜 汤为学
钙释放激活钙通道调节分子1促进结肠癌细胞系SW480的迁移和侵袭*
康清杰①向 征①彭旭东①邓大炜①汤为学②
目的:探讨钙释放激活钙通道调节分子1(calcium release-activated calcium channel modulator 1,ORAI1)对SW480迁移和侵袭的影响及其机制。方法:以ORAI1干扰慢病毒感染SW480细胞,用RT-qPCR和Western blot检测细胞中ORAI1mRNA和蛋白的表达,Transwell小室、黏附实验、血管形成及拟态分别检测细胞侵袭、迁移能力,同、异种细胞间黏附及血管生成能力,激光共聚焦显微镜检测细胞钙内流(store-operated Ca2+entry,SOCE),Western blot法检测细胞中ERK1/2、p-ERK1/2、MMP-2、VEGF和E-cadherin蛋白的表达。结果:SW480转染ORAI1干扰慢病毒72h后,可见明显的荧光表达;较空病毒组和(或)对照组,干扰组ORAI1的表达降低(P<0.01);侵袭和迁移能力减弱(P<0.01);同种黏附能力增强(P<0.05);异种黏附能力减弱(P<0.05);血管生成能力减弱(P<0.01);SOCE内流峰值降低(P<0.05);p-ERK1/2、MMP-2和VEGF的表达降低(P<0.01)、E-cadherin表达增加(P<0.01)。结论:ORAI1可以促进SW480的迁移和侵袭,其机制可能与SOCE增加有关。
ORAI1SW480 迁移 侵袭 SOCE
肿瘤侵袭转移是决定患者预后的关键因素,它是指癌细胞从原发灶脱离后向周围和(或)远处组织扩散形成另一肿瘤的过程[1]。Ca2+作为细胞内重要的第二信使,对细胞的黏附、迁移、运动等有重要作用[2]。胞膜蛋白ORAI1是钙库操纵的钙通道(store-operated calcium channels,SOCC)的重要组成蛋白,它通过与内质网膜上的基质相互作用分子1(stromal interaction molecule 1,STIM1)相互作用,激活SOCC,引起细胞外Ca2+内流形成SOCE,进而调节胞内Ca2+的稳态[3]。研究表明,ORAI1介导的SOCE在异常状态时与肿瘤的发生发展密切相关,如在人胶质母细胞瘤中,ORAI1通过SOCE调节外钙内流,参与人胶质母细胞瘤的侵袭[4]。但目前国内外对于ORAI1与结肠癌转移关系的研究较少。本研究拟通过探讨ORAI1对SW480转移的影响及其机制,为结肠癌的转移提供新的理论依据。
1 材料与方法
1.1 材料和细胞株
人结肠癌细胞系SW480、人脐静脉内皮细胞HUVEC(重庆医科大学附属第一医院肿瘤实验室提供);Polybrene、干扰人ORAI1基因的重组慢病毒(shRNA:CGTGCACAATCTCAACTCG)和空载体慢病毒(shRNA:TTCTCCGAACGTGTCACGT)、Polybrene(上海纽恩生物科技有限公司);Trizol、RT-PCR试剂盒、SYBY荧光定量试剂盒(大连TaKaRa宝生生物工程有限公司);Ca2+荧光探针Rhod-2AM(美国,AAT Bioquest公司);毒胡萝卜素(thapsigargin,TG)、Nifedipin(美国,Sigma公司);兔抗人MMP-2、VEGF和E-cadherin多克隆抗体(美国,santa cruz公司);兔抗人ERK1/2和p-ERK1/2多克隆抗体(美国,immunoway公司);兔抗人ORAI1多克隆抗体、鼠抗人β-action单克隆抗体、辣根过氧化物酶标记的羊抗兔IgG和羊抗鼠IgG(武汉三鹰生物技术有限公司);Matrigel基质胶(美国,BD公司)。
1.2 方法
1.2.1 细胞培养 细胞用含10%胎牛血清、5%青霉素-链霉素双抗的RPMI-1640培养基置于37℃、5% CO2培养箱中培养。
1.2.2 分组及慢病毒转染 实验设干扰组、空病毒组、对照组。以每孔2×105个细胞铺6孔板,细胞贴壁,筛选最适MOI,最终2种慢病毒以MOI20感染细胞,再加入5 μg/孔Polybrene,24 h后换液,72 h后用荧光显微镜摄像。
1.2.3 RT-qPCR检测细胞ORAI1 mRNA表达 细胞培养72h后,按说明书提取RNA、逆转录获得cDNA,再进行PCR实时扩增,条件:预变性95℃30 s,然后95℃5 s,60℃30 s,反应40个循环,结果以2-△△Ct值表示待测样本基因表达量相对于校准样本基因表达量的倍数。ORAI1引物序列如下:上游:5'-GCTGCTCTGCTGGG TCAAGTT-3',下游:5'-CGATAAAGATCAGGCCGAAG G-3',片段长179 bp;GAPDH上游:5'-CTTTGGTATCGT GGAAGGACTC-3',下游:5'-GTAGAGGCAGGGATGAT GTTCT-3',片段长132 bp,实验重复3次。
1.2.4 Transwell小室检测细胞侵袭及迁移力 侵袭实验:将Transwell小室(8 μm)放入24孔板,Matrigel胶用4℃无血清培养基(1:5)稀释后取40 μL铺上室,紫外线照射过夜,实验前水化,各组取5×104个/400 μL加入上室,下室加10%胎牛血清培养液600 μL,常规培养24 h,擦去上室细胞,固定,结晶紫染色、切膜、封片、摄像,计数5个视野平均穿膜细胞数。迁移实验:上室内不铺胶,余操作同前,实验重复3次。
1.2.5 黏附实验 取SW480细胞接种于96孔板(2× 104个/100 μL/孔)除第1、7、12列的A-D排孔,取同量HUVEC细胞接种于上述各列的E-H排孔,培养至细胞基本铺满孔板底部;取空病毒组细胞加至96孔板(3×104个/100 μL/孔)第3至7列A-H孔内,等量干扰组细胞加入第8至12列A-H孔内,每隔30 min吸出3、8列,4、9列,5、10列,6、11列所有孔上清液,120 min后离心,吸出2、7、12列所有孔内上清液,吸出后每孔用PBS液轻洗,再加100 μL/孔无血清培养基;除D、E排外的所有孔内加MTT(20 μL/孔),4 h后离心去上清液加DMSO(150 μL/孔),即在570 nm波长处测吸光值(A);计算同(异)种黏附率=[同(异)种各时间段A值-同(异)种空白组A值)]/空载体组或实验组A值,并随机在荧光显微镜下各取5个(×200)视野观察记录D、E排各孔荧光细胞数,实验重复3次。
1.2.6 血管形成实验 细胞培养3天,取上清液离心备用;Matrigel胶用4℃无血清培养基稀释(1:7)后铺于96孔板(40 μL/孔),将HUVEC细胞加入上述孔(2×103个/100 μL);分别加入上述3组细胞上清液100 μL,各孔再加100 μL无血清培养基。常规培养4天,摄像并随机选取5处视野(×200)计录管腔形成数(以细胞连接呈C形即为一个管腔),实验重复3次。
1.2.7 血管拟态实验 铺胶同上,将3组细胞分别加入各铺胶孔(2×103个/100 μL),各孔再加100 μL无血清培养基,培养6天,摄像同上,实验重复3次。
1.2.8 细胞Ca2+内流的测定 细胞铺于激光共聚焦专用培养皿(35 mm),待细胞生长至70%汇合,用PBS冲洗3遍,加入含5 μmol/L Rhod-2/AM的D-Hanks液(无钙、无酚红),37℃孵育35 min,用D-Hanks液洗去多余的Rhod-2/AM,再加入500 μL D-Hanks液孵育30 min后用激光共聚焦显微镜检测,每个皿选1个视野。常规扫描30 s后加入含2 μmol/L TG和5 μmol/L Nifedipin的D-Hanks,继续每6 s扫描1次,待细胞荧光强度基本恢复基线后,加入5 mmol/L的CaCl2,继续扫描,以胞内钙荧光变化曲线的峰值评估SOCE。胞内Ca2+浓度的变化用F/F0表示,Ca2+释放或内流的幅度以(Fmax-F0)与F0表示,其中F0为未作任何处理的基础荧光值,F为任意时间点的荧光值,Fmax为最大荧光值。实验重复3次。
1.2.9 Western blot检 测 细 胞 ORAI1、ERK1/2、p-ERK1/2、MMP-2、VEGF和E-cadherin蛋白表达分别收集各组细胞,加RIPA裂解液(含1%PMSF),冰浴下碎解,低温离心10 min,取上清液,用BCA法定量。每孔加等量蛋白样品,进行SDS-PAGE凝胶电泳,然后电转至PVDF膜、封闭,加入Anti-ORAI1(1:500)、Anti-ERK1/2(1:800)、Anti-p-ERK1/2(1:800)、Anti-MMP-2(1:1 000)、Anti-VEGF(1:800)、Anti-E-cadherin(1:1 000)和Anti-β-actin(1:2 000),4℃过夜,TBST洗膜,加入对应二抗(1:2 500),室温1.5 h,TBST漂洗3次后用ECL发光试剂盒显影。凝胶成像系统扫描分析,以目的蛋白与β-actin的灰度值比值代表目的蛋白的表达水平,实验重复3次。
1.3 统计学分析
2 结果
2.1 重组慢病毒转染SW480的情况
荧光显微镜观察显示,干扰慢病毒和空载体慢病毒感染SW480的效率均达90%以上(图1)。
2.2 ORAI1表达的变化
干扰组ORAI1 mRNA的表达量约为对照组的0.21倍,差异有统计学意义(P<0.01);ORAI1蛋白的表达量约为对照组的0.39倍,差异有统计学意义(P<0.01,图2)。
2.3 侵袭和迁移力变化
在侵袭实验中,干扰组穿膜细胞数(20.13±4.87)明显少于对照组(40.33±6.13)和空病毒组(37.73± 5.42),差异有统计学意义(P<0.01)。在迁移实验中,干扰组穿膜细胞数(28.20±7.23)明显少于对照组(48.93±3.95)和空病毒组(51.73±5.19),差异有统计学意义(P<0.01,图3,4)。
2.4 黏附率变化
在同种细胞黏附实验中,120 min时,干扰组黏附的荧光细胞数(52.93±4.12)明显多于空病毒组(29.53±4.74),差异有统计学意义(P<0.01);而在异种细胞黏附实验中:120 min时,干扰组黏附的荧光细胞数(75.13±7.29)明显少于空病毒组(163.8±9.04),差异有统计学意义(P<0.01)。计算各时段细胞间黏附率显示:干扰组同种细胞间黏附率明显高于空病毒组,差异有统计学意义(P<0.05);而异种细胞间黏附率明显低于空病毒组,差异有统计学意义(P<0.05,表1)。
2.5 血管形成与血管拟态变化
实验结果显示:干扰组血管形成数和血管拟态数均明显少于对照组和空病毒组,差异有统计学意义(P<0.01,表2)。
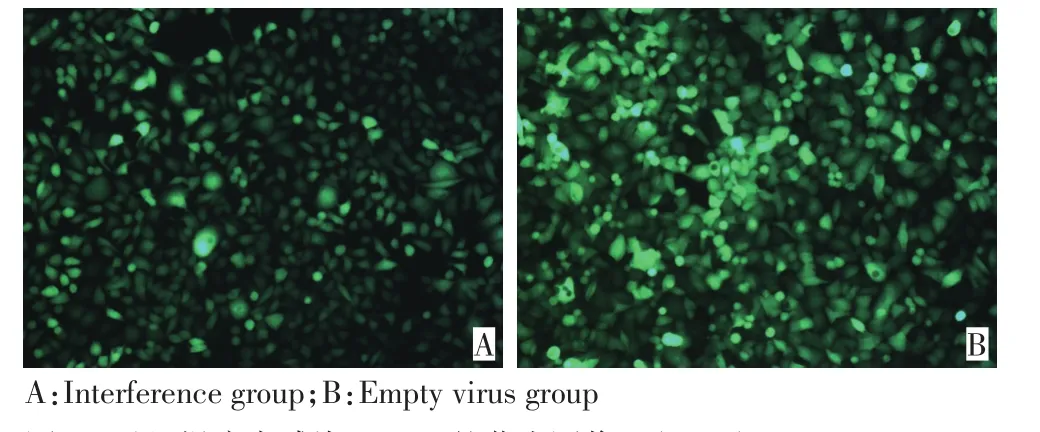
图1 重组慢病毒感染SW480的荧光图像 (×200)Figure 1 Fluoroscopic image of SW480 infected with recombinant lentivirus(×200)
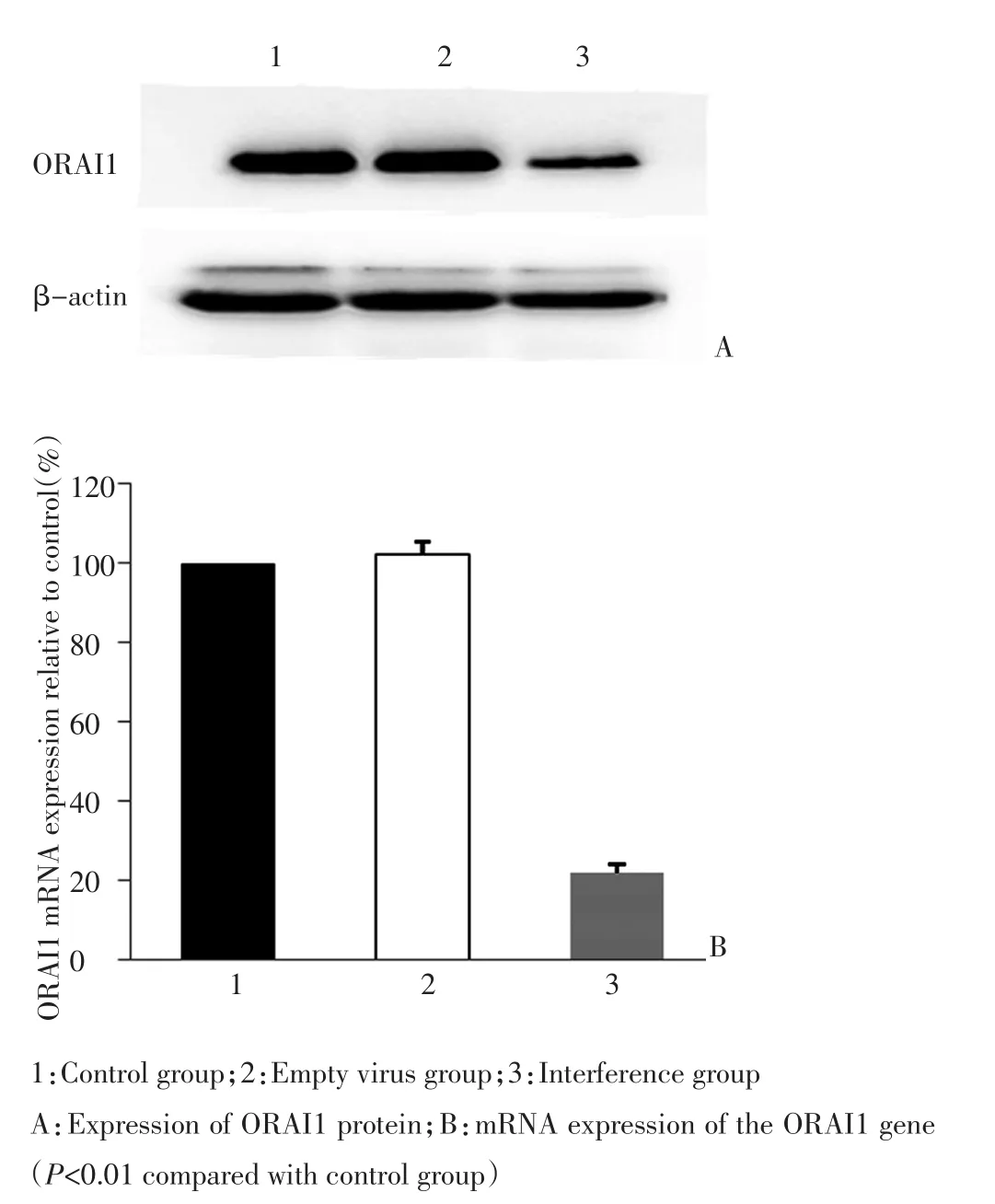
图2 3组细胞ORAI1表达变化Figure 2 Expression change of ORAI1 in the three groups of cells
2.6 外钙内流(SOCE)的变化
激光共聚焦结果显示,各组细胞均成功标记Ca2+荧光探针Rhod-2AM(图5),与对照组和空病毒组相比,干扰组的SOCE上升最大幅度明显下降,差异有统计学意义(P<0.05)。SOCE曲线所代表的是不同时间点同一培养皿同一视野下多个细胞荧光比值的平均值(F/F0,图6)。
2.7 Western blot检测ERK1/2、p-ERK1/2、MMP-2、VEGF和E-cadherin蛋白的表达
3组细胞之间总ERK1/2的表达量没有统计学差异(P>0.05),干扰组p-ERK1/2、MMP-2和VEGF蛋白表达量分别为对照组的0.34、0.38和0.44倍,差异有统计学意义(P<0.01),E-cadherin蛋白表达量为对照组2.44倍,差异有统计学意义(P<0.01,图7)。
表1 同种及异种细胞间黏附率的比较 (±s)Table 1 Comparison between the intercellular adhesion rates of the homogeneous and heterogeneous cells(±s)
*P<0.05 vs.empty virus group;**P<0.01 vs.empty virus group
Categorie Homogeneous cell adhesion Adhesion rate Heterogeneous cell adhesion Group Empty virus group Interference group Empty virus group Interference group 30 min 0.067±0.014 0.072±0.003 0.422±0.031 0.380±0.023 60 min 0.098±0.015 0.128±0.004* 0.613±0.095 0.441±0.046* 90 min 0.122±0.013 0.166±0.014* 0.720±0.048 0.553±0.070* 120 min 0.149±0.017 0.212±0.018* 0.889±0.057 0.594±0.072**
表2 各组间血管形成与血管拟态比较 (±s)Table 2 Comparison of angiogenesis and vascular mimicry among the groups(±s)

表2 各组间血管形成与血管拟态比较 (±s)Table 2 Comparison of angiogenesis and vascular mimicry among the groups(±s)
**P<0.01,compared with control group
Group Control group Empty virus group Interference group Angiogenesis 29.87±5.11 33.40±3.42 11.73±2.25** Vascular mimicry 38.67±5.75 44.20±4.70 19.27±2.86**

图6 3组细胞实时Ca2+荧光强度变化Figure 6 Changes in real-time Ca2+fluorescence intensity of three groups of cells
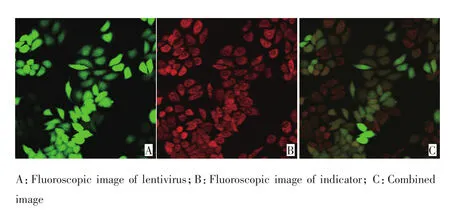
图5 转染细胞标记钙离子探针Rhod-2AM的荧光图像(×400)Figure 5 Fluoroscopic image of infected cells marked by Ca2+indicator Rhod-2Am(× 400)

图7 各组细胞ERK1/2、p-ERK1/2、MMP-2、VEGF和E-cadherin蛋白的表达变化Figure 7 Changes in protein expression of ERK1/2,P-ERK1/2,MMP-2,VEGF,and E-cadherin among the groups
3 讨论
侵袭与转移是恶性肿瘤最主要的生物学行为,它与细胞的黏附、运动、血管生成等密切相关[5]。SOCC介导的SOCE是非兴奋细胞产生Ca2+内流的主要方式,它通过调节胞内Ca2+的浓度,参与细胞的黏附、运动、增殖等过程[2]。Yang等[6]发现在乳腺癌动物模型中抑制STIM1和ORAI1蛋白的表达后,可以降低肿瘤细胞的远处转移能力,并且发现抑制0RAI1表达后肿瘤细胞的侵袭能力抑制更明显。所以本文选取ORAI1作为研究靶标。
本实验沉默SW480细胞ORAI1的表达后。通过Transwell侵袭和迁移实验、黏附实验、血管形成和血管拟态实验发现,干扰组细胞侵袭、迁移能力减弱;血管形成及血管拟态能力减弱;同种细胞间黏附力增强,而异种细胞间黏附力减弱。结果说明,ORAI1能促进SW480细胞的侵袭和迁移、促进细胞脱落与异种组织黏附、提升肿瘤新生血管的能力,最终诱导肿瘤转移。
肿瘤细胞发生远处转移,必须要克服黏附分子介导的细胞间黏附力而从原发灶脱离。上皮钙黏蛋白(E-cadherin)通过维持同质细胞间的黏附来降低细胞的侵袭性[7]。Hu等[8]在研究SOCE与乳腺癌细胞上皮间质转化(EMT)的关系时发现,Ca2+内流可以通过诱导E-cadherin表达降低参与乳腺癌MCF-7细胞系EMT的发生。这与本研究结果有相同之处,沉默ORAI1的表达后,细胞Ca2+内流降低,E-cadherin表达增加,细胞间粘附增强。由此推测,在SW480中ORAI1通过调节外钙内流控制细胞间的粘附。
肿瘤的侵袭转移过程涉及到细胞外基质(ECM)的降解。基质金属蛋白酶(MMPs)是一类能降解ECM的酶类,MMP2是其中最重要的成员之一[9]。Ca2+可以直接通过与CaM(钙调蛋白)结合激活Ras,再通过激活raf、MEK级联激活ERK1/2[10]。活化的ERK1/2则通过诱导MMP2的表达参与肿瘤的浸润转移[11-12]。本实验同样发现:干扰组细胞内磷酸化ERK1/2减少,MMP2表达降低。结果说明Ca2+可能通过促进了SW480细胞内ERK1/ 2活化及MMP2的表达参与其侵袭转移的调控。
肿瘤的浸润与转移还依赖于肿瘤血管形成,肿瘤细胞可以通过产生并分泌VEGF促进血管内皮细胞增殖,导致血管生成[13]。研究发现,Ca2+内流可以刺激肿瘤细胞释放VEGF[14]。这与本实验结果相同,干扰组细胞内VEGF表达明显降低。结果说明Ca2+促进了SW480细胞VEGF的表达。
综上所述,本研究发现在SW480细胞中,ORAI1可能通过介导SOCE促进胞外Ca2+内流,引起ERK1/2磷酸化、MMP2、VEGF表达的增加,E-cadherin表达降低,最终促进SW480细胞的转移。本研究首次探讨了ORAI1调控结肠癌细胞侵袭和转移的可能机制,是对Ca2+促进细胞转移机制的重要补充,后续将通过体内实验进一步验证。
1 Ariake K,Ohtsuka H,Motoi F,et al.GCF2/LRRFIP1 promotes colorectal cancer metastasis and liver invasion through integrin-dependent RhoA activation[J].Cancer Lett,2012,325(1):99-107.
2 Lourido S,Shuman J,Zhang C.et al.Calcium-dependent protein kinase 1 is an essential regulator of exocytosis in Toxoplasma[J].Nature,2010,465(7296):359-362.
3 Wei-Lapierre L,Carrell EM,Boncompagni S,et al.Orai1-dependent calcium entry promotes skeletal muscle growth and limits fatigue[J].Nat Commun,2013,4:2805.doi:10.1038/ncomms3805.
4 Motiani RK,Hyzinski-García MC,Zhang X,et al.STIM1 and Orai1 mediate CRAC channel activity and are essential for human glioblastoma invasion[J].Pflugers Arch,2013,465(9):1249-1260.
5 Li XM,Bai XC,Deng F,et al.Phospholipase Cγ1 and NF-κB are required for cell-matrix adhesion of colorectal cancer cells[J].Acad J Sec Mil Med Univ,2005,26(5):465-470[李秀梅,白晓春,邓 凡,等磷脂酶Cγ1及NF-κB在结直肠癌细胞与基质黏附中的作用及信号转导机制[J].第二军医大学学报,2005,26(5):465-470.]
6 Yang S,Zhang JJ.Huang XY.ORAI1 and STIM1 Are Critical for Breast Tumor Cell Migration and Metastasis[J].Cancer Cell,2009,15 (2):124-134.
7 Chan AO.E-cadherin in gastric cancer[J].World J Gastroenterol, 2006,12(2):199-203.
8 Hu J,Qin K,Zhang Y,et al.Downregulation of transcription factor Oct4 induces an epithelial-to-mesenchymal transition via enhancement of Ca2+influx in breast cancer cells[J].Biochem Biophys Res Commun,2011,411(4):786-791.
9 Tang J,Hui J.PTTG Expression and Its Relationship with MMP-2 and VEGF in Ovarian Serous Tumor[J].Chin J Clin Oncol,2010,37 (8):437-439.[汤 捷,惠 京.卵巢浆液性肿瘤PTTG的表达与MMP-2及VEGF的关系[J].中国肿瘤临床,2010,37(8):437-439.]
10 Huber R,O'Day DH.EGF-like peptide-enhanced cell motility in Dictyostelium functions independently of the cAMP-mediated pathway and requires active Ca2+/calmodulin signaling[J].Cell Signal,2011,23(4):731-738.
11 Jang XF,Li H,Liu L,et al.NF-κ B and MMP-2 expression regulatedby Lrig 1 through the MEK-ERK signaling pathway in Hazaks' esophageal squamous cell carcinoma[J].Chin J Clinl Oncol,2013,40 (10):575-578.[姜孝芳,李 卉,刘 玲,等.哈萨克族食管癌患者中Lrig1通过MEK-ERK信号通路调控NF-κB及MMP-2表达[J].中国肿瘤临床,2013,40(10):575-578.]
12 Mendes O,Kim HT,Lungu G,et al.MMP-2 role in breast cancer metastasis development and its regulation by TIMP and ERK1/2 [J].Clin Exp Metastasis,2007,24(5):341-351.
13 Lee TK,Poon RT,Yuen AP,et al.Regulation of angiogenesis by Id-1 through hypoxia-inducible factor-1alpha-mediated vascular endothelial growth factor up-regulation in hepatocellular carcinoma[J].Clin Cancer Res,2006,12(23):6910-6919.
14 Chen YF,Chu WT,Chen YT,et al.Calcium store sensor stromal-interaction molecule 1-dependent signaling plays an important role in cervical cancer growth,migration,and angiogenesis[J]. Proc Natl Acad Sci USA,2011,108(37):15225-15230.
(2014-06-07收稿)
(2014-07-20修回)
(本文编辑:贾树明)
Calcium release-activated calcium channel modulator 1 promotes the migration and invasion of SW480 colon cancer cell line
Qingjie KANG1,Zheng XIANG1,Xudong PENG1,Dawei DENG1,Weixue TANG2
Zheng XIANG;E-mail:xzly@medmail.com.cn
1Department of Gastrointestinal Surgery,The First Affiliated Hospital of Chongqing Medical University,Chongqing 400016, China;2Research Institute of The FirstAffiliated Hospital of Chongqing Medical University,Chongqing 400016,China
This work was supported by grants from Chongqing Municipal Key Scientific Project(No.cstc2012gg-yyjs10044)and the Science and Technology Project of Yuzhong District,Chongqing(No.20130120)
Objective:To explore the effect of calcium release-activated calcium channel modulator 1(ORAI1)on the migration and invasion of colon cancer cell line SW480 and its mechanism.Methods:The SW480 cells were infected with ORAI interference lentivirus.The expression of ORAI1 mRNA and protein was confirmed by quantitative real-time polymerase chain reaction and Western blot.Transwell chamber,adhesion,angiogenesis,and vasculogenic mimicry experiments were conducted to detect the ability of cell invasion,migration,and angiogenesis and the intercellular adhesion of homogeneous and heterogeneous cells among each group. Confocal microscopy was employed to detect the difference of store-operated Ca2+entry(SOCE)in each group.Western blott was used to detect the expression of ERK1/2,p-ERK1/2,MMP-2,VEGF,and E-cadherin protein.Results:After the infection of SW480 with the ORAI1 interference lentivirus for 72 h,significant fluorescence expression was observed.Compared with the empty vector group and control group,the expression of ORAI1 was lower in the interference group(P<0.01).Invasion and migration ability decreased(P<0.01);the intercellular adhesion ability of homogeneous cells increased(P<0.05);the intercellular adhesion ability of heterogeneous cells decreased(P<0.05);the angiogenesi and vasculogenic mimicry were enhanced(P<0.01);the internal flow peak of SOCE was low (P<0.05);the expression of p-ERK1/2,MMP-2,and VEGF proteins decreased(P<0.01);and the expression of E-cadherin protein increased(P<0.01).Conclusion:ORAI1 may promote the migration and invasion of SW480.This mechanism may be associated with the increase of SOCE.
ORAI1,SW480,migration,invasion,SOCE

10.3969/j.issn.1000-8179.20140964
①重庆医科大学附属第一医院胃肠外科(重庆市400016);②实验研究中心
*本文课题受重庆市科技攻关项目(编号:cstc2012gg-yyjs10044)和重庆市渝中区科技项目(编号:20130120)资助
向征 xzly@medmail.com.cn
康清杰 专业方向为胃肠道肿瘤临床与基础研究。
E-mail:406041847@qq.com
