LZTS2抑癌基因与肿瘤相关性的研究进展*
2014-06-28王枭雄张大明赵世光
王枭雄 杨 光 张大明 陈 鑫 赵世光
·国家基金研究进展综述·
LZTS2抑癌基因与肿瘤相关性的研究进展*
王枭雄 杨 光 张大明 陈 鑫 赵世光
亮氨酸拉链肿瘤抑制因子2(leucine zipper tumor suppressor 2,LZTS2)是一种新的肿瘤抑制基因,近年受到越来越多的关注。目前许多研究表明,LZTS2与多种肿瘤的发生和细胞异常增殖等多个环节密切相关,是重要的候选肿瘤抑制基因,可为肿瘤的治疗提供新的思路。
亮氨酸拉链肿瘤抑制因子2 抑癌基因 肿瘤
亮氨酸拉链肿瘤抑制蛋白家族在对相关蛋白的转录和细胞周期的调节过程中起重要作用。通过对基因组及染色体组改变的分析,现已知其中3个成员(LZTS1/FEZ1、LZTS2/LAPSER1和LZTS3/ProSapip1)在多种类型的肿瘤中表达异常或缺失并参与肿瘤发生与增殖等过程[1-2]。
1 LZTS2/LAPSER1基因的位置与结构
LZTS2/LAPSER1位于人类染色体10q24.3,并与抑癌基因PTEN相邻,其在多种肿瘤(食管癌、前列腺癌、膀胱癌、乳腺癌、肺癌)中表达异常或缺失。LZTS2/LAPSER1在正常的前列腺、睾丸和卵巢组织中表达水平最高[1,3]。
LZTS2/LAPSER1基因长度约为10.6kb,其中包含有5个外显子。通过比较LZTS2/LAPSER1和LZTS1/FEZ1基因,可以看出LZTS2/LAPSER1的外显子3和4可能来源于LZTS1/FEZ1的外显子2。LZTS2/ LAPSER1基因有3种转录异构体:Ⅰ型(主要)、Ⅱ型和Ⅲ型(次要)。其中Ⅰ型异构体包含全部外显子,而Ⅱ型和Ⅲ型异构体则分别缺少外显子3和4。来源于转录异构体Ⅰ(含有1 932 bp的ORF、含639 bp的3'-UTR和156-206 bp 5'-UTR)的LZTS2/LAPSER1 cDNA编码含有644/699个氨基酸分子量为70.3/72.8 kD的蛋白。LZTS2/LAPSER1基因在脊椎动物中高度保守,其编码蛋白和LZTS1/FEZ1蛋白氨基酸序列具有38%一致性。LZTS2/LAPSER1蛋白中存在3个亮氨酸拉链结构域(LZ1、LZ2、LZ3),其中LZ1是由外显子4编码,LZ2和LZ3则是由外显子5编码。LZTS2/ LAPSER1蛋白的N-末端还有由外显子2和3分别编码的PGS富集区和SGP富集区,而C-末端则存在由外显子4和5分别编码的位于LZ两端的谷氨酸富集区(Q1和Q2)。另外,在两者的C-末端发现了与LZ和Q富集区相一致的螺旋结构,在N-末端发现富含α-螺旋和β-折叠结构,以上这些结构为转录因子间成分相互结合的基础[3]。
2 LZTS2/LAPSER1是一种新的抑癌基因
Yofre等[3]通过LZTS2/LAPSER1 cDNA和细胞周期蛋白依赖性激酶抑制剂转染实验发现在LNCaP、TSUPr1、PC3、U2Os、HEK-293、AT6.2和正常大鼠成纤维细胞中LZTS2/LAPSER1过量表达可以抑制细胞增殖和细胞集落形成的能力。Cui等[4]应用免疫组织化学研究89例肺癌组织,结果显示非小细胞肺癌组织中的LZTS2/LAPSER1更低,且LZTS2/LAPSER1的过表达水平与非小细胞肺癌类型、肿瘤的状态和淋巴结侵袭情况有关。Daniel等[1]在LZTS2/LAPSER1敲除小鼠模型中发现,LZTS2/LAPSER1杂合子和纯合子缺失均可提高肿瘤的发生率,并且纯合子敲除的小鼠模型中肿瘤的发生率高于杂合子敲除模型。Jong等[5]发现在结肠癌、胶质瘤和前列腺癌中LZTS2/ LAPSER1的下调可以增强cyclin D1和c-myc的表达,从而促进细胞增殖。与上述结果相反,Hyun等[6]在hACS(human adipose tissue derived from mesenchymal stem cells)中的RT-PCR结果显示NF-κB的下调可抑制cyclin D1表达,最终抑制细胞增殖。
3 LZTS2/LAPSER1的作用机制
3.1 LZTS2/LAPSER1调节基因的转录过程
LZTS2/LAPSER1含有的Q富集区和LZ结构与bZIP转录因子家族中的CREB/ATF和CREM以及其他基因转录调节蛋白具有相似的功能结构域。其中,位于Q富集区两侧N-末端的P-Box和C-末端的LZ为蛋白作用结构域。其中一些蛋白可直接结合DNA的增强子和启动子,另外一些则通过蛋白间相互作用从而影响基因的转录过程[3]。
3.2 LZTS2/LAPSER1的不同转录异构体及其剪切体对其功能的影响
Northern blot分析结果显示LZTS2/LAPSER1在多种组织中的表达存在差异性。Yofre等[3]对前列腺癌细胞系DU145、LNCaP、TSUPr1、PC3、PC3-M、PPC1和ND1及肉瘤细胞系SaOs2、肺癌细胞系H1299、人胚肾细胞系HEK-293、成纤维细胞系BUD-8和原发前列腺癌组织细胞中进行筛查,发现除DU145和ND1外,其余细胞系中均有LZTS2/LAPSER1基因表达,但其表达水平各不相同,而LZTS1/FEZ1基因在所有组织中表达均相同。由于LZTS2/LAPSER1基因在不同组织细胞的表达存在差异,导致了其转录异构体和剪切体的种类含量也有不同。LZTS2/LAPSER1主要转录异构体水平的下调和剪切体水平的上调均会削弱LZTS2/LAPSER1基因的效应。
3.3 LZTS2/LAPSER1与邻近及相关抑癌基因的相互作用
PTEN基因在多种肿瘤中存在突变,被认为是重要的抑癌基因[7]。但有研究表明PTEN基因在多种原发性肿瘤和肿瘤早期中突变不是十分明显,提示PTEN基因的突变可能是肿瘤演进过程中的晚期事件。而LZTS2/LAPSER1基因位于其附近且可参与调节细胞增殖,提示LZTS2/LAPSER1基因与PTEN基因间可能存在相互作用并参与肿瘤晚期进程[8-12]。Iida等[13]在互补DNA微阵列实验中发现抑制Tsc-22表达后导致LZTS2/LAPSER1和Gadd45b基因的表达上调。在小鼠BNL-CL.2细胞中应用Tsc-22siRNA抑制Tsc-22表达后,Gadd45b的表达在经历短时的下降后反而表达上调,而LZTS2/LAPSER1则一直处于高表达状态。以上说明LZTS2/LAPSER1与邻近及相关抑癌基因可能在肿瘤进展的不同时期存在协同或抑制作用。
3.4 LZTS2/LAPSER1参与调节重要信号通路
3.4.1 β-catenin与LZTS2/LAPSER1之间的相互作用 β-catenin作为黏附复合体的一部分,其将黏附素和肌动蛋白骨架联系在一起,同时又是Wnt通路的重要中介物,在调节胚胎发育、细胞极性形成、肿瘤的生成和干细胞功能方面有重要作用。异常的Wnt/ β-catenin通路可破坏胚胎形成,同时与多种人类的恶性疾病有关[14-17]。
在LZTS2/LAPSER1蛋白C-末端存在REV样亮氨酸富集的NES序列,通过此序列LZTS2/LAPSER1可实现对β-catenin胞内分布的调节。Gregory等[18]通过酵母双杂交实验和GST pull-down实验证明,LZTS2/LAPSER1通过C-末端的447-669氨基酸序列与β-catenin的全长armadillo序列(134-671)结合。在DU145、LNCaP、PC3中,LZTS2/LAPSER1可抑制β-catenin介导的TCF/LEF转录过程;在CV-1和PC3中显示LZTS2/LAPSER1蛋白受CRM1/exportinα信号通路调节分布于胞浆中,并通过C-末端的NES序列调控β-catenin分布。
3.4.2 NF-κB、LZTS2/LAPSER1与Wnt/β-catenin在多细胞水平上存在相互作用 NF-κB为免疫应答和细胞凋亡的重要调节物,其突变可以导致免疫性疾病和肿瘤的发生,且为包括慢性淋巴细胞型白血病在内的多种肿瘤的预后标记物[19-24]。Jong等[5]通过对LZTS2/LAPSER1启动子序列的分析发现其含有7个潜在的NF-κB结合位点。通过SKBR3和U87MG细胞的转染实验还证明NF-κB调节LZTS2/LAPSER1转录的结合位点位于-1 241和-1 637 bp之间。NF-κB和CREB可以通过竞争性结合LZTS2/LAPSER1上的CREB结合位点来调控LZTS2/LAPSER1的表达。Hyun等[6]发现LZTS2/LAPSER1的表达可以抑制由NF-κB介导的β-catenin核内聚集过程。进一步通过siRNA沉默技术发现下调LZTS2/LAPSER1的表达可增加核内β-catenin的浓度和NF-κB在hASCs中的活性,同时伴随β-TrCP1d表达增加和IκB水平下降。与此同时Western blot结果表明LZTS2/LAPSER1表达下调,可提高hASCs细胞中β-catenin的总水平和核中含量,同时也增加p65在细胞核内的含量(总含量无变化)。Wang等[25]报道可以通过β-TrCP1介导的IκB降解诱导NF-κB的活性变化。Hyun等[6]在运用LZTS2/LAPSER1的siRNA沉默LZTS2/LAPSER1以后,RT-PCR和Western blot的结果显示在LZTS2/ LAPSER1表达下降的hASCs中,还伴随β-TrCP1表达增高和IκB表达水平降低,与上述结果一致。
但是,NF-κB在不同肿瘤/细胞系中对β-catenin/ Tcf和LZTS2/LAPSER1的影响不同。Hyun等[26]发现在人胶质母细胞瘤系U87MG和GBM-05中,NF-κB可正向调节β-catenin/Tcf信号通路,但在结肠癌细胞系COLO-201和KM12C、肝癌细胞系HepG2和HepG3B及乳腺癌细胞系SKBR3中NF-κB的作用相反。在结肠癌细胞系COLO-201和KM12C、肝癌细胞系HepG2和HepG3B及乳腺癌细胞系SKBR3中,NF-κB可正向调节LZTS2/LAPSER1的表达,但在人胶质母细胞瘤系U87MG和GBM-05中NF-κB的作用相反。通过转染LZTS2/LAPSER1和沉默LZTS2/ LAPSER1实验表明抑制LZTS2/LAPSER1的表达可降低除胶质瘤外的结肠癌、乳腺癌和前列腺癌中的NF-κB的活性[5]。
另外,由免疫抑制和免疫抵抗所致的免疫逃逸、增殖、侵袭与转移共同被视为是恶性肿瘤的主要特征。在肿瘤的生长过程中,肿瘤细胞、免疫细胞以及其他基质细胞相互联系共同构成了一个免疫抑制微环境,这一微环境使得发生上皮间质转化及肿瘤干细胞等肿瘤细胞亚群具有免疫抑制和抵抗的能力,这一过程称为免疫编辑。其中包括减少肿瘤免疫原性以及诱导免疫抑制分子和细胞等一系列机制。这些改变最终导致肿瘤的增殖和侵袭。同时经历免疫系统筛选后的肿瘤细胞因其基因组的不稳定性导致肿瘤细胞致癌信号的激活,从而影响参与肿瘤免疫抵抗和免疫逃逸的诸如STAT3、MAPK、NF-κB和Wnt/β-catenin等肿瘤免疫抑制相关的上游信号通路的活性[27]。
NF-κB作为固有免疫和获得性免疫应答中的关键调节物,其信号异常可导致相关免疫疾病的发生。NF-κB在中枢免疫耐受的建立和调节外周Treg细胞的功能方面具有重要作用,其也可通过NF-κ B-TCR信号通路参与T细胞的增殖和分化过程。NF-κB的表达下调还与慢性炎症性自身免疫疾病有关,而慢性炎症性自身免疫疾病的发生与多种恶性肿瘤密切相关[28-29]。
Wnt/β-catenin信号通路在胸腺细胞的分化及记忆细胞的形成方面具有重要作用。在Tcf1缺陷小鼠中可发生胸腺细胞成熟障碍,包括双阴性细胞或单阴性细胞的产生。而N-末端含有β-catenin结合区域的Tcf1 45异构体可逆转上述情况的发生[13]。有研究[30-32]发现Wnt信号通路可促进Satb1、β-catenin和组蛋白乙酰转移酶Ep300结合于Gata启动子。在Th2细胞中沉默β-catenin表达后,可出现Gata3和IL-4表达水平的下降。Zhao等[30-33]利用染色质免疫沉淀等方法显示Tcf1和β-catenin结合于Gata3-1b上游的Tcf1结合区并促进Gata3-1b转录。Tomonori等[31]发现β-catenin/Tcf可直接结合于IL-10启动子,促进IL-10的表达并影响黑色素瘤中DC细胞的成熟,还可增强黑色素瘤细胞对CTL溶细胞作用的抵抗。
Wnt/β-catenin和NF-κB信号通路广泛的参与免疫细胞的分化、发育及肿瘤免疫等过程中,这为LZTS2/LAPSER1通过Wnt/β-catenin或NF-κB信号通路参与肿瘤免疫的调节过程提供了可能,但目前尚缺乏相关方面的研究。
综上可以看出,LZTS2/LAPSER1、NF-κB与Wnt/ β-catenin在多细胞水平上存在相互作用,并与肿瘤免疫存在可能联系,均预示LZTS2/LAPSER1作为肿瘤抑制因子的潜在重要作用。
3.4.3 APC和LZTS2/LAPSER1对β-catenin的影响 超过80%的结直肠癌含有突变的APC基因,其编码的非活化状态不完整蛋白不能结合Axin和其他调节蛋白最终导致β-catenin的聚积[34-36]。Gregory等[18]发现在结直肠癌细胞中,LZTS2/LAPSER1位于胞浆中并参与调节同样位于胞浆中的β-catenin的胞内分布过程。然而Cui等[4,18]发现肺癌细胞中存在的完整APC蛋白能维持细胞核中β-catenin相对较低水平,同时在大多数肺癌中LZTS2/LAPSER1主要位于细胞核中,而β-catenin则主要位于细胞膜上。以上这些不同导致肺癌中LZTS2/LAPSER1和β-catenin间的作用并不明显。另外,在肺癌细胞中LZTS2/LAPSER1可通过GSK3β/Akt信号途径促进β-catenin降解从而抑制依赖Lef/Tcf的转录过程,同时LZTS2/LAPSER1也可与Dvl-1(主要位于细胞核内)共同调节依赖Lef/ Tcf的转录过程[4]。Gregory等[18]将野生型APC导入SW480细胞(APC突变)后促进了β-catenin的降解。同时在比较野生型和LZTS2/LAPSER1突变的SW480细胞后发现,在野生型SW480细胞中LZTS2/LAPSER1的过量表达也可以造成β-catenin核内水平的下降,但是在LZTS2/LAPSER1突变的SW480细胞中内源性β-catenin水平却无显著变化。这也提示LZTS2/ LAPSER1虽然可调节β-catenin水平变化,但可能不是影响β-catenin水平的主要调节物。LZTS2/LAPSER1作用机制见图1。
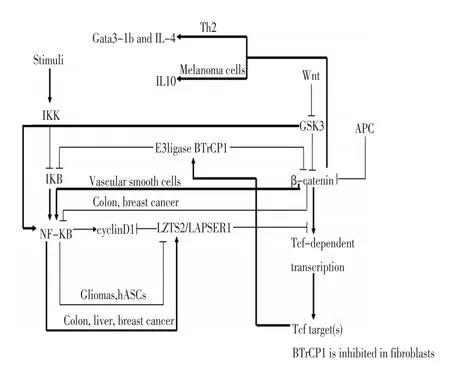
图1 不同细胞内LZTS2/LAPSER1相关信号间的联系和作用Figure 1 Relationship and role of correlated signals of LZTS2/LAPSER1 in various cells
4 展望
LZTS2/LAPSER1作为LZTS1/FEZ1相关基因,广泛存在于多种肿瘤组织中可参与调节肿瘤细胞增殖等生物事件,还可与附近相关抑癌基因共同参与肿瘤晚期进展等过程,为肿瘤的基因治疗提供了新的方向但LZTS2/LAPSER1作为新的抑癌基因调控肿瘤的详细机制仍需进一步探讨。
1 Daniel TJ,Richard L,Suk HL,et al.Deletion of leucine zipper tumor suppressor 2(Lzts2)increases susceptibility to tumor development[J].J Biol Chem,2013,288(6):3727-3738.
2 Teufel A,Weinmann A,Galle PR,et al.In silico characterization of LZTS3,a potential tumor suppressor[J].Oncol Rep,2005,14(2):547-551.
3 Yofre CA,Timothy CT,Jorge LS,et al.LAPSER1:a novel candidate tumor suppressor gene from 10q24.3[J].Oncogene,2001,20 (46):6707-6717.
4 Cui QZ,Tang ZP,Zhang XP,et al.Leucine zipper tumor suppressor 2 inhibits cell proliferation and regulates Lef/Tcf-dependent transcription through Akt/GSK3β signaling pathway in lung cancer [J].J Histochem Cytochem,2013,61(9):659-670.
5 Jong MK,Ji SS,Hyun HC,et al.Effect of the modulation of leucine zipper tumor suppressor 2 expression on proliferation of various cancer cells functions as a tumor suppressor[J].Mol Cell Biochem, 2011,346(1-2):125-136.
6 Hyun HC,Hye JJ,Ji SS,et al.Crossregulation of β-catenin/Tcf pathway by NF-κ B is mediatedby lzts 2 in human adipose tissue-derived mesenchymal stem cells[J].Biochim Biophys Acta, 2008,1783(3):419-428.
7 Phin S,Moore MW,Cotter PD.Genomic rearrangements of PTEN in prostate cancer[J].Front Oncol,2013,3:240.
8 Chen M,Nowak DG,Trotman LC.Molecular pathways:PI3K pathway phosphatases as biomarkers for cancer prognosis and therapy[J].Clin Cancer Res,2014,20(12):3057-3063.
9 Olar A,He D,Florentin D,et al.Biological correlates of prostate cancer perineural invasion diameter[J].Hum Pathol,2014,45 (7):1365-1369.
10 Al Bashir S,Alshalalfa M,Hegazy SA,et al.Cysteine-rich secretory protein 3(CRISP3),ERG and PTEN define a molecular subtype of prostate cancer with implication to patients'prognosis[J].J Hematol Oncol,2014,7(7):1-11.
11 Yue S,Li J,Lee SY,et al.Cholesteryl ester accumulation induced by PTEN loss and PI3K/AKT activation underlies humanprostate cancer aggressiveness[J].Cell Metab,2014,19(3):393-406.
12 Choy E,MacConaill LE,Cote GM,et al.Genotyping cancer-associated genes in chordoma identifies mutations in oncogenes and areasofchromosomallossinvolving CDKN2A,PTEN,and SMARCB1[J].PLoS One,2014,9(7):e101283.
13 Iida M,Anna CH,Gaskin ND,et al.The putative tumor suppressor Tsc-22 is downregulated early in chemically induced hepatocarcinogenesis and may be a suppressor of Gadd45b[J].Toxicol Sci, 2007,99(1):43-50.
14 Seeger-Nukpezah T,Little JL,Serzhanova V,et al.Cilia and cilia-associated proteins in cancer[J].Drug Discov Today Dis Mech, 2013,10(3-4):e135-e142.
15 MacDonald BT,Tamai K,He X.Wnt/beta-catenin signaling:components,mechanisms,and diseases[J].Dev Cell,2009,17(1):9-26.
16 Moyes LH,McEwan H,Radulescu S,et al.Activation of Wnt signalling promotes development of dysplasia in Barrett's oesophagus [J].J Pathol,2012,228(1):99-112.
17 He M,Li Y,Zhang L,et al.Curcumin suppresses cell proliferation through inhibition of the Wnt/β-catenin signaling pathway inmedulloblastoma[J].Oncol Rep,2014,32(1):173-180.
18 Gregory T,Tzu-Huey L,Lynn L,et al.LZTS2 Is a Novel β-Catenin Interacting Protein and Regulates the Nuclear Export of β-Catenin[J].Mol Cell Biol,2006,26(23):8857-8867.
19 Bradford JW,Baldwin AS.IKK/Nuclear Factor-kappaB and oncogenesis:roles in tumor-initiating cells and in the tumor microenvironment[J].Adv Cancer Res,2014,121:125-145.
20 Block MS,Charbonneau B,Vierkant RA,et al.Variation in NF-κB signaling pathways and survival in invasive epithelial ovarian cancer [J].Cancer Epidemiol Biomarkers Prev,2014,23(7):1421-1427.
21 Liu H,Yang J,Yuan Y,et al.Regulation of Mcl-1 by constitutive activation of NF-kappaB contributesto cell viability in human esophageal squamous cellcarcinoma cells[J].BMC Cancer,2014,17 (14):98.
22 Prasad S,Ravindran J,Aggarwal BB.NF-kappaB and cancer:how intimate is this relationship[J].Mol Cell Biochem,2010,336(1-2):25-37.
23 Uno M,Saitoh Y,Mochida K,et al.NF-κB inducing kinase,a central signaling component of the non-canonical pathway of NF-κB, contributes to ovarian cancer progression[J].PLoS One,2014,9(2):e88347.
24 Baldoni S,Sportoletti P,Del Papa B,et al.NOTCH and NF-κB interplay in chronic lymphocytic leukemia is independent of genetic lesion[J].Int J Hematol,2013,98(2):153-157.
25 Wang X,Adhikari N,Li Q,et al.The role of[beta]-transducin repeat containing protein([beta]-TrCP)in the regulation of NF-[kap-pa]B in vascular smooth muscle cells[J].Arterioscler Thromb Vasc Biol,2004,24(1):85-90.
26 Hyun HC,Ji SS,Yu JM,et al.Differential effect of NF-κB activity on β-catenin/Tcf pathway in various cancer cells[J].FEBS Lett, 2008,582(5):616-622.
27 Yaguchi T,Sumimoto H,Kudo-Saito C,et al.The mechanisms of cancer immunoescape and development of overcoming strategies[J]. Int J Hematol,2011,93(3):294-300.
28 Sun SC,Chang JH,Jin J.Regulation of nuclear factor-kB in autoimmunity[J].Trends Immunol,2013 June,34(6):282-289.
29 Paul S,Schaefer BC.A new look at T cell receptor signaling to nuclear factor-Kb[J].Trends Immunol,2013,34(6):269-281.
30 Gattinoni L,Ji Y,Restifo NP.Wnt/β-Catenin Signaling in T-Cell Immunity and Cancer Immunotherapy[J].Clin Cancer Res,2010, 16(19):4695-4701.
31 Tomonori Y,Yasufumi G,Kenji K,et al.Immune Suppression and Resistance Mediated by Constitutive Activation of Wnt/β-Catenin Signaling in Human Melanoma Cells[J].J Immunol,2012,189(5):2110-2117.
32 Notani D,Gottimukkala KP,Jayani RS,et al.Global regulator SATB1 recruits beta-catenin and regulates T(H)2 differentiation in Wnt-dependent manner[J].PLoS Biol,2010,8:e1000296.
33 Zhou X,Yu S,Zhao DM,et al.Differentiation and persistence of memory CD8+T cells depe nd on T cell factor 1[J].Immunity, 2010,32:229-240.
34 Zhao J,Yue W,Zhu MJ,et al.AMP-activated protein kinase(AMPK) cross-talks with canoni cal Wnt signaling via phosphorylation of beta-catenin at Ser 552[J].Biochem Biophys Res Commun,2010,395:146-151.
35 Liang J,Lin C,Hu F,et al.APC polymorphisms and the risk of colorectal neoplasia:a HuGE review and meta-analysis[J].Am J Epidemiol,2013,177(11):1169-1179.
36 Meguerditchian AN,Bullard Dunn K.Biomarkers and targeted therapeutics in colorectal cancer[J].Surg Oncol Clin N Am,2013,22(4):841-855.
(2014-05-14收稿)
(2014-08-07修回)
(本文编辑:邢颖)

王枭雄 专业方向为胶质瘤分子调控。
E-mail:momo15846506773@126.com
·读者·作者·编者·
ESMO2014:结直肠癌药物治疗新靶点
在第39届欧洲临床学年会(ESMO2014)上,来自意大利的F.DiNicolantonio介绍了结直肠癌的药物治疗新靶点。美国癌症和肿瘤基因组图谱(TCGA)网络对结直肠癌(CRC)样本的分析发现有很多遗传学改变可解除对5种主要信号转导途径的管制:WNT、TGF-β、p53、PI3K和受体酪氨酸激酶(RTK)-RAS信号通路。每个肿瘤中可同时存在3种或更多途径的调节紊乱。如何利用这一点呢?举个简单易行的例子,有一些分子改变可影响RTK的几个编码基因(包括RET、ERBB3、FGFRs、TRKs、PDGFRA、ALK和KIT),TCGA数据显示其发生率很低(0.5%~2%)。需要进行更大规模的研究来确定其在普通CRC人群以及不同分子亚型中的发生率。PI3K信号通路的基因调节紊乱可能意味着额外的药物靶点,包括IGF2、PIK3CA、PTEN或PIK3R1。
但是,根据单个基因的分子状态来确定治疗策略时应当谨慎。CRC分子构成的复杂性强力提示单个遗传学改变本身可能并不代表着一个有前景的药物靶点,除非已对可同时激活多个致癌信号途径的其他同时存在的遗传学改变进行了分析。目前很缺乏关于特异性RTKs在CRC进展中作用的功能研究,需要进行这样的研究来鉴别以上提到的激酶是否真的代表有价值的治疗靶点。然而,仅以一个基因(一种途径)为靶点可能不足以诱导肿瘤缓解,联合抑制CRC的两种主要信号通路可能更有效。最近的转录组学分析已经发现,根据编码上皮细胞或间叶细胞(干细胞样)表型、炎症或高脚杯样细胞标志的基因表达,目前已识别出3~5种不同的CRC分子亚型。这些研究也提示,不同分子分型对不同治疗的反应不同。因此,未来的药物靶点将来自筛查化学或RNA干扰库,以对抗以每种亚型分子特征为蓝本的CRC临床前期模型。
——引自“医学论坛网”
LZTS2 tumor suppressor gene and advancements in tumor research
Xiaoxiong WANG,Guang YANG,Daming ZHANG,Xin CHEN,Shiguang ZHAO
Shiguang ZHAO;E-mail:guangsz@hotmail.com
Institute of Brain Science,Harbin Medical University,Department of Neurosurgery,The First Affiliated Hospital of Harbin Medical University,Harbin,150001,China
This work was supported by the National Natural Science Foundation of China(No.81272788,81302178).
Leucine zipper tumor suppressor 2(LZTS2)is a novel tumor suppressor gene that has been increasingly recognized in recent years.Currently,many studies illustrate that LZTS2 gene,the important candidate tumor suppressor gene,is already involved in the inhibition of tumorigenesis and aberrant proliferation of tumor cells,and other functions of tumor cells.Information from these studies can contribute to the formulation of new strategies for the treatment of tumors.
leucine zipper tumor suppressor 2,tumor suppressor gene,cancer
10.3969/j.issn.1000-8179.20140676
哈尔滨医科大学脑科学研究所,哈尔滨医科大学附属第一医院神经外科(哈尔滨市150001)
*本文课题受国家自然科学基金(编号:81272788,81302178)资助
赵世光 guangsz@hotmail.com
