甜荞麦壳中原花青素提取及抗氧化性研究
2014-06-27杨芙莲陈旭清
杨芙莲, 陈旭清, 李 凡
(1.陕西科技大学 生命科学与工程学院, 陕西 西安 710021; 2.西安天一生物技术有限公司, 陕西 西安 710075)
0 引言
原花青素是自然界中广泛存在的聚多酚类混合物,具有清除自由基、保护心血管、抑菌和抗癌等功效,已经被人们所关注,具有广阔的开发前景[1,2].目前市售的原花青素产品大多来自葡萄籽,来源比较单一,价格较高,因此拓宽原花青素的来源一直是研究的热点[3-5].通过前期研究发现,甜荞麦壳中原花青素含量较高,具有较好的生理活性[6,7],同时,荞麦壳作为荞麦加工后的副产物,价格便宜,只需简单的预处理便可直接用于原花青素的制备,适合作为工业化生产的原料.
超声波辅助提取技术在功能性物质提取方面应用比较广泛[8-10],超声波产生的热效应和空化效应可以促进功能性物质的溶出,从而提高提取率.目前,国内未见有关超声波辅助提取甜荞麦壳中原花青素的报告,本研究以甜荞麦壳为原料,对超声波辅助提取原花青素工艺及提取物的抗氧化性进行了研究,为工业化生产提供一定依据.
1 材料与方法
1.1 材料与仪器
甜荞麦壳,购自陕西省榆林市;儿茶素标准品、DPPH·,国药集团化学试剂有限公司;香草醛、浓盐酸、甲醇、乙醇等均为分析纯.
UV-2600型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;300 g摇摆式粉碎机HK-06B型,广州市旭朗机械设备有限公司;BS323S型电子天平,北京赛多利斯仪器有限公司;101-1AB电热鼓风干燥箱,天津市泰斯特仪器有限公司;SHZ-D循环水式真空泵,巩义市予华仪器有限责任公司.
1.2 实验方法
1.2.1 甜荞麦壳中原花青素的提取
将甜荞麦壳除杂、干燥、粉碎后,准确称取1.00 g甜荞麦壳于100 mL三角瓶中,按一定料液比加入一定体积分数的乙醇溶液,在一定温度、超声功率下提取一定时间,冷却后抽滤,将滤液置于100 mL容量瓶内,定容待测.
1.2.2 标准曲线的绘制
选用香草醛-盐酸法[11,12]测定甜荞麦壳中原花青素含量,具体方法如下:精密称取干燥至恒重的儿茶素标准品10 mg,置于10 mL容量瓶中,甲醇溶解,定容至刻度,配成1 mg/mL的储备液.再以甲醇分别稀释成浓度为0.02 mg/mL,0.05 mg/mL,0.1 mg/mL,0.2 mg/mL,0.4 mg/mL的标准溶液.将上述一系列标准溶液各取1 mL,置于25 mL比色管中,依次分别加入5 mL 30 g/L香草醛-甲醇溶液和3 mL浓盐酸,摇匀后,在30 ℃水浴30 min.以甲醇代替儿茶素标准溶液作为空白对照,于500 nm波长处测定吸光度,绘制标准曲线得出回归方程为:y=3.397 1x+0.025 5,R2=0.998 9.
1.2.3 原花青素含量测定及得率计算
精密量取1.0 mL样品液置于25 mL比色管中,按1.3.2方法处理测定,根据线性回归方程计算,即可得到1.0 mL样品中原花青素含量.
1.2.4 原花青素抗氧化能力研究
(1)原花青素的纯化
将提取液经浓缩、萃取脱脂、醇沉后旋转蒸发得到浓缩液,加适量蒸馏水稀释得到原花青素溶液.选择D101型大孔吸附树脂纯化甜荞麦壳原花青素溶液,上样液浓度为0.24 mg/mL,上样流速为2 mL/min,最大上样量为9 BV,以60%的乙醇作为洗脱液,洗脱流速为1 mL/min,洗脱剂用量为7 BV.洗脱液浓缩真空冷冻干燥,备用.
(2)DPPH·自由基清除能力测定
DPPH·自由基清除作用在国内外广泛用于清除自由基物质性质的研究与天然抗氧化剂的筛选[13-15].取纯化后的甜荞麦壳原花青素样品,以甲醇为溶剂,配制浓度分别为0.01、0.02、0.05、0.08、0.1、0.15、0.18、0.2 mg/mL的系列溶液.分别取上述样品溶液各0.1 mL,加入3.9 mL质量浓度为25μg/mL DPPH·标准液,用甲醇代替样液为空白,测定样品溶液在517 nm处的吸光度A样品.同时,测定原花青素样品溶液0.1 mL与甲醇3.9 mL混合液在517 nm处的吸光度A对照,再测定0.1 mL甲醇与3.9 mL DPPH溶液在517 nm处的吸光度A空白,DPPH·清除率的计算方法见如下公式.

同时,配置浓度分别为0.01、0.02、0.05、0.08、0.1、0.15、0.18、0.2 mg/mL的VC溶液,按照上述步骤计算其对DPPH·自由基清除率.
2 结果与讨论
2.1 超声波辅助提取单因素实验
2.1.1 提取剂种类确定
在料液比为1∶20,温度50 ℃,超声时间50 min,超声功率200 W条件下,分别选择浓度为50%的甲醇、乙醇、丙酮和蒸馏水作为提取剂,考察提取剂种类对原花青素得率的影响,结果如图1所示.
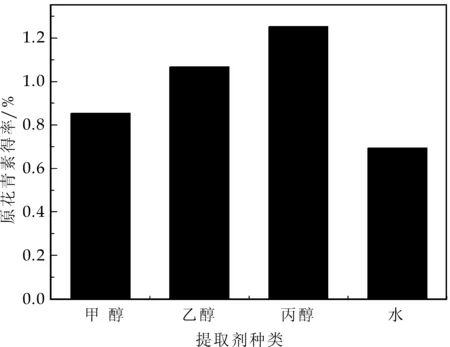
图1 提取剂种类对原花青素得率的影响
由图1可知,丙酮的提取效果最好,乙醇次之,水的提取效果最差.丙酮羰基氧不稳定,能取代与葡萄糖结合的多聚体酚类物质;由于甲醇和丙酮都具有较高毒性,在提取时会存在安全隐患,而乙醇的安全性则较高,且广泛应用与各种功能性物质的提取.综合考虑,选择乙醇作为提取剂.
2.1.2 料液比对原花青素得率的影响
在乙醇体积分数50%,温度50 ℃,超声时间50 min,超声功率200 W条件下,考察料液比1∶10、1∶15、1∶20、1∶25、1∶30、1∶35对原花青素得率的影响,结果如图2所示.
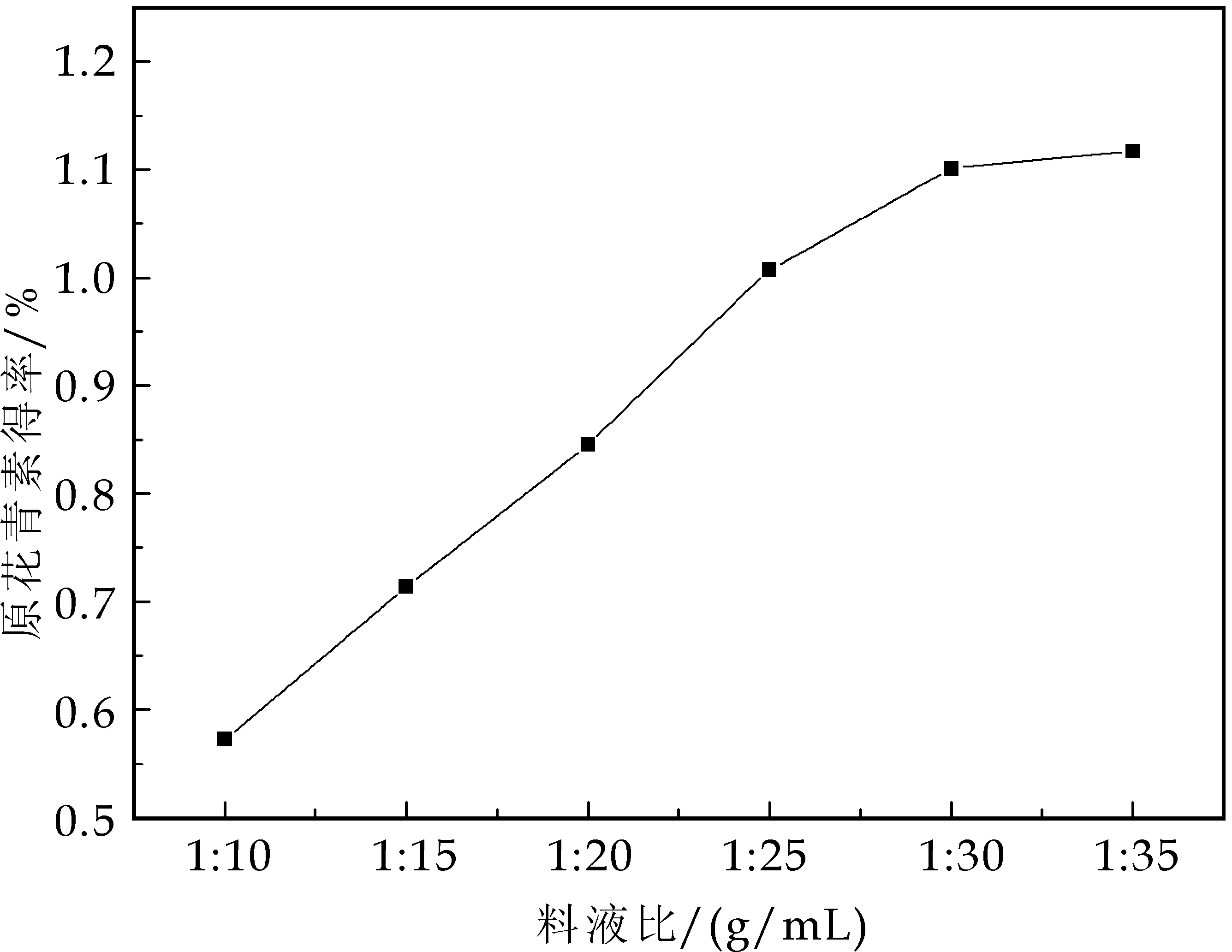
图2 料液比对原花青素得率的影响
由图2可知,随着料液比的增大,原花青素的得率也随之增大,但当料液比达到1∶30后,原花青素得率增加很小.这是由于当料液比小于1∶30时,由于料液比的提高增加了样品与溶剂体系间原花青素的浓度差,从而提高原花青素得率较明显,但这种提高并不是无限的,当料液比达到1∶30后,原花青素的溶出达到平衡,继续增大料液比对原花青素得率影响不大,同时会增大后续脱溶处理的难度.综合考虑得率和经济效益,选择1∶30料液比最佳.
2.1.3 乙醇浓度对原花青素得率的影响
在料液比1∶30,温度50 ℃,超声时间50 min,超声功率200 W条件下,考察乙醇浓度30%、40%、50%、60%、70%、80%对原花青素得率的影响,结果如图3所示.
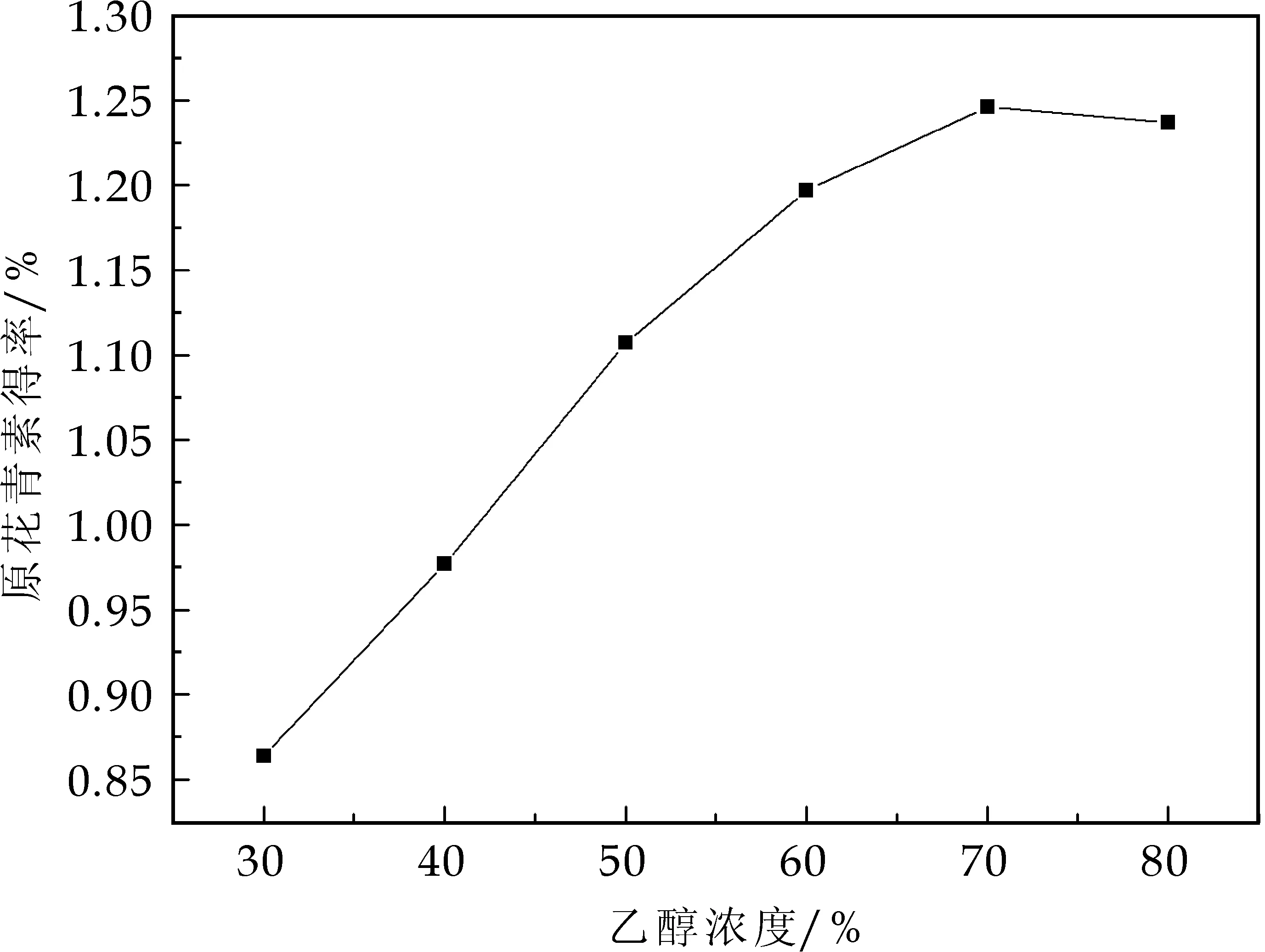
图3 乙醇浓度对原花青素得率的影响
由图3可知,随着乙醇体积分数的提高,原花青素得率呈先增大后减小的趋势,70%的乙醇提取效果最好.这是由于溶剂极性过低时,不利于原花青素的溶出,极性过高时多糖等杂质溶出较多,阻碍了原花青素的溶出.综合考虑,选择70%体积分数乙醇最佳.
2.1.4 超声时间对原花青素得率的影响
在料液比1∶30,温度50 ℃,乙醇体积分数70%,超声功率200 W条件下,考察超声时间30 min、40 min、50 min、60 min、70 min、80 min对原花青素得率的影响,结果如图4所示.

图4 超声时间对原花青素得率的影响
由图4可知,随着超声时间的增加,原花青素得率不断增加,当60 min时得率达到最高,然后随着时间增加得率反而降低.这可能是由于超声波较强的机械效应和热效应,长时间作用会破坏甜荞麦壳中原花青素,因此超声时间选择60 min最佳.
2.1.5 超声温度对原花青素得率的影响
在料液比1∶30,乙醇体积分数70%,超声时间60 min,超声功率200 W条件下,考察超声温度30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃对原花青素得率的影响,结果如图5所示.
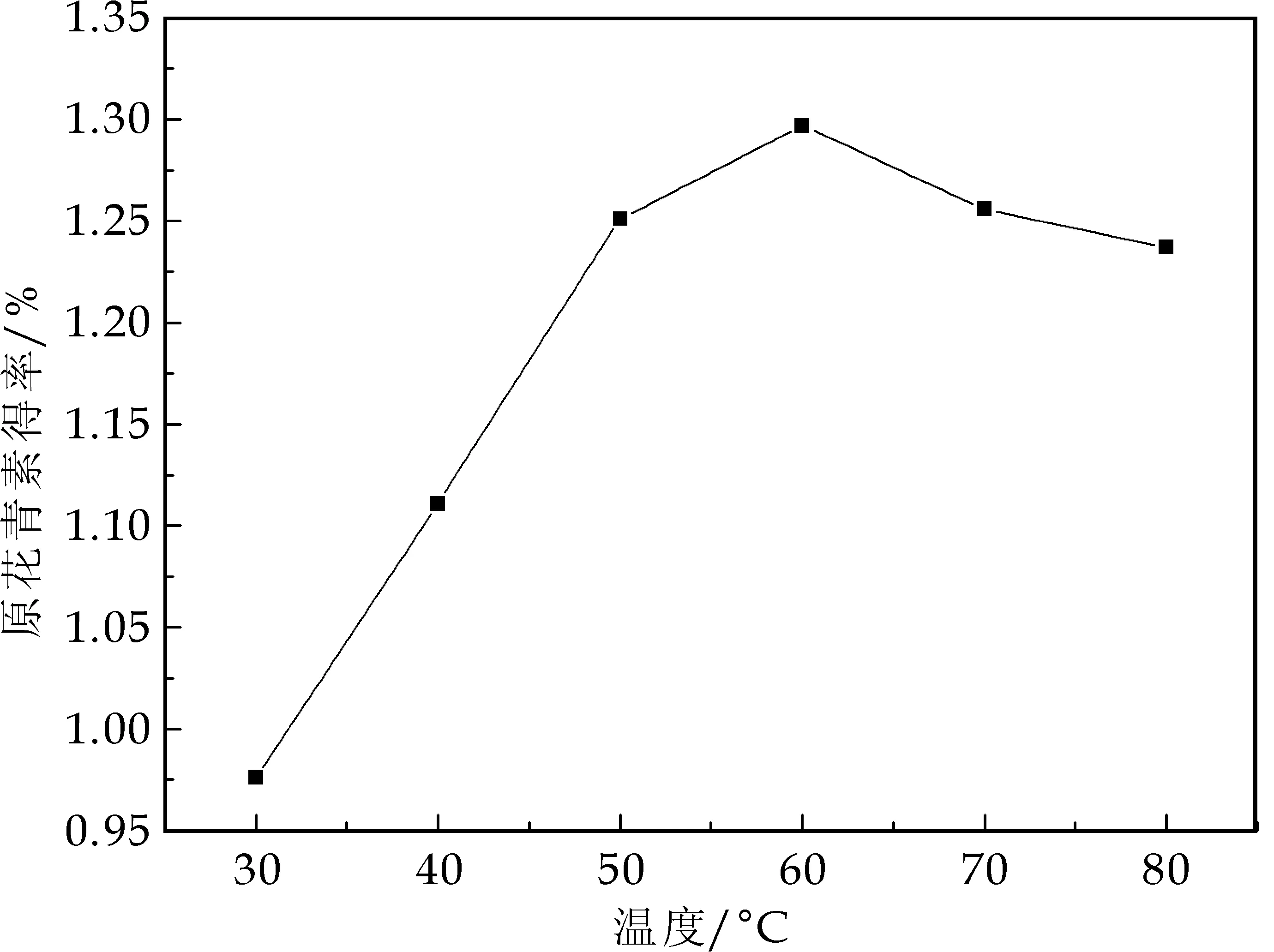
图5 超声温度对原花青素得率的影响
由图5可知,随着超声温度的升高,原花青素得率呈现先增大后减小的趋势,60 ℃时原花青素得率最大.这可能是由于温度的升高,分子运动加快,同时提取液的粘稠度降低,原花青素更容易溶出,然而原花青素在60 ℃以上时不稳定,会发生分解.因此,超声温度选择60 ℃最佳.
2.1.6 超声功率对原花青素得率的影响
在料液比1∶30,乙醇体积分数70%,超声时间60 min,超声温度60 ℃条件下,考察超声功率125 W、150 W、175 W、200 W、225 W、250 W对原花青素得率的影响,结果如图6所示.

图6 超声功率对原花青素得率的影响
由图6可知,随着超声功率的升高,原花青素得率呈现先增大后减小的趋势,200 W时原花青素得率最大.这可能是因为开始时超声功率越大,对荞麦壳细胞壁破坏程度越大,从而增加了原花青素的溶出,然而功率过大,杂质的溶出量增加,与原花青素竞争溶剂,原花青素得率反而下降.因此,超声功率选择200 W最佳.
2.2 超声波辅助提取正交试验
在单因素实验的基础上,将料液比固定为1∶30,超声功率固定为200 W,选择乙醇浓度(A)、超声时间(B)、超声温度(C)3个因素,以原花青素得率为指标,采用L9(34)正交试验设计对提取工艺进行研究,确定最佳工艺条件.因素水平如表1所示,正交试验结果与极差分析如表2所示.

表1 因素水平

表2 正交试验结果与极差分析
由表2可以看出,影响原花青素得率的各因素依次是:C>A>B,通过比较各水平的K值,得出最佳因素水平组合为C2A2B3,即:乙醇浓度为70%,超声时间70 min,超声温度为60 ℃.综合单因素和正交实验结果,最终得出超声波辅助提取甜荞麦壳中原花青素的最佳工艺条件为:选择70%乙醇作为提取溶剂,料液比为1∶30,在温度为60 ℃,功率200 W的条件下超声提取70 min.
2.3 验证实验
在料液比1∶30,乙醇体积分数70%,超声时间70 min,超声温度60 ℃,超声功率200 W的条件下进行验证实验,结果如表3所示.

表3 验证实验结果
由表3可以看出,超声波辅助提取原花青素在最佳工艺条件下原花青素得率为1.311%,三组平行实验的重复性较好,说明此工艺条件可行,结果可靠.
2.4 抗氧化能力研究
甜荞麦壳原花青素和VC对DPPH·自由基清除效果如图7所示.

图7 甜荞麦壳原花青素对DPPH·自由基清除效果
由图7可以看出,原花青素浓度在0.01~0.1 mg/mL范围内,随着浓度的增大,对DPPH·自由基清除率明显增大,最高达到92%,进一步增大浓度,清除率增幅不明显.目前,半数清除浓度(EC50)被普遍采用作为评价抗氧化清除自由基能力强弱的指标.通过线性回归分析,计算得到甜荞麦壳原花青素和VC的EC50分别为0.061、0.092 mg/mL,说明纯化后的原花青素抗氧化能力强于VC.
3 结论
本实验首先对超声波辅助提取甜荞麦壳中的原花青素进行研究,得到最佳提取工艺条件为:超声温度60 ℃,乙醇体积分数70%,超声时间70 min,料液比1∶30.在此工艺条件基础下,原花青素得率为1.311%,对其抗氧化性研究发现,甜荞麦壳中的原花青素对DPPH·自由基清除效果显著,最高清除率可达92%,EC50为0.061 mg/mL,抗氧化能力强于VC.
[1] 孙传范.原花青素的研究进展[J].食品与机械,2010,26(4):146-168.
[2] 张 华,曾 桥.原花青素功能及应用进展[J].安徽农业科学,2011,39(9):5 349-5 350.
[3] 张小军,夏春镗,吴建铭,等.原花青素的资源研究[J].中药材,2009,32(7):1 154-1 160.
[4] 樊金玲,罗 磊,武 涛,等.沙棘原花青素与葡萄籽原花青素抗氧化活性的比较[J].食品与机械,2007,23(2):26-30.
[5] 宋应华,陶 冶,罗小武.红松树皮中原花青素提取工艺研究[J].天然产物研究与开发,2010,22(2):339-342.
[6] Christel Quettier Deleu,Bernard Gressier,Jacques Vasseur,et al.Phenolic compounds and antioxidant activities of buckwheat(Fagopyrum esculentum Moench)hulls and flour[J].Journal of Ethnopharmacology,2000,72(2):35-42.
[7] 查阳春,杨义听,胡晓菡,等.相应面法优化荞麦壳中原花青素的提取工艺[J].食品科学,2009,30(16):189-192.
[8] 徐怀德,闫宁环,陈 伟,等.黑莓原花青素超声波辅助提取优化及抗氧化性研究[J].农业工程学报,2008,24(2):264-268.
[9] 战伟伟,司振军,王超萍,等.蓝莓叶原花青素提取工艺研究[J].粮食与油脂,2010(6):39-42.
[10] 刘 新,韩 琴,徐 洁.荔枝核中原花青素超声波提取工艺研究[J].安徽农业科学,2011,39(6):3 282-3 285.
[11] 赵 平,刘俊英,张月萍.香草醛法测定原花青素物质的量浓度[J].中国食品添加剂,2011(3):219-224.
[12] 薛昆鹏,颜流水,赖文强,等.超声微波酶解协同提取油茶壳中原花青素[J].化学研究与应用,2012,24(8):1 295-1 299.
[13] 吴平格,杨怀霞,陈志红,等.DPPH·法评价葡萄籽梯度渗漉各组分的抗氧化性能[J].食品科技,2005(10):40-42.
[14] 陈 婵,黄 琼,彭 宏,等.紫色甘薯原花青素稳定性及抗氧化性的研究[J].安徽农业科学,2012,40(35):17 308-17 310.
[15] 于立梅,赵谋明,李 莹.基于响应面法的马尾松树皮原花青素提取及抗氧化性研究[J].食品与机械,2007,23(1):64-68.
