超声辅助酶解谷朊粉制备ACE抑制肽工艺优化
2014-06-27刘树兴
刘树兴, 石 凯
(陕西科技大学 生命科学与工程学院, 陕西 西安 710021)
0 引言
谷朊粉(Vital wheat gluten)又称活性小麦面筋蛋白,物美价廉、氨基酸组成齐全的纯天然植物性蛋白源,是从小麦面粉中经水洗、分离、干燥提取
出来的天然蛋白质.在世界蛋白质资源严重缺乏的当今,深入开发谷朊粉蛋白产品的研究,不仅可提高谷朊粉资源的利用率和企业的经济效益,而且对拓展蛋白质资源具有重要的现实意义[1].
血管紧张素转换酶( angiotensin converting enzyme,ACE ) 在人体血压调节过程中起重要作用.ACE 抑制肽通过抑制血管紧张素I 向血管紧张素II转换以及阻止ACE 降解缓激肽而起降血压的作用[2].小麦蛋白经过碱性蛋白酶作用后, 可以得到具有ACE 抑制活性的酶解物.
本文主要介绍超声辅助酶解制备ACE抑制肽,对制备条件进行优化,确定最优工艺.同时也为小麦蛋白的综合利用提供了理论依据,为小麦副产物提供更宽广的利用空间.
1 材料与方法
1.1 材料与仪器
谷朊粉:陕西大河粉业有限公司;碱性蛋白酶酶活200 000 u/g以上;双缩脲试剂、氢氧化钠、三氯乙酸等分析纯:天津市天力化学试剂有限公司.UV-2600/2600A紫外可见分光光度计:龙尼柯(上海)仪器有限公司;KQ-250TDV型高频数控超声波清洗器BS245分析天平:赛多利斯科学仪器(北京)有限公司; SC-3610低速离心机:安徽中科中佳科学仪器有限公司;HH-s6型电热恒温水浴锅:北京科伟水兴仪器有限公司;KDN-04C型数显消化炉、KDN-04C型凯氏定氮仪:上海洪纪仪器设备有限公司.
1.2 实验方法
1.2.1 谷朊粉理化特性测定
粗蛋白含量的测定:微量凯氏定氮法[3];灰分含量的测定:灼烧法[4];粗脂肪含量测定:酸水解法[5];碳水化合物测定:DNS比色法[6].
对原料基本组成进行分析,具体见表1.

表1 小麦蛋白的基本成分
1.2.2 小麦蛋白的酶解工艺
称取1 g左右小麦谷朊粉,加100 mL蒸馏水,搅拌后静置30 min,加入一定量的酶,放入超声波清洗器中,设置时间、温度、功率,分别酶解,离心30 min(3 500 r/min,30 min),取酶解上清液,冷藏待测.
1.2.3 水解度的测定
根据氨基酸的两性作用,加入甲醛以固定氨基的碱性,使羧基显示出酸性.用NaOH标准溶液滴定,以酸度计定终点.-COOH被完全中和时,pH值约为8.5~9.5.本法准确快速,可用于各类样品游离氨基酸含量的测定.
取水解蛋白液20.00 mL于250 mL烧杯中,加入60 mL去二氧化碳蒸馏水并磁力搅拌,待搅拌稳定后,用精密pH计指示pH值并加0.1 mol/LNaOH调整pH=8.2,记下消耗氢氧化钠标准溶液的体积,然后加入10 mL甲醛溶液,混匀,记录将其pH值再用0.05 mol/LNaOH滴定至9.2时所耗氢氧化钠的体积;同时取80 mL去二氧化碳水作空白实验[7,8];则水解蛋白液中蛋白质的氨基氮为:
式中:C-0.05 mol/LNaOH标准溶液的浓度,mol/L;V-酶解液消耗NaOH标准溶液体积,mL ;V0-空白组消耗0.05 mol/LNaOH标准溶液体积,mL;0.014-氮的毫克当量;N-样品底物中总氮含量,g.
1.2.4 ACE抑制率的测定
硼酸盐缓冲液的配制:分别称取0.618 3 g硼酸、1.753 2 g NaCl溶于适量超纯水中,定容至100 mL,配制成0.1 mol/L的硼酸溶液(含0.3 mol/L的NaCl);再分别称取0.953 4 g四硼酸钠、1.753 2 g NaCl溶于适量超纯水中,定容至100 mL,配制成0.025 mol/L的硼砂溶液(含0.1 mol/L的硼酸根,0.3 mol/L的NaCl);将配制好的硼砂溶液逐渐加到硼酸溶液中,磁力搅拌,调节pH值至8.3即可.
0.1 UN/mL ACE溶液的配制:将ACE溶于上述硼酸盐缓冲溶液中,配成浓度为0.1 UN/mL.
5 mmol/L HHL溶液的配制:将HHL溶于上述硼酸盐缓冲溶液中,配成5 mmol/L.
ACE抑制活性测定采用紫外吸光度体外检测法[9,10],称取冻干的酶解物样品,加入上述磷酸盐缓冲液中,配制成浓度为2.5 mg/mL的溶液,取50μL样品溶液加入50μL 0.1 UN/mL的ACE溶液,混匀后,于37 ℃水浴预热10 min,加入100μL 5 mmol/L的HHL溶液,置于漩涡混合仪上震荡摇匀,37 ℃水浴反应30 min后,加入100μL 1 mol/L的HCL溶液震荡以终止反应,冷却至室温后,加入2 mL乙酸乙酯混合均匀后取0.9 mL酯层,放入烘干箱烘干后,溶于2 mL水中,分别于228 nm处测吸光度.定量马尿酸的生成量,同时做空白和对照实验.
取三支试管,按表2加入样品处理液(酶解液)和试剂等.
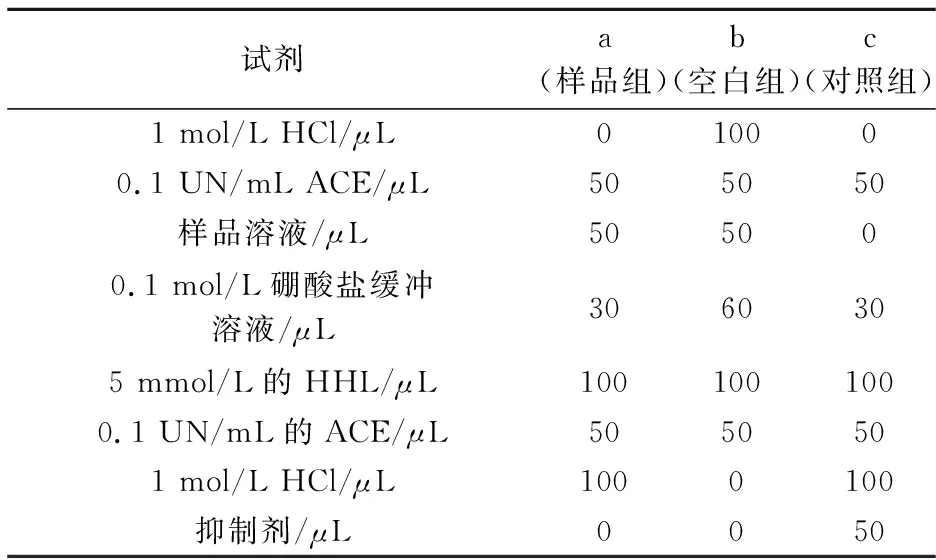
表 2 试剂加样
则抑制率的计算公式为:
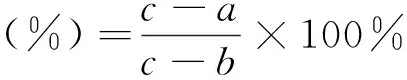
式中:a—样品228 nm处吸光度;b—空白228 nm处吸光度;c—对照228 nm处吸光度.
1.2.5 不同超声功率对谷朊粉水解度和抑制率的影响
分别设定超声功率为100 W、150 W、200 W、250 W,酶浓度为30 mg/g,温度为50 ℃,时间为1 h,超声条件下用碱性蛋白酶酶解,观察超声功率对水解度和抑制率,并确定适宜的酶解功率.
1.2.6 不同超声时间对谷朊粉水解度和抑制率的影响
分别设定酶解时间为30 min、60 min、90 min、120 min,酶浓度30 mg/g,温度为50 ℃,超声功率为250 W,进行超声酶解,考察酶解时间对水解度和抑制率的影响,并确定适宜的酶解时间.
1.2.7 不同超声温度对谷朊粉水解度和抑制率的影响
分别设定超声酶解温度为30 ℃、40 ℃、50 ℃、60 ℃,时间为1 h,超声功率为250 W,酶浓度为30 mg/g,考察酶解温度对水解度和抑制率的影响,并确定适宜的酶解温度.
1.2.8 超声辅助不同酶浓度对谷朊粉水解度和抑制率的影响
分别设定酶的浓度为10 mg/g、20 mg/g、30 mg/g、40 mg/g,温度为50 ℃,超声功率为250 W,时间为60 min,超声酶解,考察酶浓度对水解度和抑制率的影响,并确定适宜的酶浓度.
2 结果与讨论
2.1 不同超声功率对水解度和抑制率的影响
由图1可以看出,小麦面筋蛋白多肽的水解度和抑制率随着功率的增加而上升,在功率为200 W后水解度和抑制率增速出现明显增加,说明单位时间内功率 200 W之后超声产生的空化事件较多,从而使酶解效果较好[11],因此实验选择超声波功率为 250 W进行后续实验.

图1 不同超声功率对水解度和抑制率的影响
2.2 不同超声时间对水解度和抑制率的影响
由图2可以看出,水解度在0~60 min快速上升,之后变化趋于平缓,水解度在此时已经达到饱和,而抑制率随着酶解时间的延长,抑制率先增加再降低,在 90 min时达到最大值,随后抑制率逐渐降低,可能是水解物的ACE活性既受体系的肽浓度影响[12],也可能与水解产物中肽的组成相关.为获得较高抑制率的酶解产物,考虑到ACE 抑制率活性较好,且生产效率较高的因素,选择酶解时间为60 min.
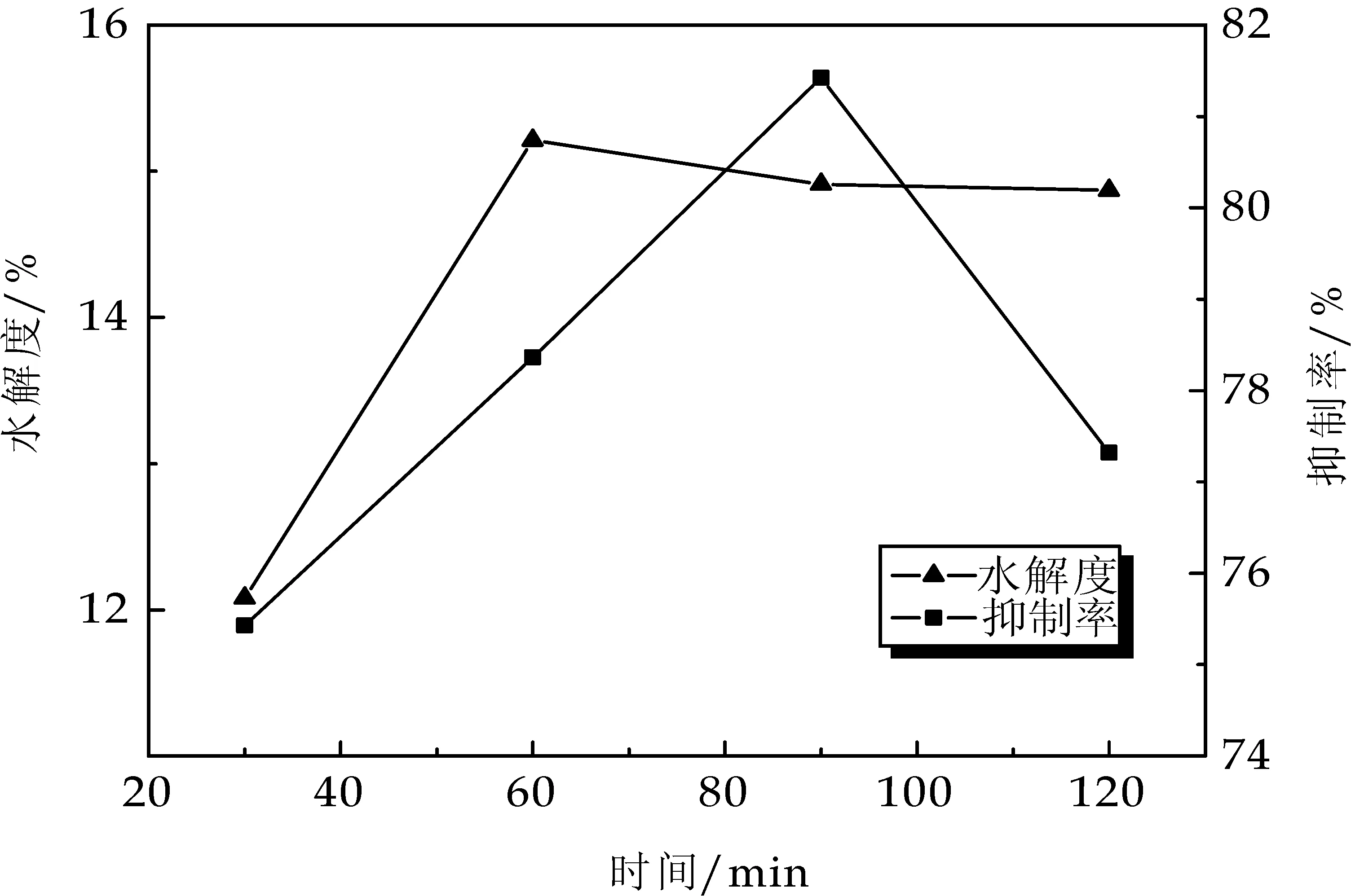
图2 不同超声时间对水解度和抑制率的影响
2.3 不同温度对谷朊粉水解度和抑制率的影响
由图3可以看出,温度的变化对水解度和ACE抑制率均有较大的影响[13],随着温度的变化,水解度和ACE抑制率的变化趋势基本一致,随着温度的增加,两者呈现先上升再降低的趋势.当温度达到 50 ℃时,水解度和ACE抑制率均达到最大值,而再升高温度两者均出现明显下降,说明ACE抑制肽的结构或成分会随着温度的升高发生变化从而使ACE抑制作用下降,因此实验选择的超声波水浴温度为50 ℃.

图3 不同温度对谷朊粉水解度 和抑制率的影响
2.4 不同酶浓度对谷朊粉水解度和抑制率的影响
由图4可以看出,酶浓度的增加对于水解度和ACE抑制率的影响较为明显,随着酶浓度的增加水解度也不断增加,当酶浓度到30 mg/g时增加趋势变缓,说明酶量的增加提高了酶对不溶性蛋白的作用能力[14],但是当加酶浓度增加到一定程度时,即当全部底物均与蛋白酶结合的时候,水解度就不再提高了.ACE 抑制率随着加酶量的增加呈现先增加后降低的趋势,在 30 mg/g时达到最大值,随后降低,说明ACE抑制率并不会随着加酶浓度增加而不断升高,当加酶量增加到一定程度时,可能是由于ACE抑制肽的结构或成分随着酶量的增高发生改变反而会使ACE抑制率下降[15].因此选择加酶浓度为30 mg/g.
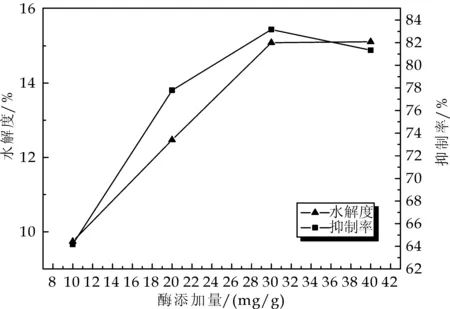
图4 不同酶浓度对谷朊粉水解度 和抑制率的影响
2.5 碱性蛋白酶正交试验结果与讨论
根据前面对于碱性蛋白酶四种单因素的研究,现选用超声功率为250 W,时间为1 h,温度为50 ℃,酶浓度为30 mg/g设计正交试验,本试验采用L9(43)正交试验设计.分别用A、B、C、D来表示超声功率、酶量、温度、时间.因素、水平的选取如表3 所示,实验方案和实验结果如表4所示.
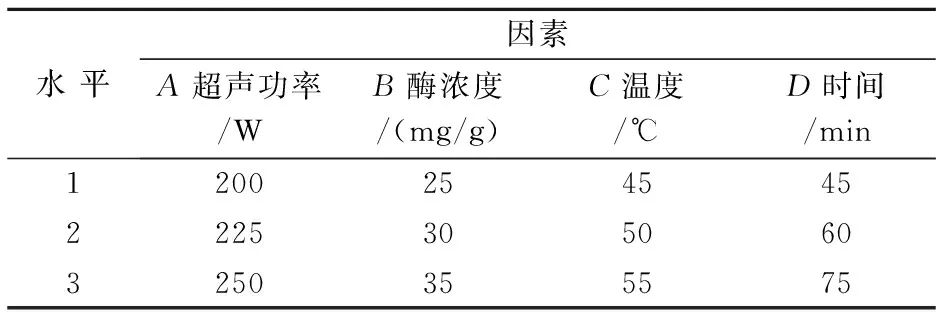
表3 正交因素水平表

表4 水解度正交试验结果表
根据极差R的大小,进行因素主次排队.R越大,表示因素水平的变化对试验指标的影响越大,因此在本试验中就越重要;反之R越小,表示因素水平的变化对试验指标的影响越小,这个因素水平就越不重要.
由以上结果可以得知A>B>C>D,即超声功率大小对水解程度的影响最大,其次是酶浓度,温度和酶解时间的影响较小.最优组合为A3B2C2D2.即超声功率为100%、时间为1 h、温度为50 ℃、酶浓度为30 mg/g,此时水解度最大.
2.6 验证试验
在超声功率为250 W、时间为60 min、温度为50 ℃、酶浓度为30 mg/g,测得其水解度,与正交实验最优组进行对比,结果见表5所示.

表5 验证试验结果
即超声波辅助酶解的最佳工艺条件为:声功率为100%、时间为60 min、温度为50 ℃、酶浓度为30 mg/g,在此工艺条件下小麦蛋白的水解度为14.64%,抑制率为80.37%.
3 结论
(1)由于ACE是一类专一性相对较宽的酶,因此水解度和ACE抑制率没有一定的相关性.不能简单的以水解度的高低判断多肽的ACE抑制率.超声辅助酶解在得出的最大水解度条件下,其抑制活性高达80%以上.
(2)原料经超声波预处理后酶解得到的水解度和抑制率都得到大大的提高,同时能明显缩短反应时间,加快反应效率,为超声化学在酶解制备生物活性肽提供简单快捷的方法.
(3)谷朊粉酶解制备ACE抑制肽最佳工艺参数为:在超声功率为250 W下,酶浓度30 mg/g,酶解温度为50 ℃,水解时间60 min.
[1] 鲁晓翔,唐津忠.玉米麸质综合利用研究进展[J].食品科技,1999,25(6):52-53.
[2] 吴琼英,马海乐,骆 琳,等.高效液相色谱法测定血管紧张素转化酶抑制剂的活性[J].色谱,2005,23(1):79-81.
[3] GB 5009.5-2010,食品中蛋白质的测定[S].
[4] GB 5009.4-2010,食品中灰分的测定[S].
[5] GB-T 5009.6-2003,食品中脂肪的测定[S].
[6] GB-T 5009.9-2008,食品中还原糖的测定[S].
[7] 李天娇,徐 晌,孙丽萍.油菜蜂花粉蛋白水解度测定方法比较[J].食品科学,2010,31(16):184-187.
[8] 周慧江,朱振宝,易建华.核桃蛋白水解物水解度测定方法比较[J].粮食与油脂,2012,26(2):28-30.
[9] 何海伦,陈秀兰,孙彩云,等.血管紧张素转化酶抑制肽的研究进展[J].中国生物工程杂志,2004,29(9):7-11.
[10] Cushman D W,Cheung H S.Spectrophotometric assayand properties of the angiotensin converting enzyme of RabbitLung[J].Bichemical pharmacology,1971,20(2):1 673-1 675.
[11] 吕 鹏,庄 重,凌建亚,等.超声对酶的影响[J].生物技术通讯,2004,15(5):534-536.
[12] 何荣海,马海乐,周存山,等.超声波在酶法生产紫菜降血压肤过程中的应用[J].江苏大学学报,2007,28(1):4-8.
[13] 赵冬艳,王金水,严忠军.碱性蛋白酶水解提高谷阮粉乳化性的研究[J].粮食与饲料工业,2003,9(8):39-41.
[14] Ney K H.Hydrolysis of deliberated proteins[J].Journal of Food Science,2002,24(3):87-89.
[15] 廖丹葵,万顺刚,孙秀华,等.碱性蛋白酶制备蛋黄降压肤工艺条件优化[J].食品科技,2006,32(8):138-141.
