症状性颅内血管狭窄患者支架成形术治疗前后的对比研究
2014-06-27韩建峰袁兴运宋文峰屈秋民马爱群
韩建峰,袁兴运,霍 康,宋文峰,屈秋民,马爱群
(西安交通大学医学院第一附属医院:1.神经内科;2.心内科,陕西西安 710061)
脑卒中危害极大,很多缺血性卒中是由于颅内动脉粥样硬化性狭窄所致,同时,症状性颅内动脉狭窄患者出现脑卒中后往往症状逐渐加重,药物治疗效果不佳,预后较差[1]。症状性颅内动脉狭窄一直是临床治疗的难点,目前其治疗大致分为内科药物治疗、外科手术治疗、血管内介入治疗。WASID(Warfarin Aspirin Symptomatic Intracranial Disease study)实验结果显示,药物治疗并不能取得满意效果[2]。多中心的颅外-颅内旁路移植术的研究结果显示外科手术无效[3]。神经介入治疗尤其是颅内支架成形术是目前新兴的治疗方法,也是研究的热点和方向之一。近几年来,专用于颅内血管的支架系统(Wimgspan支架和Apollo支架系统)开始应用于治疗颅内动脉狭窄并显示了良好的前景[4-6]。目前尚缺乏两种颅内支架系统治疗中国人颅内动脉狭窄疗效的相关报道,且更少有对比两种支架成功率、效果、并发症及再狭窄率的报道[7-8]。为此我们前瞻性观察两种支架治疗中国人症状性颅内动脉狭窄的效果差异,以期为临床工作指出方向。
1 对象与方法
1.1研究对象选择自2007年7月~2012年3月西安交通大学医学院第一附属医院神经内科住院患者90例,所有入组患者均具备颅内支架成形术条件。本研究采取有干预的前瞻性对照研究,患者年龄40~75岁,平均年龄52.66岁,其中男性74人,女性16人。伴发高血压病64例,糖尿病33例,高血压病合并糖尿病26例。颈内动脉系统短暂性脑缺血发作(TIA)11例,椎-基底动脉系统TIA 8例,颈内动脉系统脑梗死45例,椎-基底动脉系统脑梗死26例,病程3~28 d,平均16.7 d。71例患者头颅MRI检查显示新鲜脑梗死灶;数字减影血管造影(DSA)检查均发现与临床症状相关的颅内动脉狭窄,狭窄程度未超过70%的未计入统计范围,与症状无关的其他血管狭窄未计入范围。平均狭窄程度79.61%。患者均经阿司匹林、速避凝(低分子肝素)、东菱迪芙(巴曲酶)、曼新妥(前列腺素E)治疗无效。所有入组患者均具备颅内支架成形术条件,依据患者与家属的态度及经济能力将患者分为3组,每组30例,分别进行不同治疗。在DSA或CTA检查后,择期在全麻下行颅内支架置入术,颅内段血管狭窄共置入支架64枚,其中Wimgspan支架33枚,Apollo支架31枚。各组完成1年随访的病例分别为:标准药物治疗组22例,Apollo支架治疗组27例,Wingspan支架治疗组26例。
1.2颅内动脉狭窄血管成形术操作方法①术前准备及评估:术前3~5 d口服抗血小板药物氯吡咯雷75 mg+阿司匹林300 mg。术前进行颈部血管超声、TCD评价及结构影像学评价(CT、MRI、核磁共振灌注、PET、CT灌注或SPECT其中一项或以上)。全脑血管造影或CTA、MRA。②使用的设备和狭窄血管测量方法:采用荷兰PHILLIPS公司生产的血管造影系统。颅内-外动脉血管狭窄的测量方法依据北美症状性颈动脉内膜剥脱术实验法(NASCET)进行测量,即:狭窄率(%)=(1―狭窄处残留管腔内径/狭窄远端正常管腔内径)×100。狭窄程度依据NASCET分级标准,即轻度狭窄(0~29%)、中度狭窄(30%~69%)、重度狭窄(70%~99%)和完全闭塞(100%)[7]。辅助测量工具有标准刻度尺及直径10 mm不锈钢球等。③操作方法及程序:插管全麻,经股动脉穿刺,使用F6血管鞘,全身肝素化,术后肝素不中和,按两种支架标准操作要求操作。高度狭窄的患者伴有侧支循环不好者,在支架释放前注意控制血压,收缩压在基础血压的水平上下降20~30 mmHg,支架术后24 h仍然维持低血压,但如果存在其他血管狭窄,注意血压不能过低,以免造成低灌注性梗塞,术后不中和肝素,3~6 h后拔鞘。④术后用药:围术期3 d抗血小板药物同术前,同时给低分子肝素0.4 mL,每天2次,皮下注射。3 d后维持术前抗血小板药物9~12 月。
1.3观察指标和观察随访时间①终点事件:与狭窄血管相关的卒中(缺血、出血)、TIA的发生;所有原因的卒中及死亡。②脑血管造影或颅内血管CTA检查责任血管术前狭窄、残余狭窄及再狭窄率。手术路径应用MORI等所制定的颅内血管成形术的血管条件分类方法,根据病变责任血管的长度和形态分成3型。A型:血管狭窄的长度小于5 mm,狭窄为同心管状或轻度不同心型,并且未完全闭塞;B型:病变血管长度为5~10 mm,或者不规则形或完全闭塞,但闭塞时间不超过3月;C型:病变血管长度超过10 mm,或者成角超过90°,或者非常迂曲以及完全闭塞时间超过3月。再狭窄率是以狭窄率再次≥50%或管腔狭窄增加20%为标准;③神经功能评分(NIHSS评分、MMSE
评分);④TCD、超声及影像学检查(CT/MRI)。
观察随访时间为入组当天及治疗24 h后(指标①③)、1月(指标①③)、3月(指标①③)、1年(指标①②③④)。
1.4统计学分析用SPSS 13.0软件统计分析。样本均数间的比较采用配对t检验或成组t检验,计数资料比较用卡方检验,相关分析应用Spearman或Pearson相关分析,以P<0.05为差异有统计学意义。
2 结 果
2.1症状性颅内动脉狭窄的危险因素的比较本研究症状性颅内动脉狭窄发生的危险因素由高到低依次排列的是高血压病史、血脂异常、吸烟、糖尿病史、颈动脉狭窄。但3组间相同危险因素差异并无统计学意义(表1)。
表13组患者危险因素
Tab.1 Results of the risk factors in standardized drug therapy group, Wimgspan stent treatment group and Apollo stent treatment group
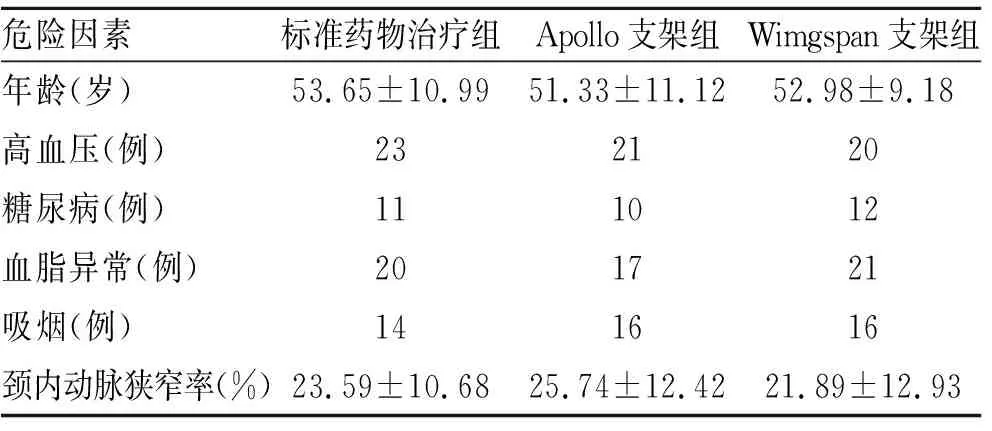
危险因素标准药物治疗组Apollo支架组Wimgspan支架组年龄(岁)53.65±10.9951.33±11.1252.98±9.18高血压(例)232120糖尿病(例)111012血脂异常(例)201721吸烟(例)141616颈内动脉狭窄率(%)23.59±10.6825.74±12.4221.89±12.93
2.2支架的到位率及其影响因素Apollo支架治疗组和Wimgspan支架治疗组的两种支架到位成功率均为96.7%,两种支架系统之间围手术期并发症并无差异。同时,所有支架治疗患者中解剖路径为Mori分型B型的手术成功率(10/12,83.3%)远低于Mori分型A型(48/48,100%),差异有统计学意义(P<0.05)。
2.3支架治疗前后残余狭窄率的比较用血管造影(CTA/DSA)复查颅内责任动脉再狭窄率,标准药物治疗组22例,Apollo支架治疗组27例,Wimgspan支架治疗组26例完成1年的随访。本Wimgspan支架治疗后即刻残余狭窄率与Apollo支架治疗后相比,差异有统计学意义,但1年后随访造影及CTA检查病变血管狭窄率两组之间差异减小,再狭窄比率两组并无差别(表2)。
表23组治疗后血管造影(CTA/DSA)复查颅内责任动脉再狭窄率的比较(t检验)
Tab.2 Comparison of re-stenosis rate detected by angiogram (CTA/DSA) in each group

组 别n平均随访时间(月)复查狭窄率x±s(%)再狭窄比率[%(例)]标准药物治疗组2211.31±6.2487.67±7.41Apollo支架治疗组2713.02±7.5727.59±13.5623.1(6)Wimgspan支架治疗组2612.18±6.9737.84±16.62△26.9(7)
△与Apollo支架治疗组比较,P=0.015,P<0.05。
2.43组发生的主要终点事件的比较支架治疗的两组患者其1年内主要终点事件(包括卒中和卒中导致的死亡),尤其是与狭窄血管相关的卒中和死亡明显低于标准内科治疗组(表3)。
表33组患者发生终点事件的比较
Tab.3 Comparison of end events within 1 year in the three groups

组 别n所有终点事件卒中(血管性死亡)标准药物治疗组6066(2)Apollo支架治疗组3033(0)Wimgspan支架治疗组3033(1)所有支架治疗者606*6(1)
*与标准药物治疗组之间比较,P=0.003,P<0.05。
2.5支架治疗前后对神经功能及智能的影响治疗前3组间NIHSS评分及MMSE评分差异无统计学意义。1年随访结束时两组支架治疗组患者NIHSS评分及MMSE评分(表4)与标准化药物治疗组间差异有统计学意义。
表43组患者治疗前后NIHSS与MMSE评分的比较


组 别nNIHSS治疗前3月随访1年随访结束MMSE治疗前3月随访1年随访结束标准药物治疗组283.96±3.239.01±5.448.18±5.5025.34±4.8323.48±4.3217.19±6.23Apollo支架治疗组293.96±3.856.93±4.595.98±4.37*24.91±5.1424.23±6.3123.45±7.11*Wimgspan支架治疗组294.13±3.275.62±5.075.16±4.93*25.62±5.4724.77±5.9423.32±6.35*
*与标准药物治疗组比较,P均<0.05;发生死亡的患者不计在内。
3 讨 论
目前批准专用于治疗症状性颅内动脉粥样硬化性狭窄的支架系统仅有Wimgspan支架和Apollo支架系统。多数学者认为Wimgspan支架手术成功率大于95%[9-10],Apollo支架亦大于90%[7]。与大多数报道一致[11-12],本研究两种支架到位成功率均为96.7%,未显示出差别,可能与病例数相对较少及对不同血管的解剖路径及特点选择了不同的支架系统有关。本研究中入组患者是考虑了狭窄远近端血管直径是否有差异以及解剖路径,所以在Wimgspan支架治疗组中路径迂曲的Mori分型B型患者较多,差异有统计学意义;同时,所有支架治疗患者中解剖路径为Mori分型B型的手术成功率(83.3%)远低于Mori分型A型(100%)。这也与大多数学者研究报道相似[12-13]。因此,对于复杂病变,尤其是解剖路径不佳的患者要做好术前评估及术前准备,包括术中提高导引导管的支撑力,充分的肝素化等;另一方面,若反复尝试支架无法通过,可单纯性球囊扩张或放弃手术治疗改为强化内科治疗,也可能会改变患者的结局。
最近一些研究对颅内支架安全性问题提出挑战[14-15]。围手术期并发症中缺血并发症较高,主要是由于支架无法到位,反复尝试所致[13]。这在本研究也进一步得到印证,2例支架植入失败者均出现围手术期并发症,并导致其中1例患者其后的卒中再发、死亡。但两种支架系统之间围手术期并发症并无差别,分析原因可能有:样本量较小,差异未显示;两种支架设计各有特点,优缺点抵消;相对较多困难的解剖路径在两种支架系统治疗中影响了Wimgspan支架的并发症。
本研究Wimgspan支架治疗后残余狭窄率很高,与许多学者报道接近[16],与Apollo支架治疗后相比,差异有统计学意义,这可能是Wimgspan支架治疗系统本身特点所致,导致即刻残余狭窄率常常>30%。但随访造影及CTA检查病变血管狭窄率两组之间差异减小,再狭窄比率两组并无差别,考虑由于Wimgspan自膨式支架系统治疗后虽然参与狭窄较重,但是其更柔软及更好顺应性特点,对血管本身走形影响较小,同时选择较小的球囊扩张对内皮的损伤较小,这些可能使再狭窄率并没有预想高。
当前,抗血小板药物在治疗症状性颅内动脉粥样硬化性狭窄时最常用,但已有研究认为内科抗血小板治疗效果较差[2]。经药物治疗30例患者总的卒中及相关死亡为7例(7/30),与狭窄相关的卒中为6例(6/30),高于WASID研究相同亚组。分析原因可能是本研究入选患者颅内血管狭窄率大于70%,而WASID研究入选标准是大于50%。很多研究也证实,症状性颅内动脉狭窄率在70%~99%之间的人群,其卒中及死亡风险远大于50%~69%人群。本研究应用的强化药物治疗与SAMMPRIS研究[11]相同,而入组的症状性颅内动脉狭窄标准也是≥70%,但是1年的终点事件为要高于SAMMPRIS研究,可能由于本研究危险因素的控制并未像SAMMPRIS研究严格,或者人群种族不同脑血管狭窄进展不同,同时也不能排除样本造成的偏倚。随访过程中11例患者因各种原因(消化道出血、脑出血、经济原因等)中断抗血小板治疗药物,终点事件(4/11)明显高于正规服药人群(8/79)。这与NIH注册实验结果一致,即随访6月以后患者出现病变同侧卒中主要与过早停用抗血小板药物有关,提示颅内动脉粥样硬化性狭窄避免过早停用抗血小板药物。
支架治疗的两组患者其1年内终点事件,尤其是与狭窄血管相关的卒中和死亡明显低于标准内科治疗组,提示对于高危的重度症状性颅内动脉狭窄支架治疗可以减少卒中的复发和死亡,这个治疗效果的差异在治疗30 d后更加明显。随访复查支架治疗两组患者的目标血管残余狭窄率较低,而标准药物治疗组目标血管狭窄程度仍在增加。推测随着时间推移,支架治疗患者的优势会进一步扩大,但近期文献报道3年的随访研究仍显示支架治疗组终点事件高于药物治疗组[17],因此,尚需要更多的实验进一步证实。
过去大多数研究随访中,仅仅观察支架或药物治疗症状性颅内狭窄患者终点事件,如:卒中、死亡、心梗等等,过多的是关注脑血管病的复发。但是症状性颅内动脉狭窄可导致慢性脑供血障碍表现,临床上可以出现痴呆、MCI、认知功能下降[18]。本研究1年随访结束时两组支架治疗组患者NIHSS评分及MMSE评分比药物治疗组改善,有统计学差异。推测由于降低了症状性颅内动脉狭窄卒中复发从而可能降低了神经功能受损,也降低了因无症状性梗死所造成慢性认知功能下降;此外,支架治疗组明显降低了目标血管的残余狭窄,而增加了目标血管的灌注,有益于患者神经功能缺损的恢复,也减少了血管性认知功能下降的速度和程度。
总之,研究发现Wimgspan支架与Apollo支架的两种支架到位率均很高,围手术期并发症相似且都较低,随访1年后再狭窄率相似。所有支架治疗患者中解剖路径为Mori分型B型的手术成功率远低于Mori分型A型,提示解剖路径不同,手术成功率不同。对于严重症状性颅内动脉狭窄,专用颅内支架治疗可能优于单纯药物治疗。支架治疗后可能对神经功能恢复有益,同时可能会改善血管性认知功能下降。
参考文献:
[1] 丁建平,王拥军,华扬,等. 缺血性脑血管病患者颅内外动脉狭窄发生率的对比研究[J]. 中华外科杂志, 2002, 40(12):9-11.
[2] CHIMOWITZ MI, KOKKINOS J, STRONG J, et al. The warfarin aspirin symptomatic intracranial disease study[J]. Neurology, 1995, 45(16):1488-1493.
[3] OVBIAGELE B. Extracranial-intracranial bypass surgery for stroke prevention in hemodynamic cerebral ischemia: the carotid occlusion surgery study randomized trial[J]. J Am Med Assoc, 2011, 306(24):2672-2672.
[4] THE SSYLVIA STUDY INVESTIGATORS. Stenting of symptomatic atherosclerotic lesions in the vertebral or intracranial arteries (SSYLVIA): study results[J]. Stroke, 2004, 35(6):1388-1392.
[5] BOSE A, HARTMANN M, HENKES H, et al. A novel, self-expanding, nitinol stent in medically refractory intracranial atherosclerotic stenoses: the Wimgspan study[J]. Stroke, 2007, 38:1531-1537.
[6] FIORELLA D, LEVY EI, TURY AS, et al. US multicenter experience with the Wimgspan stent system for the treatment of intracranial atherosclerotic disease: periprocedural results[J]. Stroke, 2007, 38:881-887.
[7] JIANG WJ, WANG YJ, DU B, et al. Stenting of symptomatic M1 stenosis of middle cerebral artery. An initial experience of 40 of patients[J]. Stroke, 2007, 35(13):1375-1380.
[8] 李健,赵振伟,高国栋,等. Wimgspan支架治疗有症状的大脑中动脉狭窄初步经验[J]. 中国实用神经疾病杂志, 2008, 11(4):25-28.
[9] WHOLEY MH, WHOLEY MH, WALTER A, et al. A comparison of balloon-mounted and self-expanding stents in the carotid arteries: Immediate and long-term results of more than 500 patients[J]. J Endovasc Ther, 2003,10:171-181.
[10] ZAIDAT OO, KLUCZNIK R, ALEXANDER MJ, et al. The NIH registry on use of the WIMGSPAN stent for symptomatic 70-99% intracranial arterial stenosis[J]. Neurology, 2008, 70(17):1518-24.
[11] BOSE A, HARTMANN M, HENKES H, et al. A novel, self-expanding, nitinol stent in medically refractory intracranial atherosclerotic stenoses: the Wimgspan Study[J]. Stroke, 2007, 38(5):1531-1537.
[12] FIORELLA DJ, TURY AS, LEVY EI, et al. Getal. US WIMGSPAN Registry 12-Month Follow-Up Results[J]. Stroke, 2011, 42(1):1-7.
[13] JIANG WJ, YU WG, DU B, et al. Outcome of patients with >70% symptomatic intracranial stenosis after Wimgspan stenting[J]. Stroke, 2011, 42(5):1971-1973.
[14] KASNER SE, CHIMOWITZ MI, LYNN MJ, et al. Predictors of ischemic stroke in the territory of a symptomatic intracranial arterial stenosis[J]. Circulation, 2006,113(8):555-563.
[15] ABOU-CHEBL A,BASHIR Q,YADAV JS, et al. Drug-eluting stents for the treatment of intracranial atherosclerosis: initial experience and midterm angiographic follow-up[J]. Stroke, 2005,36(4):165-168.
[16] WONG KS, LI H, CHAN YL, et al. Clair Trail[J]. Lancet Neurol, 2010, 459(5):489-490.
[17] DERDEYN CP, CHIMOWITZ MI, LYNN M, et al. Aggressive medical treatment with or without stenting in high-risk patients with intracranial artery stenosis (SAMMPRIS): the final results of a randomized trial[J]. N Engl J Med, 2013, 223(10):787-793.
[18] CHIMOWITZ MI, KOKKINOS J, STRONGE J, et al. Stenting versus aggressive medical therapy for intracranial arterial stenosis[J]. N Engl J Med, 2011, 365(11):993-1003.
