Sp2对宫颈癌HeLa细胞增殖的影响及Cyclin D1的表达变化
2014-06-27郑鹏生姚安梅
袁 渊,郑鹏生,周 敏,姚安梅,王 静
(1.西安交通大学医学院,陕西西安 710061;2.陕西省肿瘤医院妇瘤科,陕西西安 710061)
宫颈癌是女性生殖系统发病率最高的恶性肿瘤,近年来发病率逐渐上升和年轻化[1]。全世界每年有50万患者发病,其中我国为10万人。目前,尽管采取了包括手术切除、化学治疗、放射治疗以及其他综合性的治疗措施,但是其治疗效果仍不尽人意。宫颈癌的发生涉及癌基因/抑癌基因的异常激活/杂合性丢失、免疫改变、表观遗传学改变等,是一个多因素、多阶段的网络调控过程。从分子水平阐述宫颈癌的发病机制,筛选治疗的分子指标,为宫颈癌治疗提供新的分子靶标,是目前宫颈癌研究的热点和难点之一。
转录因子Sp2(transcription factor 2, Sp2)是Sp蛋白家族中的一员。Sp家族蛋白是一类DNA结合蛋白,通过调控富含GC/TC序列的启动子的表达,参与细胞增殖、分化、凋亡等多种功能的调节[2]。研究表明Sp1可通过调控肿瘤相关基因的表达从而影响多种肿瘤的发生和发展[3-4]。而转录因子Sp2与肿瘤的关系鲜见报道。本研究旨在检测Sp2在宫颈癌组织中的表达并应用siRNA沉默Sp2基因表达,分析其对人宫颈癌Hela细胞增殖的影响,观察细胞周期调节蛋白Cyclin D1表达的变化,探讨Sp2对宫颈癌细胞增殖影响的分子机制。
1 材料与方法
1.1实验材料、试剂及仪器宫颈癌组织和正常宫颈组织样本均收集于陕西省肿瘤医院妇瘤科;宫颈癌Hela细胞由西安交通大学医学院教育部环境与基因相关疾病重点实验室提供。RPMI-1640和新生牛血清购于美国Gibco公司;MTT、RnaseA、胰蛋白酶、碘化丙啶(PI)购于美国Sigma公司;Sp2 siRNA由上海吉玛公司设计与合成;Annexin V-FITC 凋亡试剂盒购于美国BD Bioscience公司;Sp2一抗、Cyclin D1一抗、β-actin一抗及二抗均购于美国Santa Cruz公司;ECL化学发光底物试剂盒购于美国Pierce公司;RIPA裂解液购于碧云天公司;Lipofectamine2000和Trizol Reagent购自于美国Invitrogen公司;逆转录试剂盒TaKaRa ExTaqHS和SYBR Premix ExTaqTM kit购于中国TaKaRa公司。高通量多功能微板测试系统(德国BMG Labtechnologies公司);FASCalibar流式细胞仪(美国FALS CALIBAR BD公司);GBOX-HR全自动凝胶成像分析系统(英国SYNGENE公司);iQ5 Multicolor Real-Time PCR仪(美国Bio-Rad公司)。
1.2宫颈癌HeLa细胞的培养宫颈癌HeLa细胞培养于含100 mL/L新生牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI-1640培养基中,置于37 ℃、50 mL/L CO2孵箱中培养。胰酶消化、传代。
1.3siRNA转染依照LipofectamineTM2000转染试剂说明书操作,将HeLa细胞用无抗生素含血清的RPMI-1640培养液重悬,调整细胞密度接种于96或6孔板中,置37 ℃孵箱中培养过夜。将Sp2 siRNA(sense-5′GCUUAAGCAAAGGAAAUCUUU-3′,antisense-5′AGAUUUCCUUUGCUUAAGCUU-3′)和negative siRNA(NC-siRNA,sense-5′UUCUCCGA-ACGUGUCACGUTT-3′,antisense-5′ACGUGACA-CGUUCGGAGAATT-3′)瞬时转染HeLa细胞,在无血清、无抗生素的培养液培养4~6 h后,换新鲜的含100 mL/L血清的RPMI-1640全培养基,继续培养1、2、3 d后备用。
1.4MTT比色法检测细胞增殖将对数生长期HeLa细胞以1×105个/mL接种于96孔培养板,每孔200 μL,次日瞬时转染。实验分组:对照、NC-siRNA(50 nmol/L)、siRNA(25、50、75 nmol/L)组。每组设5个复孔,继续培养1、2、3 d后,每孔加入5 mg/mL MTT溶液20 μL,37 ℃、50 mL/L CO2孵箱中继续培养4 h,弃去孔内培养液,每孔加入150 μL DMSO,震荡5 min,在POLARstar+OPTIMA微板测试仪上检测光吸收值,检测波长为490 nm。
1.5流式细胞仪检测细胞周期收集转染2 d后的各组细胞,用预冷PBS洗涤2次。加入250 μL PBS重悬细胞,再逐滴加入750 μL无水乙醇并同时不断摇动离心管,在4 ℃过夜固定;PBS洗涤1次;加入100 μg/mL的无DNase的RNaseA 0.3 mL,重悬细胞;再加入100 μg/mL PI染液0.3 mL,混合均匀,室温下避光孵育20 min;流式细胞仪检测,激发波长为488 nm,PI的红色荧光通过630 nm的滤光片收集,用BD FACSort Cellquect软件获取数据,用Modfit LT软件分析DNA含量变化。
1.6Annexin-PI染色检测细胞凋亡转染2 d后收集细胞,制备成单细胞悬液,PBS洗涤2次。用结合缓冲液重新悬浮细胞使其细胞密度为1×105/mL。取100 μL的细胞悬液入5 mL流式管中,再加入Annexin V/FITC和20 μg/mL PI各5 μL,避光混匀,孵育20 min。加入400 μL PBS,用流式细胞仪检测,光源为488 nm氩离子激光器,FITC受激发后发绿色荧光,PI发红色荧光,结果用随机软件分析。
1.7Real-timePCR检测Sp2和CyclinD1表达临床组织标本和转染2 d后的各组细胞用Trizol法提取总RNA。取总RNA 2.0 μg进行逆转录,oligo(dT)18 1 μL(0.5 μg),5×Buffer 4 μL,10 mmol/L dNTP 2 μL,Rnase 0.5 μL,补去离子水至20 μL,MMuLV 2 μL。42 ℃ 15 min;95 ℃ 2 min;终止反应。依据人HeLa细胞Sp2和Cyclin D1 cDNA序列,设计Real time PCR引物。Sp2上游引物:5′-AGCGCATATTGCAAAAGTTCAGA-3′,Sp2下游引物:5′-TCGTTACAGCCGCATGCCAATACT-3′;Cyclin D1上游引物:5′-TGATGCTGGGCACTTCATCTG-3′,Cyclin D1下游引物:5′-TCCAATCATCCCGAATGAGAGTC-3′;β-actin上游引物:5′-TGGCACCCAGCACAATGAA-3′,β-actin下游引物:5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′。Real-time PCR扩增条件:94 ℃变性2 min,按94 ℃ 30 s,54 ℃ 30 s,72 ℃ 60 s;30个循环,再于72 ℃延伸10 min。用2-△△Ct法对Real-time PCR的结果进行相对定量统计,2-△△Ct表示处理组相对于对照组的扩增倍数。其中ΔΔCt=(实验组Ct值―内参Ct值)―(对照组Ct值―内参Ct值)。
1.8免疫蛋白印迹(Westernblot)检测Sp2和CyclinD1表达收集临床组织标本和转染2 d后的各组细胞,置入RIPA细胞裂解液中提取细胞总蛋白,BCA试剂盒检测蛋白浓度。变性后取50 μg蛋白,在100 g/L十二烷基硫酸聚丙烯酰胺凝胶( SDS-PAGE)电泳后,半干转至PVDF膜上,依分子质量大小切取条带,脱脂奶粉室温震荡封闭2 h,分别加入Sp2鼠单克隆抗体(1∶1 000稀释)、Cyclin D1鼠单克隆抗体(1∶1 000稀释)、β-actin兔单克隆抗体(1∶5 000稀释),4 ℃孵育过夜,TBST洗膜3次,10 min/次。然后与HRP标记的羊抗兔/羊抗鼠二抗(1∶2 500稀释) 室温孵育2 h,TBST洗膜3次,10 min/次。加入免疫印迹化学发光剂,置于Syngene G Box凝胶成像仪的暗箱中拍照。应用英国SYNGENE公司的GeneTools软件分析,计算条带的积分吸光度(A)值进行半定量分析。

2 结 果
2.1Sp2在人宫颈癌组织中的表达的变化与正常宫颈组织相比,宫颈癌组织中Sp2 mRNA表达显著上调(P=0.004,n=35,图1A),同样Sp2蛋白表达也显著上调(P<0.007,n=35,图1B)。

图1人宫颈癌组织中Sp2表达的变化
Fig.1Expression of Sp2 in human cervical cancer tissues
A:Real time PCR结果;B:Western blot结果。1:正常宫颈组织;2:宫颈癌组织。与正常宫颈组织比较,*P<0.05,n=35。
2.2Sp2对宫颈癌HeLa细胞增殖活力的影响MTT比色法检测Sp2 siRNA(25、50、75 nmol/L)分别在转染HeLa细胞1、2、3 d后对细胞增殖活力的影响,结果显示与对照组相比较,Sp2 siRNA(50 nmol/L)在作用2、3 d后降低了宫颈癌HeLa增殖活力(P=0.006,n=3×5);Sp2 siRNA(75 nmol/L)在作用1、2、3 d后降低了HeLa增殖活力(P<0.004,n=3×5,图 2)。

图2MTT比色分析Sp2对人宫颈癌HeLa细胞增殖的影响
Fig.2 MTT assay of effects of Sp2 on the proliferation of human cervical carcinoma HeLa cells
与对照组比较,*P<0.05。
2.3流式细胞仪检测Sp2对宫颈癌HeLa细胞周期和细胞凋亡的影响Sp2 siRNA(50 nmol/L)组与对照组相比,G1/G0期细胞数量显著增加(P<0.004,n=3×5),S期细胞数量显著减少(P=0.006,n=3×5),G2/M期细胞数量也显著减少(P<0.008,n=3×5),说明Sp2 siRNA(50 nmol/L)将HeLa细胞阻滞在G1/G0期,抑制了细胞进入S期进行DNA复制和分裂(图3)。
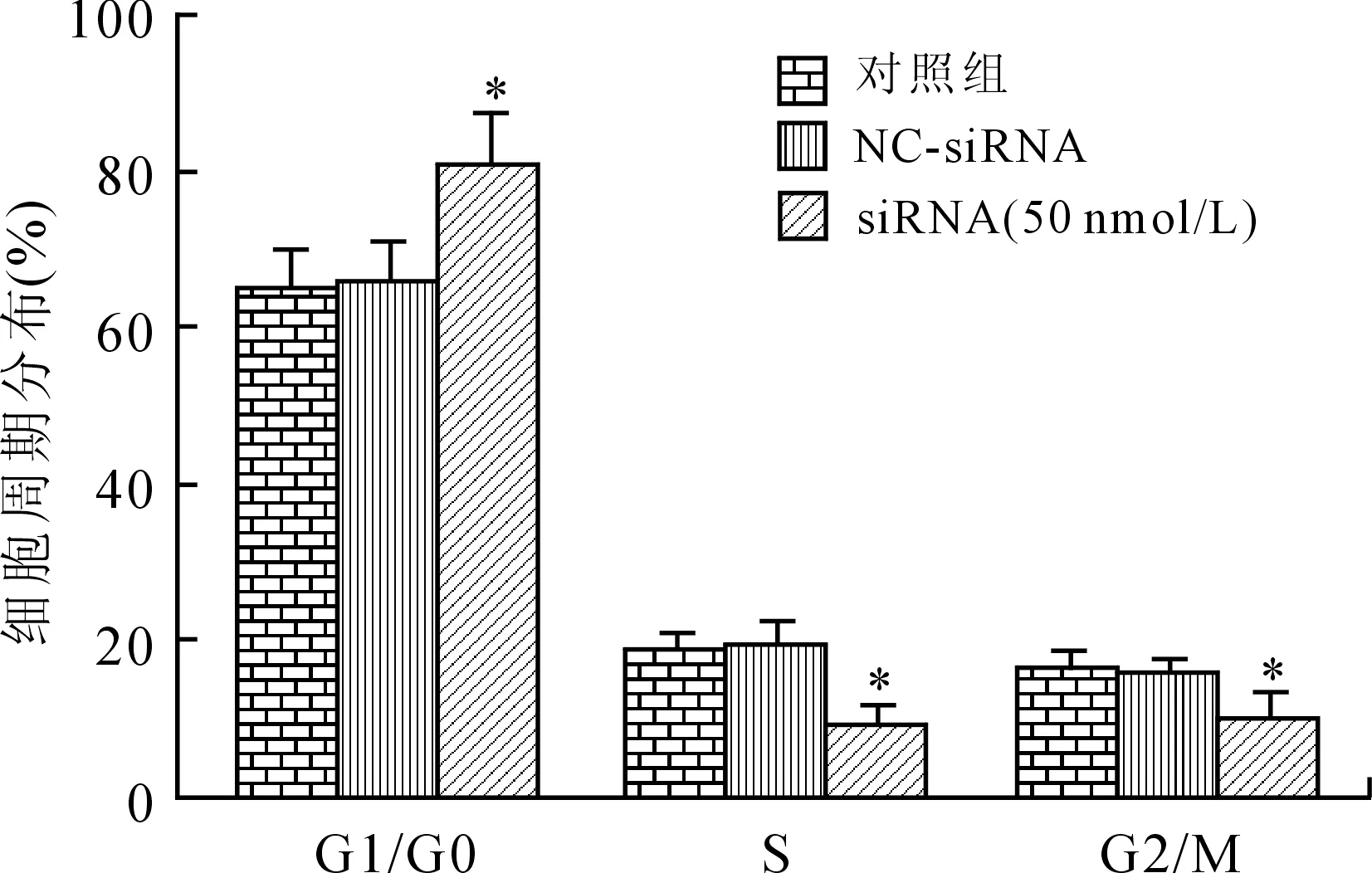
图3Sp2对人宫颈癌HeLa细胞周期的影响
Fig.3 Effects of Sp2 on cell cycle of human cervical carcinoma HeLa cells
与对照组比较,*P<0.05。
应用Annexin V+PI试剂盒染色进行流式细胞仪检测,显示Sp2 siRNA(50 nmol/L)组与对照组相比,正常细胞、早期凋亡细胞、晚期凋亡细胞和坏死细胞均没有显著差异(图4)。

图4Sp2对人宫颈癌HeLa细胞凋亡的影响
Fig.4 Effects of Sp2 on apoptosis of human cervical carcinoma HeLa cells
1:正常细胞;2:早期凋亡细胞;3:晚期凋亡细胞;4:坏死细胞。
2.4宫颈癌HeLa细胞Sp2和CyclinD1表达变化与对照组相比,Sp2 siRNA组的Sp2 mRNA表达显著下调(P=0.006,n=3×5,图5A),Cyclin D1 mRNA的表达也显著下调(P=0.007,n=3×5,图5B);同时,Sp2 siRNA组的Sp2和Cyclin D1在蛋白水平的表达也显著下调(图5C)。
3 讨 论
Sp家族成员包括Sp1-9,均具有相似的结构域,能够识别并作用于DNA序列的G-丰富元件,如GC2盒(GGGGCGGGG) 及其相近的GT/CACCC2盒(GGTGTGGGG),作为转录因子激活或抑制基因的转录[5-7]。GC/GT盒是转录调节过程中重要的顺式作用元件[8],常以多拷贝形式分布于基因的启动子和/或增强子中。Sp1对GC盒有很强的亲和力,是众多基因的基本转录因子,参与包括细胞增殖、凋亡、分化和新生物的转化等。

图5Sp2对CyclinD1表达的影响
Fig.5 Effects of Sp2 on the expression of Cyclin D1
A:Sp2 mRNA表达变化;B:Cyclin D1 mRNA表达变化;C:Sp2和Cyclin D1蛋白表达的变化。1:对照组;2:NC-siRNA;3:siRNA(50 nmol/L)。与对照组比较,*P<0.05。
Sp1是调控肿瘤细胞生长的重要转录因子,其异常表达通过复杂机制正向调节肿瘤增殖和转移。研究报道Sp1在胰腺癌、胃癌、乳腺癌和甲状腺肿瘤等多种肿瘤细胞中都有高表达[9]。研究发现在同一患者体内,肿瘤组织中的Sp1表达水平显著高于正常组织,并与肿瘤的浸润程度呈正相关,Sp1高表达的患者中位生存时间明显短于低表达或不表达Sp1的胃癌患者,而下调Sp1的过表达能抑制癌细胞形成肿瘤[10-11]。在不同肿瘤细胞中,Sp1往往显示出特异性的作用。例如,在前列腺癌细胞中,它可以增加基质金属蛋白酶Ⅰ的表达水平,促进上皮间质转化[12];在结肠癌细胞中,它能增强骨桥蛋白的表达,促进肿瘤转移[13];在乳腺癌细胞中,它可以通过与雌激素受体α的相互作用对胰岛素样生长因子产生影响,进而作用于癌细胞[14];还可以通过与垂体肿瘤转换基因共同作用,促进细胞由静息态的G1期进入DNA合成的S期[15],从而启动细胞有丝分裂。Sp2在前列腺癌中表达上调,并调控肿瘤的发生发展[16]。本研究结果显示Sp2在宫颈癌组织中表达上调,进而采用RNA干扰技术对Sp2基因进行沉默,MTT实验结果表明Sp2基因敲除后宫颈癌HeLa细胞的增殖活力显著下调,说明了Sp2能够促进宫颈癌HeLa细胞的增殖。以上均表明Sp家族在调节肿瘤细胞增殖方面起着非常重要的作用。
细胞周期中从G1到S期的转换是调节细胞周期的最主要作用节点[17-18]。M期细胞比例可说明处于增殖分裂期细胞的多少;S期细胞所占比例可表明开始新一轮DNA复制合成和分裂的细胞数量。本研究表明,在正常培养的HeLa细胞中,大部分细胞处于静息期,少数细胞处于DNA复制合成期和分裂期。在Sp2 siRNA处理HeLa细胞后,细胞的DNA复制合成与细胞分裂显著减少,这说明了Sp2可促进宫颈癌细胞的DNA复制合成与细胞分裂,进而促进宫颈癌细胞增殖。细胞周期调节子主要包括D型的Cyclins-Cdk4和Cdk6蛋白激酶复合体,它们支配通过细胞周期G1期的细胞进程[19-20]。研究报道,Sp1可通过调控Cyclin D1的表达而促进肿瘤生长[10,15]。本研究用siRNA沉默Sp2表达后,Cyclin D1的表达显著下调。因此,推测Sp2可能通过促进Cyclin D1的表达,调节宫颈癌细胞的DNA复制合成与细胞分裂,进而促进宫颈癌细胞增殖。
总之,Sp2在宫颈癌组织中表达上调,并可能通过上调Cyclin D1的表达促进宫颈癌细胞的增殖。但是,Sp2下游的通路机制非常复杂,尚需进一步研究明确其具体分子机制。
参考文献:
[1] SHI JF, CANFELL K, LEW JB, et al. The burden of cervical cancer in China: synthesis of the evidence[J]. Int J Cancer, 2012, 130(3):641-652.
[2] SAFE S, ABDELRAHIM M. Sp transcription factor family and its role in cancer[J]. Eur J Cancer, 2005, 41 (16):2438-2448.
[3] YIN P, ZHAO C, LI Z, et al. Sp1 is involved in regulation of cystathionine-lyase gene expression and biological function by PI3K/Akt pathway in human hepatocellular carcinoma cell lines[J]. Cell Signal, 2012, 24(6):1229-1240.
[4] MAOR S, MAYER D, YARDEN RI, et al. Estrogen receptor insulin-like growth factor-I receptor gene expression in breast tumor cells: involvement of transcription factor Sp1[J]. J Endocrinol, 2006, 191(3):605-612.
[5] FUJIMURA N, VACIK T, MACHON O, et al. Wnt-mediated down-regulation of Sp1 target genes by a transcriptional repressor Sp5[J]. J Biol Chem, 2007, 282 (2):1225-1237.
[6] LU X, GILBERT L, HE X, et al. Transcriptional regulation of the Osterix (Osx, Sp7) promoter by tumor necrosis factor identifies disparate effects of mitogen-activated protein kinase and NFκB pathways[J]. J Biol Chem, 2006, 281(10):6297-6306.
[7] DUNTY WC, KENNEDY MW, CHALAMALASETTY RB, et al. Transcriptional profiling of Wnt3a mutants identifies Sp transcription factors as essential effectors of the Wnt/β-catenin pathway in neuromesodermal stem cells[J].PLoS One, 2014, 9(1):e87018.
[8] JOHAR K, PRIYA A, WONG-RILEY MT. Regulation of Na(+)/K(+)-ATPase by neuron-specific transcription factor Sp4: implication in the tight coupling of energy production, neuronal activity and energy consumption in neurons[J]. Eur J Neurosci, 2014, 39(4):566-578.
[9] SAFE S, ABDELRAHIM M. Sp transcription factor family and its role in cancer[J]. Eur J Cancer, 2005, 41(16):2438-2448.
[10] YAN L, KANG M, QIN Z, et al. An intronic miRNA regulates expression of the human endothelial nitric oxide synthase gene and proliferation of endothelial cells by a mechanism related to the transcription factor SP-1[J]. PLoS One, 2013, 8(8):e70658.
[11] NAIR V, PATHI S, JUTOORU I, et al. Metformin inhibits pancreatic cancer cell and tumor growth and downregulates Sp transcription factors[J]. Carcinogenesis, 2013, 34(12):2870-2879.
[12] SROKAI C, NAGLER B, BOWDENG T. Membrane-type 1 matrix metalloproteinase is regulated by Sp1 through the differential activation of AKT, JNK, and ERK pathways in human prostate tumor cells[J]. Neoplasia, 2007, 9(5):406-417.
[13] TAKAMI Y, RUSSELLM B, GAO C, et al. Sp1 regulates osteopontin expression in SW480 human colon adenocarcinoma cells[J]. Surgery, 2007, 142(2):163-169.
[14] PATHI S, LI X, SAFE S. Tolfenamic acid inhibits colon cancer cell and tumor growth and induces degradation of specificity protein (Sp) transcription factors[J]. Mol Carcinog, 2014, 53 Suppl 1:E53-61.
[15] TONG Y, TAN Y, ZHOU C, et al. Pituitary tumor transforming gene interacts with Sp1 to modulate G1/S cell phase transition[J]. Oncogene, 2007, 26:5596-5605.
[16] KASAAI B, GAUMOND MH, MOFFATT P. Regulation of the bone-restricted IFITM-like (Bril) gene transcription by Sp and Gli family members and CpG methylation[J]. J Biol Chem, 2013, 288(19):13278-13294.
[17] KIM SJ, KIM JM, SHIM SH, et al. Shikonin induces cell cycle arrest in human gastric cancer (AGS) by early growth response 1 (Egr1)-mediated p21 gene expression[J]. J Ethnopharmacol, 2014, 151(3):1064-1071.
[18] 何文强,尹继云,孟晓,等. siRNA沉默Pim-3对T24细胞增殖和细胞周期的影响[J]. 郑州大学学报:医学版, 2012, 47(5):681-684.
[19] GODINEZ-PALMA SK, GARCIA E, SANCHEZ MDE L, et al. Complexes of D-type cyclins with CDKs during maize germination[J]. J Exp Bot, 2013, 64(18):5661-5671.
[20] ZHANG Q, SAKAMOTO K, WAGNER KU. D-type Cyclins are important downstream effectors of cytokine signaling that regulate the proliferation of normal and neoplastic mammary epithelial cells[J]. Mol Cell Endocrinol, 2014, 382(1):583-592.
