重组质粒pEGFP-N1-Twist的构建、表达及其对SKOV3细胞克隆形成能力的影响
2014-06-27尉春艳孙学军彭慧霞史玉霞王桂贤
尉春艳,张 熙,孙学军,彭慧霞,史玉霞,王桂贤
(西安交通大学医学院:1.第二附属医院妇产科,陕西西安 710004; 2.第二附属医院神经外科,陕西西安 710004;3.第一附属医院普外科,陕西西安 710061)
卵巢癌是女性生殖系统恶性肿瘤之一,早期症状不明显,很多患者诊断时已至晚期,而且极易复发转移、死亡率很高。卵巢癌的发生发展及侵袭机制不清。近年的研究发现上皮-间质转化(epithelial-mesenchymal transition, EMT)与包括卵巢癌在内的多种恶性肿瘤的转移密切相关。在EMT 过程中细胞间的连接丢失,细胞活动能力增加,并拥有间质细胞的特征,是恶性肿瘤细胞获得转移侵袭能力过程中的重要事件[1]。Twist基因编码的蛋白在EMT过程中具有重要作用。本研究通过构建含有Twist基因的重组质粒pEGFP-N1-Twist,为进一步研究上皮性卵巢癌的发生、发展及浸润转移奠定基础。
1 材料与方法
1.1主要材料与试剂Twist cDNA序列合成(609 bp)、Twist上下游引物(上海生工);EcoRⅠ、BamHⅠ、T4 DNA连接酶、DNA胶回收试剂盒(TaKaRa);pEGFP-N1载体(美国Clontech公司);LipofectamineTM2000(Invitrogen);SKOV3细胞系为西安交通大学医学院中心实验室保存;Trizol(Invitrogen);Real-time PCR试剂盒(北京全式金公司);鼠抗人Twist(Santa)、鼠抗人β-actin(Sigma)。
1.2Twist过表达载体即重组质粒pEGFP-N1-Twist的构建在NCBI数据库中查找出human Twist cDNA序列,并生物合成。按以下体系配制退火反应体系:正义寡核苷酸(100 μmol/L)5 μL,反义寡核苷酸(100 μmol/L)5 μL,NaCl 100 mmol/L,Tris-Cl pH 7.4 50 mmol/L,总反应体系50 μL。按以下程序:90 ℃ 4 min,70 ℃ 10 min,55 ℃ 10 min,40 ℃ 10 min,25 ℃ 10 min退火。按如下反应条件双酶切载体:10×缓冲液2 μL,pLentilox 3.7 1 μL,EcoRⅠ 1 μL,BamHⅠ 1 μL,ddH2O 15 μL,37 ℃酶切3 h。酶切产物于10 g/L琼脂糖凝胶上电泳分离后用胶回收试剂盒纯化。将纯化的质粒浓度调整为0.5 μg/μL,按照以下体系配制连接反应体系:T4 DNA连接酶 1 μL,线性化载体1 μL,退火寡核苷酸3 μL,10×连接酶Buffer 1 μL,加水补足10 μL,16 ℃酶连接16 h。在氨苄抗性的固态培养基平板上37 ℃培养转化后的DH5α感受态细胞,挑取其多个菌落至氨苄抗性的培养基中培养后进行测序鉴定。
1.3Twist转染SKOV3细胞株按Invitrogen公司的LipofectamineTM2000试剂盒说明书,将pEGFP-N1-Twist转染入SKOV3细胞系:SKOV3转染前24 h接种于6孔培养板,纯化的重组质粒4 μg,12 μL LipofectamineTM2000,稀释于250 μL Opti-MEM I Reduced Serum Medium中混匀,室温孵育20 min,8 h 换液,转染48 h后免疫荧光检测转染效率,采用空载体作为对照组。
1.4Real-timePCR用Trizol法提取总RNA。根据Twist序列设计合成上游及下游引物,Twist S:CGGGAGTCCGCAGTCTTA,Twist A:ACGCCCTGTTTCTTTGA,PCR反应体系(25 μL):SuperMix 12.5 μL,S引物0.5 μL,A引物0.5 μL,Passive Reference Dye 0.5 μL,cDNA 2 μL,ddH2O 9 μL;程序设置如下:95 ℃ 3 min,95 ℃ 20 s,56 ℃ 20 s 40循环,72 ℃ 20 s ,95 ℃ 15 s,60 ℃ 15 s,60~95 ℃ 20 min,95 ℃ 15 s。Realplex软件导出数据并分析。
1.5Westernblot细胞裂解后收集蛋白样品,根据碧云天BCA试剂盒说明书中步骤测定蛋白浓度。取45 μL蛋白样品以12%分离胶,5%浓缩胶电泳后转至PVDF膜上、丽春红染液中染色,洗膜后5%脱脂奶粉封闭1 h,一抗4 ℃孵育过夜,TBST洗膜3次,山羊抗小鼠二抗(1∶5 000),室温孵育1 h,TBST洗膜3次后显影及数据分析。
1.6克隆形成实验取对数生长期细胞,2.5 g/L胰蛋白酶消化并轻轻吹打,使之成为单细胞,活细胞计数,调整细胞密度至1×103细胞/mL。用蒸馏水分别制备出12 g/L和7 g/L两个质量浓度的低溶点琼脂糖液,高压灭菌后,维持40 ℃不凝。按1∶1比例使12 g/L的琼脂糖和2×DMEM/F12培养液(含有2×抗生素和200 mL/L FBS)混匀后,取3 mL混合液注入直径6 cm平皿中,冷却凝固置CO2温箱中备用。按1∶1比例让7 g/L的琼脂糖和2×DMEM培养液在无菌试管中相混以后,再向管中加入细胞悬液,充分混匀,注入铺有12 g/L琼脂糖底层平皿中,逐渐形成双琼脂层。待上层琼脂凝固后,置入37 ℃ CO2温箱中培养10~14 d。把平皿放置在倒置显微镜下,观察细胞克隆数。按公式计算克隆形成率。克隆形成率(%)=克隆数/接种数×100。
1.7统计学处理采用SPSS 12.0统计软件进行两组间独立样本t检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1构建重组质粒pEGFP-N1-Twist由上海生工生物合成Twist cDNA序列,用EcoRⅠ、BamHⅠ双酶切,经纯化、连接后,转化DH5α感受态细胞,经测序鉴定,cDNA序列总长度与预期大小一致,与NCBI数据库中的Twist cDNA序列同源,证明Twist cDNA序列已经成功构建到pEGFP-N1载体上。
2.2免疫荧光检测pEGFP-N1-Twist转染入SKOV3细胞株将带有荧光标记的重组质粒pEGFP-N1-Twist转染入SKOV3细胞系,转染48 h后,用免疫荧光检测转染效率。干预组细胞可稳定表达绿色荧光蛋白,GFP表达量高,转染效率80%以上;对照组未检测到明显的荧光蛋白表达(图1)。转染Twist 36、48、54 h后,Twist免疫荧光均呈阳性,转染结果可行(图2)。
2.3重组质粒中TwistmRNA和Twist蛋白的表达以GAPDH作为内参基因,溶解曲线可见两个主峰,说明设计的引物特异性良好。干预组的mRNA水平明显高于空白组和空载体组,差异具有统计学意义(P<0.05);空白组和空载体组差异无统计学意义(P>0.05,图3B)。干预组Twist蛋白的表达高于空白组和空质粒组;空白组和空载体组无明显差别(图3A)。

图1pEGFP-N1-Twist在SKOV3细胞株中的转染
Fig.1 Transfection of pEGFP-N1-Twist into SKOV3 cells
A:无明显GFP表达;B:GFP表达量高。
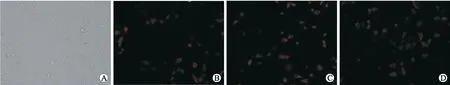
图2pEGFP-N1-Twist转染入SKOV3细胞后不同转染时间的转染效率
Fig.2 Transfection of pEGFP-N1-Twist into SKOV3 cells after different time
A:对照;B:转染36 h后;C:转染48 h后;D:转染54 h后。
2.4pEGFP-N1-Twist对SKOV3细胞克隆形成能力的影响过表达组细胞的克隆计数(61.67±4.69)明显多于对照组(32.50±2.81)及空载体组(33.17±3.18),差异具有统计学意义(P<0.05),对照组和空载体组相比,差异无统计学意义(P>0.05,图4)。
3 讨 论
Twist基因于1983年在果蝇中首次发现,此后在包括人类在内的多个物种中相继被确认,其序列在物种进化过程中高度保守。人Twist基因定位于7p21.2,含2个外显子和1个内含子,编码的mRNA全长1 669 bp。第 1个外显子长772 bp,包含整个编码区域,其内的开放可读框共609 bp,编码组成Twist蛋白的202个氨基酸;内含子长度538 bp。Twist蛋白分子质量为26 ku,等电点为9.591,此蛋白属于螺旋-环-螺旋(basic helix-loop-helix, bHLH)蛋白家族。

图3TwistmRNA和Twist蛋白的表达
Fig.3 Expressions of Twist mRNA and Twist protein
K:空白组;N:空载体组;O:干预组。
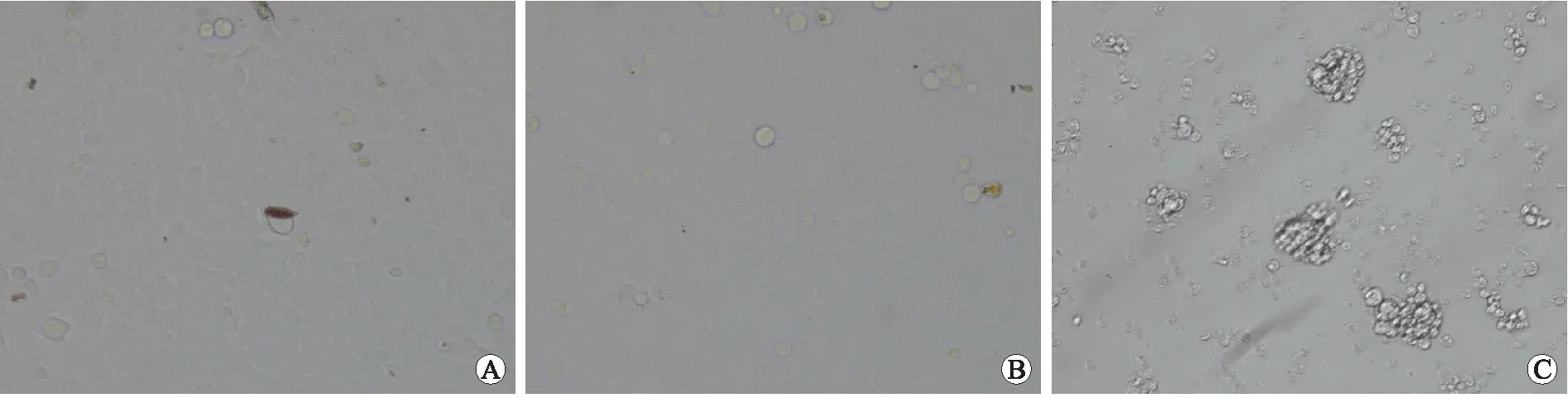
图4pEGFP-N1-Twist对SKOV3细胞克隆形成能力的影响
Fig.4 The influence of pEGFP-N1-Twist on the colony-forming ability of SKOV3 cells
A:对照组;B:空载体组;C:过表达组。
早期的研究发现,Twist在胚胎发育过程中发挥着重要作用,能诱导果蝇原肠胚腹部细胞通过上皮-间质转化(EMT)失去细胞粘着后形成中胚层[2]。EMT是指细胞间及细胞与胞外间质间的连接改变、上皮细胞失去极性并脱离周围组织,细胞骨架重塑并获得迁移能力,由此上皮细胞转化为具有间质表型细胞的过程。其分子特征是上皮细胞标记物如黏附分子表达的减少、间质细胞标记物表达的增加,转化后的细胞形态上亦具有间质细胞的特征。近年来发现EMT是上皮性恶性肿瘤发展及浸润转移中的重要过程。Twist参与EMT的全过程并发挥重要作用[3]。Twist在胃癌、肝癌、乳腺癌、生殖系统、泌尿系统多种恶性肿瘤中表达均上调。Twist基因的表达上调与E-钙黏蛋白的表达下降、肿瘤的恶性程度高、耐药性增强以及患者生存率低密切相关[4-5]。体外实验证明Twist的过表达可降低E-钙黏蛋白的表达,促进EMT,增加肿瘤细胞迁移能力从而促进肿瘤细胞的转移[6-8],在小鼠肺癌模型中Twist基因沉默后可阻止癌细胞的转移扩散[9-10]。
TWIST与恶性肿瘤的转移密切相关[11],与卵巢癌的关系近年来亦被密切关注[12-13]。上皮性卵巢癌易复发转移,缺乏有效的治疗手段,病死率很高,严重危害女性健康。本实验构建了能够表达Twist基因的真核质粒pEGFP-N1-Twist,并利用Real-time PCR和Western blot验证目的基因能够被稳定的表达,同时通过pEGFP-N1-Twist使Twist基因过表达,阐明 Twist对卵巢癌SKOV3细胞的克隆形成具有促进作用,为进一步研究上皮性卵巢癌的发生、发展及浸润转移的机制奠定了基础。
参考文献:
[1] THIERY JP, ACLOQUE H, HUANG RY, et al. Epithelial-mesenchymal transitions in development and disease[J]. Cell, 2009, 139(5):871-890.
[2] THISSE B, EL MESSAL M, PERRIN-SCHMITT F. The twist gene: isolation of a Drosophila zygotic gene necessary for the establishment of dorsoventral pattern[J]. Nucleic Acids Res, 1987, 15(8):3439-3453.
[3] ANSIEAU S, BASTID J, DOREAU A, et al. Induction of EMT by twist proteins as a collateral effect of tumor-promoting inactivation of premature senescence[J]. Cancer Cell, 2008, 14(1):79-89.
[4] QIN Q, XU Y, HE T, et al.Normal and disease-related biological functions of Twist1 and underlying molecular mechanisms[J].Cell Res, 2012, 22(1):90-106.
[5] FU J, QIN L, HE T, et al.The TWIST/Mi2/NuRD protein complex and its essential role in cancer metastasis[J]. Cell Res, 2011, 21(2):275-289.
[6] FU J, ZHANG L, HE T, et al. TWIST represses estrogen receptor-alpha expression by recruiting the NuRD protein complex in breast cancer cells[J]. Int J Biol Sci, 2012, 8(4):522-532.
[7] LEE TK, POON RT, YUEN AP, et al.Twist overexpression correlates with hepatocellular carcinoma metastasis through induction of epithelial-mesenchymal transition[J]. Clin Cancer Res, 2006, 12(18):5369-5376.
[8] CHENG GZ, ZHANG W, WANG LH.Regulation of cancer cell survival, migration, and invasion by Twist: AKT2 comes to interplay[J]. Cancer Res, 2008, 68(4):957-960.
[9] FU J, QIN L, HE T, et al. The TWIST/Mi2/NuRD protein complex and its essential role in cancer metastasis[J]. Cell Res, 2011, 21(2):275-289.
[10] YANG J, MANI SA, DONAHER JL, et al. Twist, a master regulator of morphogenesis, plays an essential role in tumor metastasis[J]. Cell, 2004, 117:927-939.
[11] SAVAGNER P, GITELMAN I, RICHARDSON A, et al. Twist, a master regulator of morphogenesis, plays an essential role in tumor metastasis[J]. Cell, 2004, 117(7):927-939.
[12] HOSONO S, KAJIYAMA H, TERAUCHI M, et al. Expression of Twist increases the risk for recurrence and for poor survival in epithelial ovarian carcinoma patients[J]. Br J Cancer, 2007, 96(2):314-320.
[13] TERAUCHI M, KAJIYAMA H, YAMASHITA M, et al. Possible involvement of TWIST in enhanced peritoneal metastasis of epithelial ovarian carcinoma[J]. Clin Exp Metastasis, 2007, 24(5):329-339.
