大鼠骨髓间充质干细胞对RH-35肝癌细胞侵袭能力的影响
2014-06-27陈昆仑慕为民王重民刘保荣
袁 博,陈昆仑,张 岚,慕为民,王重民,刘保荣,徐 心
(西安交通大学医学院:1.附属西安市中心医院,陕西西安 710004;2.第二附属医院,陕西西安 710003)
间充质干细胞(mesenchymal stem cells, MSCs)是起源于中胚层的一类具有高度自我更新能力和多向分化潜能的成体干细胞,主要存在于骨髓组织与结缔组织间质中。MSCs已被广泛用于组织修复与再生医学研究,是可用于临床细胞治疗的理想“种子细胞”[1-3]。然而,近来有研究报道MSCs参与了肿瘤的发生发展,这对MSCs治疗的生物安全性提出了挑战。但MSCs对肿瘤的恶性行为具有正向还是负向调控作用尚存在争议[4-6]。肝癌作为最常见的恶性肿瘤之一,其与MSCs间的相互作用关系尚不明确。本研究拟观察大鼠骨髓MSCs条件培养基(MSCs-conditioned medium, MSCs-CM)对大鼠肝癌细胞株RH-35侵袭转移能力的影响,并探讨其可能的机制,为进一步探索MSCs在肝细胞癌复发转移中的作用提供实验依据。
1 材料与方法
1.1材料
1.1.1实验动物与细胞 雄性清洁级SD大鼠,体质量60~80 g,由西安交通大学医学院实验动物中心提供,动物饲养与实验操作符合《实验动物管理条例》等法规的要求。大鼠肝癌细胞株RH-35由西安交通大学医学院中心实验室提供。
1.1.2主要试剂 胎牛血清(fetal bovine serum,FBS)、100 mm培养皿、6孔板(美国Gibco公司);Transwell小室(美国Costar公司);表皮生长因子(epidermal growth factor, EGF)(美国Peprotech公司);Ficoll分离液、维生素C、胰岛素、β-甘油磷酸钠、地塞米松等(美国Sigma公司);低糖型DMEM(LG-DMEM)培养基、高糖型DMEM(HG-DMEM)培养基、青链霉素(美国Hyclone公司)。
1.1.3主要设备 超净工作台(上海新苗医疗器械公司);CO2恒温培养箱(美国Revco公司);高速低温离心机(德国Eppendorf公司);倒置相差显微镜(日本Olympus公司);凝胶电泳仪器、电转仪(美国Bio-Rad公司)。
1.2方法
1.2.1大鼠MSCs的分离与培养 SD大鼠麻醉后,断颈处死,于750 mL/L乙醇中浸泡20 min。无菌条件下分离出胫骨、股骨及肱骨,剪去干垢端,PBS溶液冲洗骨髓腔3~4次。利用无菌400目不锈钢筛网过滤冲洗液,收集滤液并吹打混匀,贴管壁缓慢加入等体积的Ficoll分离液的上层,1 500 r/min离心15 min,小心吸取中间层细胞,加入5 mL PBS充分吹打混匀,离心后弃上清液,同法再洗涤1次。细胞沉淀用含100 mL/L FBS、10 ng/mL EGF及100 IU/mL青链霉素的LG-DMEM培养基混悬计数,以1×105/mL接种于100 mm培养皿中。24 h后首次换液,弃去未贴壁细胞,此后每3 d换液1次。待细胞汇合率达85%左右时,胰酶消化,按1∶2比例传代。每天在倒置显微镜下观察细胞集落、形态及排列极性。
1.2.2大鼠MSCs的分化鉴定 选取生长状态良好的第5代MSCs,以1×104个/cm2密度接种于6孔板培养,24 h后将完全培养基吸弃,两组细胞分别加入2 mL成骨分化诱导液(含100 mL/L FBS、0.2 mmol/L维生素C、10 mmol/L β-甘油磷酸钠、10 nmol/L地塞米松的LG-DMEM培养基)、成脂分化诱导液(含100 mL/L FBS、0.5 mmol/L甲基异丁基黄嘌呤、10 mg/L胰岛素、100 μmol/L吲哚美辛、10 μmol/L地塞米松的LG-DMEM培养基),每3 d更换诱导液,14 d后成骨诱导组细胞行茜素红染色,成脂诱导组行油红O染色鉴定。
1.2.3大鼠骨髓MSCs培养上清液的获取 将1×106/mL第5代MSCs接种于T25细胞培养瓶中,加入4 mL 无血清HG-DMEM,培养24 h后收集上清液,为MSCs-CM,0.22 μm滤器过滤后4 ℃保存。
1.2.4Transwell侵袭实验 胰酶消化收集RH-35细胞,以1×106个细胞接种于培养皿中,贴壁后吸除培养液,随后加入含不同浓度MSCs-CM的DMEM培养72 h。MSC-CM的浓度分别为0 mL/L、250 mL/L及500 mL/L。分别收集3组细胞,按照2×105/孔(100 mL无血清DMEM培养基)接种于Transwell上室,各组下室均加入500 μL含100 mL/L FBS的DMEM培养基。37 ℃、50 mL/L CO2孵育48 h后,取出下室,漂洗与甲醛固定完毕,行Geisma染色,镜下观察并计数(平均计数8个视野)。
1.2.5Real time PCR检测Snail与MMP-9 mRNA的表达 将80%汇合率的RH-35细胞等量接种于2个T25培养瓶中,待细胞完全贴壁后,其中1瓶加入500 mL/L MSCs-CM作为实验组,另1瓶不添加作为对照组。培养72 h后,胰酶消化收集细胞,利用Trizol提取细胞总RNA。测定纯度与浓度后,分别利用PrimeScriptTMRT reagent Kit(Takara)与SYBR®Premix ExTaqTM Ⅱ(Takara)试剂盒行RT-PCR反应。
1.2.6Western blot检测Snail与MMP-9蛋白的表达 分组方法同上。用ProteoJETTMCell Mammalian Lysis Reagent(Fermentas)提取细胞总蛋白,BCA法测定蛋白浓度。蛋白行120 g/L SDS-PAGE凝胶电泳,PVDF转膜,非特异性封闭;加入一抗Snail mAb、MMP-9 mAb,4 ℃过夜孵育,PBST洗脱后加入辣根过氧化物酶标记的二抗进行杂交。ECL发光剂显色,培清凝胶成像分析仪拍照,用Quantity One软件分析。数值以各蛋白/β-actin的灰度比值表示相对表达水平。

2 结 果
2.1大鼠骨髓MSCs的形态与分化鉴定分离细胞经多次换液、传代后逐渐呈均一的长梭形,分布均匀(图1)。MSCs经成骨分化诱导2周后,茜素红染色显示细胞内形成粗大的钙化结节,呈红色(图1);成脂诱导分化后,细胞增大,胞内出现脂滴,呈环状或团簇状,油红O染色显示脂滴呈橘红色(图1)。
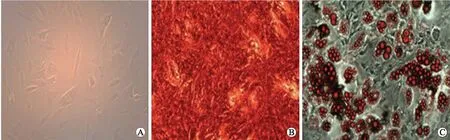
图1大鼠骨髓MSCs的形态与分化检测
Fig.1 Morphology and differentiation ability of rat bone marrow derived MSCs (×100)
A:第5代MSCs光镜下形态;B:成骨分化(茜素红染色);C:成脂分化(油红O染色)。
2.2大鼠骨髓MSCs对肝癌细胞侵袭能力的影响应用0 mL/L、250 mL/L及500 mL/L MSC-CM处理RH-35细胞后,细胞的侵袭率逐渐增加。与对照组相比较,500 mL/L MSC-CM 干预组细胞的侵袭率显著增加,其差异有统计学意义(P<0.05,图2)。选择500 mL/L MSC-CM为目标干预浓度进行下一步实验。
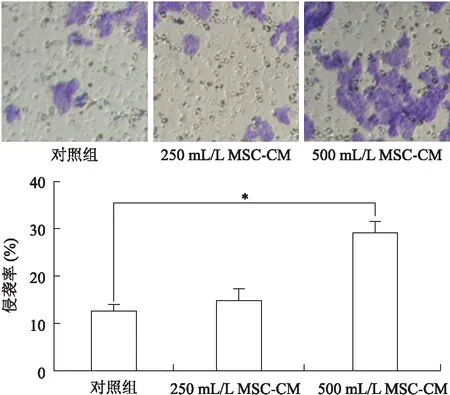
图2不同浓度MSC-CM对RH-35侵袭能力的影响
Fig.2 Effect of MSC-CM of different concentrations oninvitroinvasiveness of RH-35 cell(*P<0.05,P=0.002 0)。
2.3大鼠骨髓MSCs对肝癌细胞Snail与MMP-9mRNA表达的影响对照组中大鼠肝癌细胞表达少量的Snail与MMP-9 mRNA,而在500 mL/L MSCs-CM处理后的细胞中,Snail与MMP-9 mRNA的表达量均显著升高(P<0.05,图3)。
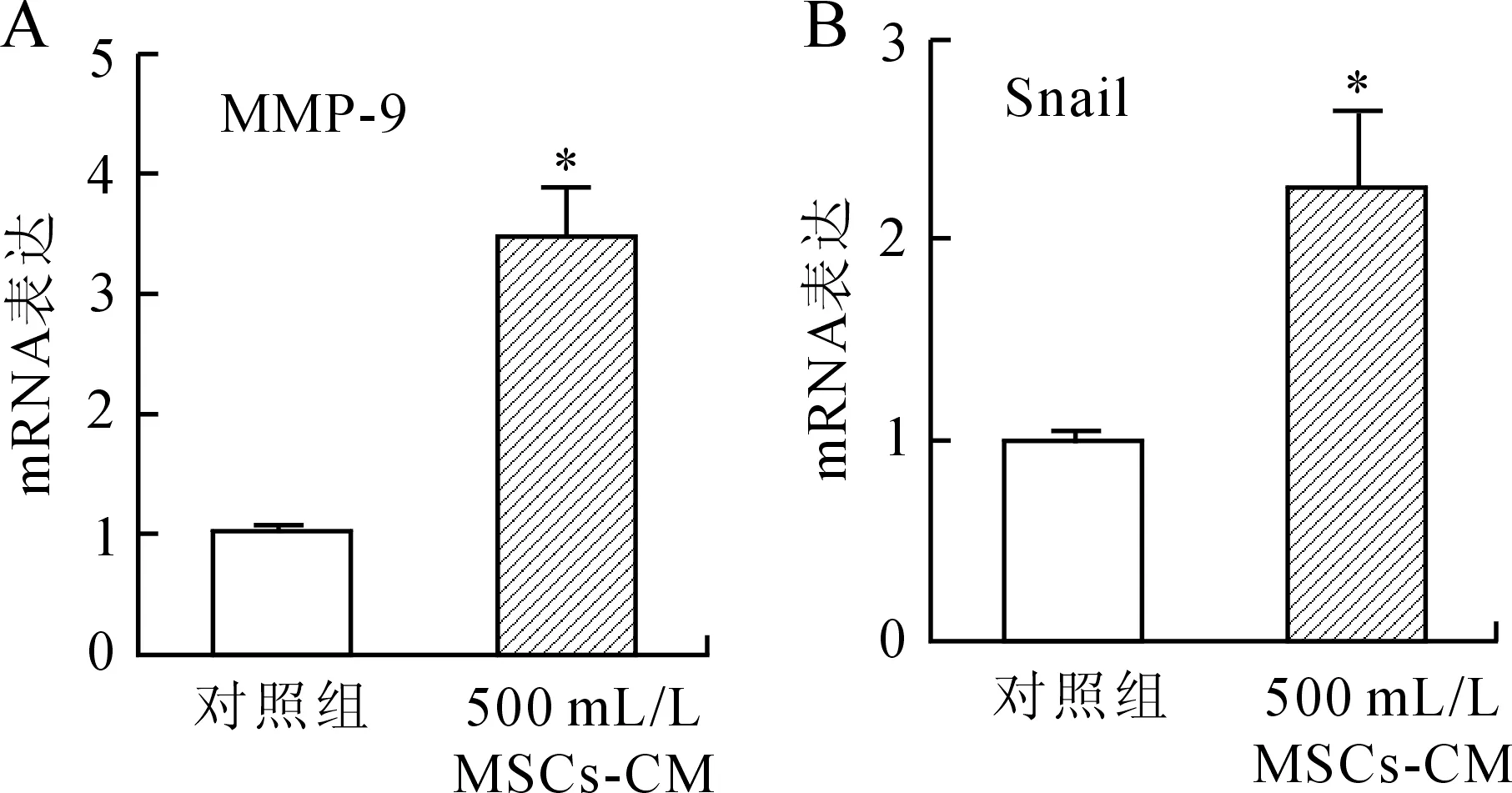
图3MSC-CM对RH-35细胞Snail(B)与MMP-9(A)mRNA表达的影响
Fig.3 Effect of MSC-CM on Snail (B) and MMP-9 (A) mRNA expressions in RH-35 cell (*P<0.05,PA=0.000 5,PB=0.002 4)。
2.4大鼠骨髓MSCs对肝癌细胞Snail与MMP-9蛋白表达的影响Western blot结果显示,500 mL/L MSC-CM干预后,RH-35细胞Snail与MMP-9的蛋白含量较对照组显著升高,其差异均有统计学意义(P<0.05,图4)。表明MSC-CM可促进大鼠肝癌细胞RH-35中Snail与MMP-9蛋白的表达。
3 讨 论
肝癌是临床上最常见的恶性实体肿瘤之一,具有较早发生侵袭转移、术后复发率高等特点,这也是造成肝癌极差预后的主要原因。近年有研究表明,骨髓干细胞除在肝损伤的再生修复中发挥着重要作用,而且参与了肝癌的发生发展[7-8]。研究骨髓干细胞在肝癌侵袭转移进程中的作用具有重要意义。MSCs是骨髓干细胞家族中的重要成员,与肝癌侵袭转移的关系尚不明确,文献报道甚少。本实验采用体外共培养的方法,结果表明,MSCs可以对肝癌细胞RH-35侵袭能力有促进作用,与肿瘤侵袭与转移密切相关的指标Snail及MMPs的表达水平也明显升高。这一结果与KARNOUB等[5]报道相似,认为MSCs能够显著提高乳腺癌细胞的侵袭能力,促进乳腺癌发生肺转移。这表明MSCs是可以影响肝癌的发展及术后复发,应值得重视并深入探讨。
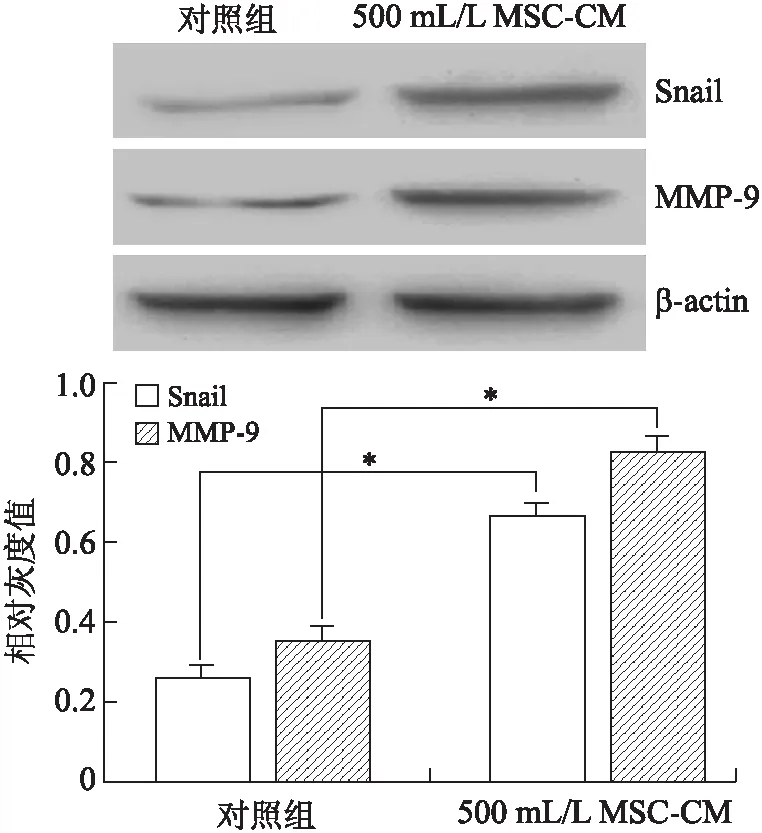
图4MSC-CM对RH-35细胞Snail与MMP-9蛋白表达的影响
Fig.4 Effect of MSC-CM on Snail and MMP-9 protein expressions in RH-35 cell(*P<0.05,PSnail=0.000 1,PMMP-9=0.000 1)。
本研究采用MSCs-CM进行共培养实验,发现MSCs-CM能显著提高肝癌细胞的侵袭能力,说明至少MSCs的旁分泌机制在对肿瘤的作用中发挥了作用。既往研究报道,MSCs-CM含有大量的细胞因子,包括VEGF、TGF等,这些因子可能通过促肿瘤血管新生、癌细胞的间质、免疫抑制等作用促进肿瘤的侵袭转等恶性行为[9-11]。
肿瘤的侵袭与转移是一个多因素共同介导及参与的复杂病理过程,细胞外基质(extracellular matrix, ECM)的降解与基底膜的破坏降解是其中的关键步骤之一,依赖于的蛋白水解酶的表达与激活。明胶酶MMP-2/9是体内降解Ⅳ型胶原蛋白与层粘连蛋白的主要酶类,Ⅳ型胶原蛋白是组成ECM的基本骨架。明胶酶通过破坏基质的降解平衡而可促进肿瘤细胞突破其组织学屏障,侵袭邻近组织和转移至远处组织[12]。相比MMP-2,MMP-9与肝癌侵袭及不良预后关系更为密切,MMP-9可作为反映肝癌转移潜能、复发及预后的生物学指标[13-14]。
Snail是新近发现的锌指样核转录因子。在肿瘤侵袭转移方面,Snail是上皮间充质转化(epithelial-mesenchymal transition, EMT)的主要调控因子,诱导上皮来源的肿瘤细胞发生间质细胞转化,从而使肿瘤细胞易于脱离原定植部位,发生转移[15]。由于本研究Transwell实验结果表明500 mL/L MSCs上清液对肝癌细胞的迁徙能力作用最为明显,因此后续实验选择检测500 mL/L MSC-CM浓度孵育下肝癌细胞侵袭相关蛋白的转录与表达。PCR与Western blot结果均表明,经过MSC-CM作用后,RH-35细胞中Snail与MMP-9的表达明显升高。MARTIN等[9]将乳腺癌细胞系与MSCs分别进行直接/间接共培养后,乳腺癌细胞发生了上皮间质转化(EMT),表达稳定的间质表型(Snail、Twist、Vimentin等);同时,癌细胞抗凋亡、血管形成、迁移及侵袭相关基因水平也显著提高。目前,研究多认为Snail是MMP-9的上游调节蛋白。在MDCK上皮细胞中,Snail可通过MAPK与PI3K信号通路来激活MMP-9的转录与表达,两者的表达与细胞的侵袭能力相关[16]。另有研究表明,Snail可以通过上调MMPs的表达来促进肝癌的侵袭转移,与肝癌的不良预后相关[17]。因此,我们推断MSCs促进肝癌细胞侵袭转移的机制可能是与Snail的活化有关,MSCs通过激活Snail介导的MMP-9的表达上调发挥促侵袭效应。
但是,也有研究认为MSCs能抑制肿瘤的侵袭转移。LI等[18]将人MSCs-CM与人肝癌细胞系MHCC97-H共培养,发现MSCs可以显著抑制癌细胞的侵袭转移能力。我们认为,出现这种截然不同的报道结果,可能与实验所采用的肝癌细胞特性和选择的MSCs不同有关。既往研究表明,MSCs对不同类型乳腺癌细胞的增殖与侵袭也发挥不同的调控作用[5,9]。这也证实了MSCs对肿瘤恶性行为的作用具有复杂性与双向调节性。
总之,MSCs对肿瘤发生、发展的影响涉及到诸多方面的因素,对其影响的机制还不十分明确。进一步明确MSCs与肿瘤侵袭转移潜能的关系及其机制将是我们迫切需要解决的问题。
参考文献:
[1] FALANGA V, IWAMOTO S, CHARTIER M, et al. Autologous bone marrow-derived cultured mesenchymal stem cells delivered in a fibrin spray accelerate healing in murine and human cutaneous wounds[J]. Tissue Eng, 2007, 13(6):1299-1312.
[2] GRIFFIN M, IQBAL SA, BAYAT A. Exploring the application of mesenchymal stem cells in bone repair and regeneration[J]. J Bone Joint Surg Br, 2011, 93(4):427-434.
[3] KODE JA, MUKHERJEE S, JOGLEKAR MV, et al. Mesenchymal stem cells: immunobiology and role in immunomodulation and tissue regeneration[J]. Cytotherapy, 2009, 11(4):377-391.
[4] ZHU Y, SUN Z, HAN Q, et al. Human mesenchymal stem cells inhibit cancer cell proliferation by secreting DKK-1[J]. Leukemia, 2009, 23(5):925-933.
[5] KARNOUB AE, DASH AB, VO AP, et al. Mesenchymal stem cells within tumour stroma promote breast cancer metastasis[J]. Nature, 2007, 449(7162): 557-563.
[6] LIU J, HAN G, LIU H, et al. Suppression of cholangiocarcinoma cell growth by human umbilical cord mesenchymal stem cells: a possible role of wnt and akt signaling[J]. PloS One, 2013, 8(4):e62844.
[7] WU XZ, CHEN D. Origin of hepatocellular carcinoma: role of stem cells[J]. J Gastroenterol Hepatol, 2006,21(7):1093-1098.
[8] GONG P, WANG Y, JIN S, et al. Effect of bone marrow mesenchymal stem cells on hepatocellular carcinoma in microcirculation[J]. Tumour Biol, 2013, 34(4):2161-2168.
[9] MARTIN FT, DWYER RM, KELLY J, et al. Potential role of mesenchymal stem cells (MSCs) in the breast tumour microenvironment: stimulation of epithelial to mesenchymal transition (EMT)[J]. Breast Cancer Res Treat, 2010,124(2):317-326.
[10] KINNAIRD T, STABILE E, BURNETT MS, et al. Marrow-derived stromal cells express genes encoding a broad spectrum of arteriogenic cytokines and promoteinvitroandinvivoarteriogenesis through paracrine mechanisms[J]. Circ Res, 2004, 94(5):678-685.
[11]张伟,葛薇,李长虹,等. 骨髓间充质干细胞通过分泌TGF-β1抑制T细胞的增殖[J]. 中国免疫学杂志, 2005, 21(3):168-171.
[12] HUA H, LI M, LUO T, et al. Matrix metalloproteinases in tumorigenesis: an evolving paradigm[J].Cell Mol Life Sci, 2011, 68(23):3853-3868.
[13] CHEN R, CUI J, XU C, et al. The significance of MMP-9 over MMP-2 in HCC invasiveness and recurrence of hepatocellular carcinoma after curative resection[J].Ann Surg Oncol, 2012, 19(Suppl 3):S375-384.
[14] 彭利,王顺祥,张风瑞,等. 基质金属蛋白酶-9和血管内皮生长因子与原发性肝癌侵袭转移关系研究[J].中华肝胆外科杂志, 2003, 9(1):42-44.
[15] CANO A, PEREZ-MORENO MA, RODRIGO I, et al. The transcription factor snail controls epithelial-mesenchymal transitions by repressing E-cadherin expression[J]. Nat Cell Biol, 2000, 2(2):76-83.
[16] JORDA M, OLMEDA D, VINYALS A, et al. Upregulation of MMP-9 in MDCK epithelial cell line in response to expression of the Snail transcription factor[J]. J Cell Sci, 2005, 118(Pt 15):3371-3385.
[17] MIYOSHI A, KITAJIMA Y, KIDO S, et al. Snail accelerates cancer invasion by upregulating MMP expression and is associated with poor prognosis of hepatocellular carcinoma[J]. Br J Cancer, 2005, 92(2):252-258.
[18] LI GC, YE QH, XUE YH, et al. Human mesenchymal stem cells inhibit metastasis of a hepatocellular carcinoma model using the MHCC97-H cell line[J]. Cancer Sci, 2010, 101(12):2546-2553.
