钠、钾干预对Dahl盐敏感大鼠肾髓质TGF-β1表达及纤维化的影响
2014-06-27徐海霞白晓君牟建军任珂宇刘富强郑树慧郭统帅
徐海霞,白晓君,牟建军,任珂宇,刘富强,郑树慧,王 丹,汪 洋,郭统帅
(西安交通大学医学院第一附属医院心内科,陕西西安 710061)
盐是高血压最常见和最重要的环境因素之一,相对高盐摄入会导致血压升高,也能通过独立的非血压依赖途径直接影响心、脑、肾等靶器官[1-2]。血压的盐敏感性是原发性高血压的一种中间遗传表型,盐敏感高血压者早期即可出现肾功能损害,且损害较严重[3]。钾作为钠的“拮抗剂”,可拮抗盐介导的血压升高,同时具有保护靶器官损害的作用[4]。本研究通过观察高盐及补钾饮食对盐敏感高血压大鼠肾髓质转化生长因子(transforming growth factor, TGF)β1的表达及纤维化的影响,探讨盐与TGF-β1之间的关系。
1材料与方法
1.1实验动物健康雄性Dahl盐敏感大鼠和SS-13BN大鼠,从美国Charles River公司引进,于西安交通大学医学院实验动物中心SPF级动物室饲养繁殖。SS-13BN大鼠作为Dahl盐敏感大鼠的对照组,是Dahl盐敏感大鼠的13号染色体置换为Brown Norway大鼠13号染色体后得到的盐不敏感大鼠模型,与Dahl盐敏感大鼠基因组98%同源性。
1.2试剂及仪器Trizol试剂(Sigma公司);逆转录-聚合酶链反应(reverse transcription-PCR, RT-PCR)试剂盒(TaKaRa公司);TGF-β1抗体(Santa Cruz Biotechnology公司);兔抗鼠二抗免疫组化试剂盒(Santa Cruz Biotechnology公司)。MODEL-229大鼠无创血压测定仪(美国IITC公司);电泳装置(美国Bio-Rad公司);凝胶成像仪(美国Ultro-violet公司);正置荧光显微镜BX51(奥林巴斯公司)。
1.3方法
1.3.1动物分组及饮食干预 6周龄健康雄性Dahl盐敏感大鼠24只,分成盐敏感大鼠低盐组(salt-sensitivity rats given low salt, SLS)、盐敏感大鼠高盐组(salt-sensitivity rats high salt, SHS)和盐敏感大鼠高盐补钾组(salt-sensitivity rats given high salt plus high potassium, SHK),每组8只,分别摄入低盐(4 g/kg NaCl)、高盐(80 g/kg NaCl)及高盐补钾(80 g/kg NaCl+80 g/kg KCl)饲料。同样,6周龄健康雄性SS-13BN大鼠24只,按摄入不同饲料分为盐不敏感大鼠低盐组(SS-13BN rats given the low salt, BLS)、盐不敏感大鼠高盐组(SS-13BN rats given high salt, BHS)和盐不敏感大鼠高盐补钾组(SS-13BN rats given high salt plus high potassium, BHK),每组8只。
1.3.2血压测量 分别在饮食干预前及干预4周末,采用尾袖法测量大鼠尾动脉血压。测量前1周对大鼠进行固定仪的适应性训练,每次30 min。测量血压时,将大鼠固定后置于30 ℃恒温箱内10 min,固定探极,通过对其尾部加压阻断其血流,至不能记录尾部动脉搏动,保持3~5 s,然后打开软件,逐渐减压,取尾部出现动脉搏动时血压为该实验动物的收缩压。该系统舒张压为计算获得,不作参考。每只大鼠重复测量6次,时间间隔2 min,取均值记录为最后的血压值。
1.3.3标本制备 大鼠以100 mL/L水合氯醛0.35 mL/100 g麻醉后,取腹正中切口,暴露并摘除双肾,剥离肾纤维膜,一侧肾脏于液氮中速冻保存,另一侧肾脏用100 mL/L甲醛溶液固定制备石蜡标本。
1.3.4RT-PCR法检测肾髓质TGF-β1 mRNA表达 剪取约100 mg的大鼠肾髓质组织匀浆提取总RNA,在逆转录酶催化下合成cDNA,以适量cDNA为模板在TaqDNA聚合酶催化下扩增。TGF-β1引物:上游CTCTGCAGGCGCAGCTCTG,下游:TCAAAAGACAGCCACTCAGG,扩增片段为236 bp;β-actin引物:上游TCAGGTCATCACTATCGGCAAT,下游:AAAGAAAGGGTGTAAAACGCA,扩增片段为281 bp。扩增条件:94 ℃ 2 min;94 ℃ 40 s;退火:52 ℃ 40 s;延伸:72 ℃ 1 min;72 ℃ 5 min,循环数为35。以10 g/L琼脂糖凝胶电泳,Ultro-violet凝胶成像仪分析结果。
1.3.5免疫组化法检测肾小管区TGF-β1蛋白的表达 肾脏常规石蜡包埋,标本5 μm连续切片,贴片后于37 ℃温箱干燥24 h。免疫组化染色步骤:切片脱蜡水化,30 mL/L H2O2-甲醇封闭内源性过氧化物酶,80 ℃的0.01 mol/L枸橼酸盐缓冲液修复抗原,羊血清封闭,一抗为稀释后的TGF-β1单克隆抗体(1∶50),二抗为生物素标记的IgG,滴加辣根酶或碱性磷酸酶标记的链霉卵白素,二氨基联苯胺(3,3′-diaminobenzidine, DAB)显色,苏木精复染,脱水透明,中性树胶封片。显微镜下观察,细胞内有棕黄色颗粒者为阳性,采用Image Pro plus软件半定量分析,每切片选取肾小管区10个视野,采样取均值。
1.3.6Masson染色观察肾小管区纤维化 肾组织蜡块连续5 μm切片,贴片干燥后脱蜡水化,苏木素、丽春红酸性品红、苯胺蓝染色。显微镜下以蓝色胶原沉积为阳性信号,用Image Pro plus软件进行半定量分析。
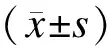
2结果
2.1各组大鼠钠钾干预前后血压的变化各组大鼠基线期血压差异无统计学意义。Dahl盐敏感大鼠和SS-13BN大鼠低盐组、高盐组、高盐补钾组干预后血压均较基线期升高,高盐组比低盐组升高更明显,高盐补钾组血压较高盐组降低。干预后高盐组Dahl盐敏感大鼠较SS-13BN盐不敏感大鼠的血压升高更明显 (P<0.01, 单因素方差分析);低盐组两种大鼠之间差异有统计学意义(P<0.05)。高盐补钾组两种大鼠的血压差异无统计学意义(P>0.05,图1)。
2.2各组大鼠肾髓质TGF-β1mRNA表达的变化SHS组TGF-β1 mRNA表达量比SLS组明显升高(P<0.01),SHK组TGF-β1 mRNA表达量较SHS组明显减少(P<0.01);而BHS组TGF-β1 mRNA表达较BLS组也有所升高(P<0.05),程度较轻,BHK组较BHS组有所减少(P<0.05)。低盐组、高盐组SS-13BN盐不敏感大鼠较Dahl盐敏感大鼠TGF-β1 mRNA表达减少(图2)。
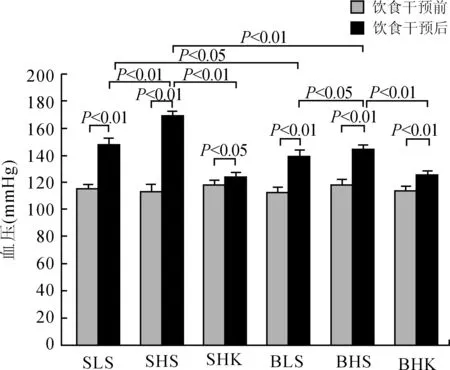
图1 各组大鼠饮食干预前后血压的变化
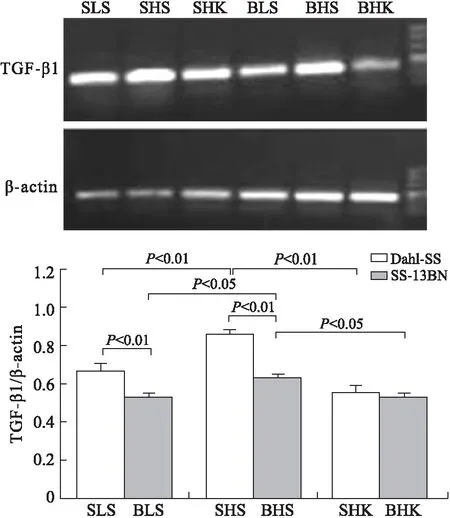
图2 各组大鼠肾髓质TGF-β1 mRNA表达的变化
2.3各组大鼠肾小管区TGF-β1蛋白表达的变化Dahl盐敏感大鼠肾小管上皮细胞表达的TGF-β1,SHS组明显多于SLS组(P<0.01),SHK组较SHS组明显减少(P<0.01)。SS-13BN大鼠3组肾小管上皮所表达的TGF-β1差别比Dahl大鼠小,其中BHK组较BHS组表达明显减少(P<0.01)。高盐组、高盐补钾组SS-13BN盐不敏感大鼠较Dahl盐敏感大鼠TGF-β1蛋白表达减少(图3)。
2.4各组大鼠肾小管区形态学的变化Dahl盐敏感大鼠肾小管区胶原沉积,SHS组明显多于SLS组(P<0.01),SHK组则较SHS组明显减少(P<0.01)。而盐不敏感大鼠3组肾小管胶原沉积差异无统计学意义。高盐组、高盐补钾组SS-13BN盐不敏感大鼠较Dahl盐敏感大鼠肾小管胶原沉积减少(图4)。
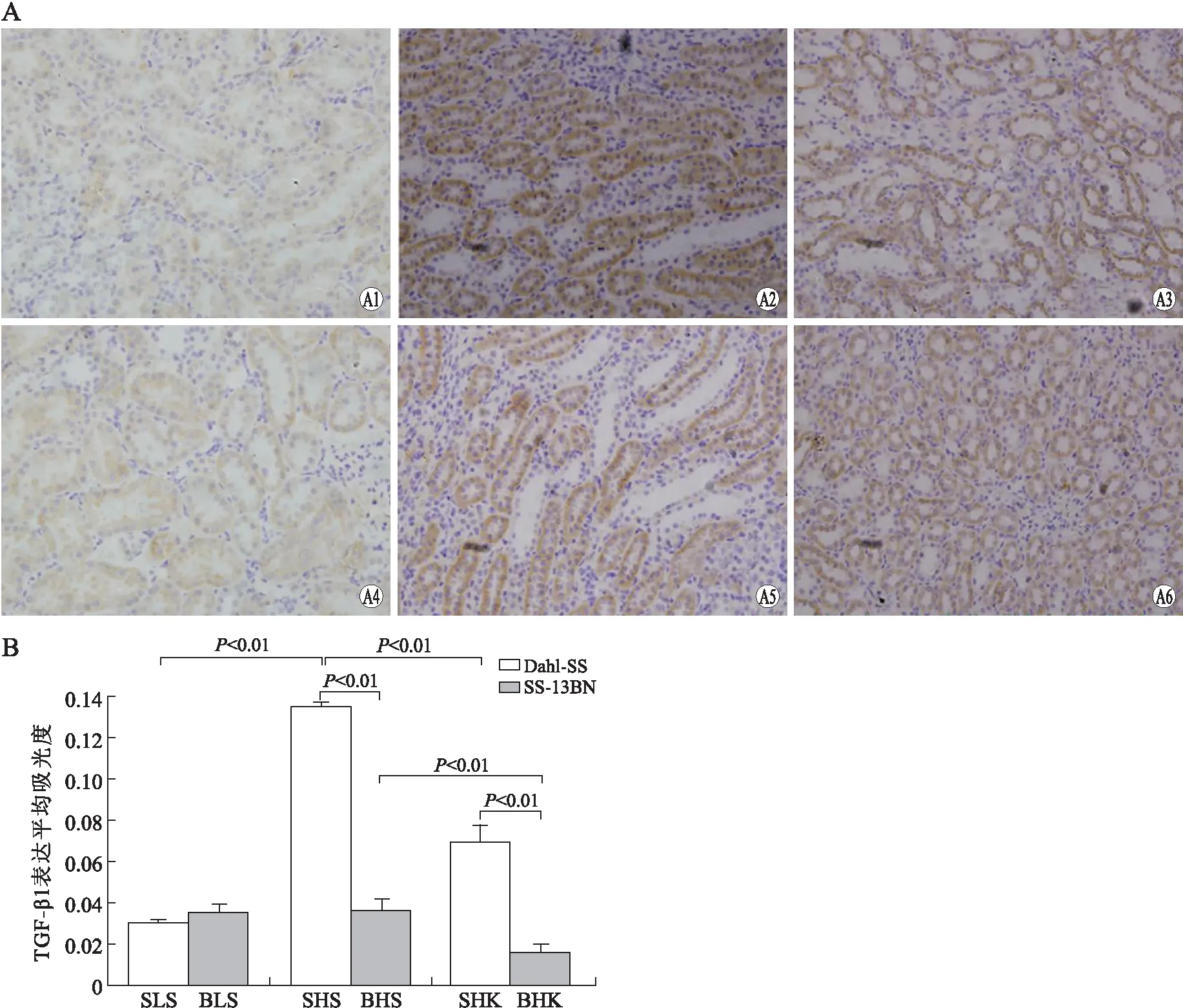
图3 各组大鼠肾小管区TGF-β1的免疫组化染色Fig.3 Immunohistochemisty of TGF-β1 in renal tu-bules of different groups of ratsA:肾髓质TGF-β1免疫组化染色(×200);A1:SLS;A2:SHS;A3:SHK;A4:BLS;A5:BHS;A6:BHK。B:肾髓质TGF-β1表达的平均吸光度比较。
3讨论
本研究结果显示,盐负荷饮食可诱导Dahl盐敏感大鼠血压升高,而SS-13BN大鼠的血压升高幅度较小,提示盐可以促进盐敏感大鼠形成高血压;此外,高盐负荷使盐敏感大鼠肾髓质TGF-β1 mRNA和蛋白表达水平明显升高,而SS-13BN大鼠肾脏髓质TGF-β1表达对盐反应迟钝,虽有升高趋势,但不如盐敏感大鼠明显,提示高盐促进盐敏感大鼠肾脏损伤,其可能是通过增加TGF-β1表达而实现的。
盐敏感高血压的形成与肾脏功能障碍有着错综复杂的关系,TGF-β1在其中可能起着重要作用[5]。TGF-β是一种具有激素活性的多肽,会影响靶细胞的增殖、修复、分化、凋亡、免疫功能等。晚近研究结果显示,TGF-β1依赖的通路在高血压肾脏损害过程中起着非常重要的作用,与系膜基质增生和间质纤维化密切相关[6]。高血压肾损害中,TGF-β1过表达,增加细胞外基质合成,减少各种酶的表达,促进各种酶激活物的抑制物表达,使细胞外基质降解减少,同时刺激系膜细胞增殖,并增加基质蛋白受体表达,促进细胞与基质之间相互作用;也作用于各种炎症细胞,促进多种细胞因子表达[7-8]。此外,TGF-β1能与肾素-血管紧张素系统相互调节,研究表明,TGF-β1能刺激肾小球旁细胞释放肾素,激活肾素-血管紧张素系统,促使血压升高[9]。体内外研究均表明,对大鼠的肾小球系膜细胞,血管紧张素II是呈剂量依赖、时间依赖地增加TGF-βl mRNA的表达和促进TGF-βl的活化,并伴有细胞外基质成分及其mRNA表达的增加,最终导致肾纤维化的发生[10]。也有研究证明,氧化应激与TGF-β1的产生关系密切,TGF-β1促进肾组织中过氧化物的释放,可能是通过还原型辅酶Ⅱ介导的,而过氧化物也可以通过激活丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路促进TGF-β1的表达[8]。DAHLY等[11]研究发现,给Dahl盐敏感大鼠TGF-β1抗体治疗后,肾脏TGF-β1 mRNA及蛋白的表达,可降低高盐饮食后升高的血压及减轻心脏、肾脏等靶器官功能障碍,这恰证实TGF-β产物可增加Dahl盐敏感大鼠肾小球和缺氧性肾小管细胞的损伤。
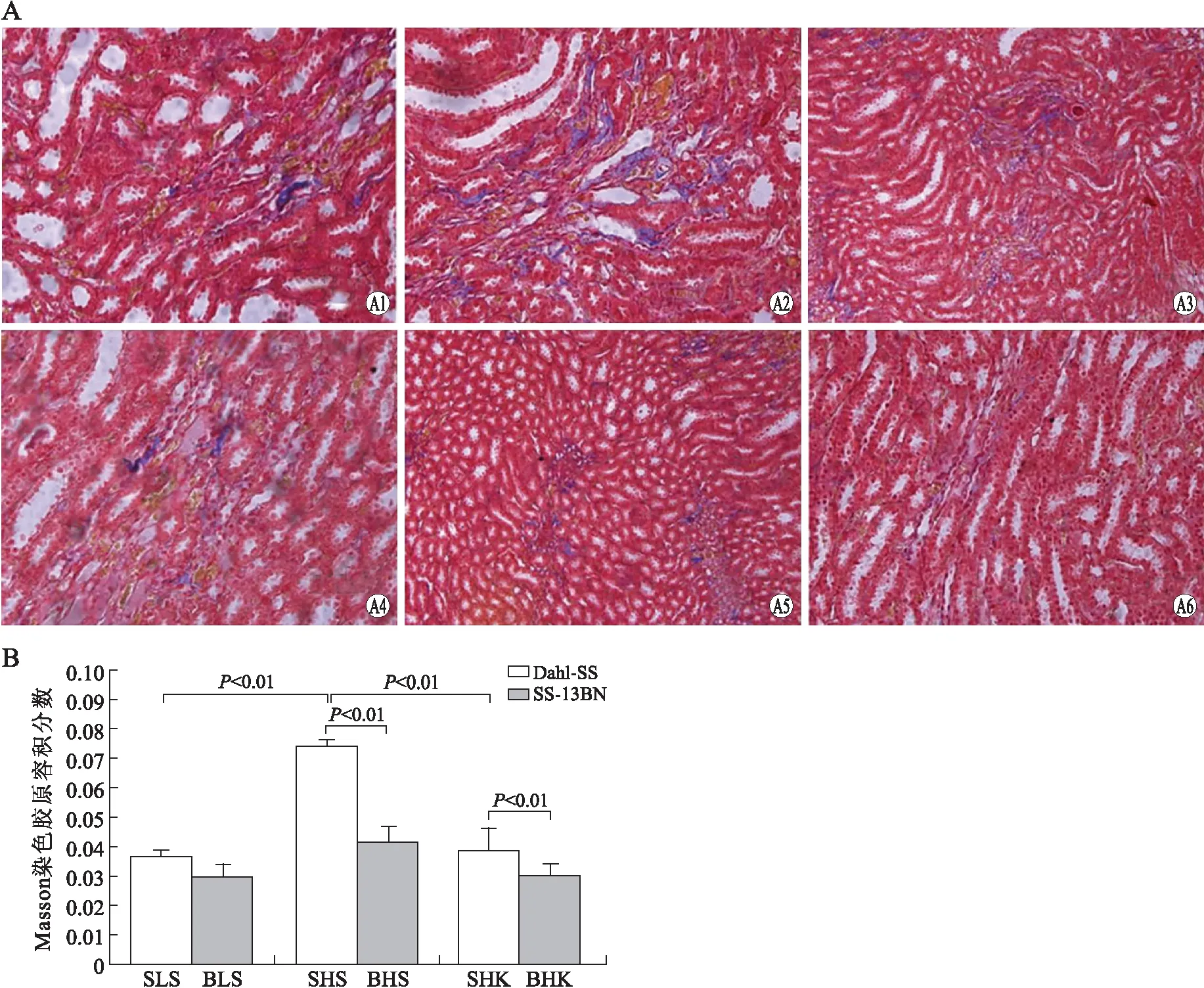
图4 各组大鼠肾小管区Masson染色的胶原容积分数Fig.4 Masson staining of collagen volume fraction in renal tubular areaA:大鼠肾小管区Masson染色(×200);A1:SLS;A2:SHS;A3:SHK;A4:BLS;A5:BHS;A6:BHK。B:大鼠肾小管区Masson染色胶原容积分数的比较。
早期实验显示,增加盐的摄入也会导致主动脉环TGF-β1表达增加,内皮细胞是盐的直接作用环节[12]。INOUE等[13]研究发现,主动脉血管内皮细胞予TGF-β1培养后一氧化氮合酶转录增多,一氧化氮产物生成增加。SANDERS等[14]也证明正常血压大鼠或盐不敏感大鼠给予盐摄入后一氧化氮增加,反馈抑制TGF-β1,进一步舒张血管,减弱剪切力。而Dahl盐敏感大鼠并非如此,其一氧化氮产物生成减少,对TGF-β1的反馈作用减弱,导致盐敏感大鼠进展性肾功能不全。此外研究还表明,对SD大鼠高盐干预,静注四乙铵,组织内TGF-β1与一氧化氮合酶的表达均被抑制,且内皮细胞中MAPK信号通路的活性亦明显受抑;而抑制MAPK信号通路后也可降低TGF-β1与一氧化氮合酶表达[15]。
本研究在高盐饮食的基础上补充钾摄入,结果显示,Dahl盐敏感组在高盐摄入的基础上大剂量补钾不仅使血压显著下降,而且能使肾髓质TGF-β1表达明显减少;无论是盐敏感组还是盐不敏感组大鼠,补钾均可使高盐负荷升高的血压和TGF-β1 mRNA及蛋白表达水平下降。提示大剂量补钾可能通过TGF-β1依赖性通路发挥血压保护作用。此外,Dahl盐敏感大鼠补钾后血压显著降低,而SS-13BN大鼠血压较高盐组也稍有降低。由此可知,根据大鼠遗传基因不同,血压对盐的敏感性不同,对钾的反应也有差别。
钾与钠离子的相互拮抗可调节内环境稳定,对过多钠盐摄入所引起的靶器官损害有一定程度的保护作用。KIDO等[16-17]对4周龄的SD大鼠分别给予低盐(4 g/L NaCl)、高盐(80 g/L NaCl)和高盐加补钾(80 g/L KCl)饮食,研究发现,补钾可以减轻盐诱导的血管内膜增生、巨噬细胞浸润,并且可以抑制超氧化物表达,抑制NADPH氧化酶减少活性氧的生成,从而发挥抗氧化效应和心血管保护作用。WANG等[18]在慢性肾病模型的SD大鼠中研究发现,补钾可以通过降低巨噬细胞的浸润、炎症因子的表达以及核因子-KB的激活从而减轻肾脏的炎性损伤;进一步研究发现,这些作用与TGF-β的下调及Smad7的上调有关。YING等[19]则发现,补钾可抑制高盐诱导的内皮细胞上钙激活的钾通道从而抑制TGF-β1的表达而发挥对靶器官的保护作用。有关补钾对肾髓质TGF-β1表达水平影响的具体机制还有待进一步研究。
参考文献:
[1] 刘治全,牟建军,李玉明,等. 盐与高血压[M]. 北京:北京医科大学中国协和医科大学联合出版社, 1997.
[2] 王文,顾东风,陈伟伟. 盐与高血压[M]. 北京:卫生部疾病预防控制局, 2009.
[3] ZHOU XJ, RAKHEJA D, YU X, et al. The aging kidney[J]. Kid Inter, 2008, 74(6):710-720.
[4] MU JJ, LIU ZQ, LIU FQ, et al. Family based randomized trial to detect effects on blood pressure of a salt substitute containing potassium and calcium in hypertensive adolescents[J]. AMJ Hypertens, 2009, 22(9):943-947.
[5] YU H, BURRELL LM, BLACK MJ, et al. Salt induces myocardial and renal fibrosis in normotensive and hypertensive rats[J]. Circulation, 1998, 98(23):2621-2628.
[6] THIERY JP, ACLOQUE H, HUANG RYJ, et al. Epithelial-mesenchymal transitions in development and disease[J]. Cell, 2009, 139(5):871-890.
[7] KALLURI R, WEINBERG RA. The basics of epithelial-mesenchymal transition[J]. J Clin Invest, 2009, 119(6):1420.
[8] AUGUST P, SUTHANTHIRAN M. Transforming growth factor beta and progression of renal disease[J]. Kid Inter, 2003,11(87):S99-S104.
[9] KAGAMI S, BORDER WA, MILLER DE, et al. Angiotensin II stimulates extracellular matrix protein synthesis through induction of transforming growth factor-beta expression in rat glomerular mesangial cells[J]. J Clin Invest, 1994, 93(6):2431.
[10] 姚颐,张杰. 肾间质纤维化相关信号转导通路的研究进展[J]. 国际泌尿系统杂志, 2007, 27(6):831-834.
[11] DAHLY AJ, HOAGLAND KM, FLASCH AK, et al. Antihypertensive effects of chronic anti-TGF-β antibody therapy in Dahl S rats[J]. Am J Physiol Regul Integr Comp Physiol, 2002, 283(3):R757-R767.
[12] YING WZ, KRISTAL A, PAUL W. Mechanism of dietary salt-mediated increase in intravascular production of TGF-β1[J]. Am J Physiol Renal Physiol, 2008, 295:F406-F414.
[13] YING WZ, SANDERS PW. Dietary salt increases endothelial nitric oxide synthase and TGF-β1 in rat aortic endothelium[J]. Am J Physiol, 1999, 277(4 Pt 2):H1293-H1298.
[14] SANDERS PW. Vascular consequences of dietary salt intake[J]. Am J Physiol Renal Physiol, 2009, 297(2):F237-F243.
[15] SANDERS PW. Dietary salt intake, salt sensitivity, and cardiovascular health[J]. Hypertension, 2009, 53(3):442-445.
[16] KIDO M, ANDO K, ONOZATO ML, et al. Protective effect of dietary potassium against vascular injury in salt-sensitive hypertension[J]. Hypertension, 2008, 51(2):225-231.
[17] OBERLEITHNER H, CALLIES C, KUSCHE-VIHROG K, et al. Potassium softens vascular endothelium and increases nitric oxide release[J]. Proc Natl Acad Sci USA, 2009, 106(8):2829.
[18] WANG W, SOLTERO L, ZHANG P, et al. Renal inflammation is modulated by potassium in chronic kidney disease: possible role of Smad7[J]. Am J Physiol Renal Physiol, 2007, 293(4):F1123-F1130.
[19] YING WZ, AARON K, WANG PX, et al. Potassium inhibits dietary salt-induced transforming growth factor-β production[J]. Hypertension, 2009, 54(5):1159-1163.
