大骨节病差异表达基因PAPSS2对成骨细胞矿化及碱性磷酸酶活性的影响
2014-06-27王伟卓程一钊王坤正袁普卫
王伟卓,程一钊,郭 雄,王坤正,袁普卫
(1.西安交通大学医学院第二附属医院骨科,陕西西安 710004;2.西安交通大学医学院环境与疾病相关基因教育部重点实验室及卫生部微量元素与地方病重点实验室,陕西西安 710061;3. 陕西中医学院附属医院骨科,陕西咸阳 712000)
骨矿化过程涉及多种机械和代谢之间的相互作用,骨的形成和维持是成骨细胞和破骨细胞复杂的动态平衡,其增殖和分化由生长因子、细胞因子以及多种酶相互作用进行调控。许多骨骼疾病,如骨质疏松症、大骨节病(Kashin-Beck disease, KBD)、Paget病、类风湿关节炎和骨转移癌等与成骨细胞和破骨细胞中的相对活性不平衡密切相关[1]。
PAPSS2(3′-phosphoadenosine-5′-phosphosulfate synthetase 2)是体内催化合成活性硫酸根供体的重要酶类基因。人类的PAPS合成ATP和SO42-两种异构体的PAPS合成酶(PAPSS):PAPSS1和PAPSS2。PAPSS2是在骨形成和其他组织细胞外基质分子的硫酸化所需的主要酶之一[2-3]。本实验室前期基因芯片研究表明,PAPSS2基因在膝骨性关节炎与KBD中差异表达,与KBD骨骼病变可能具有相关性,患者表现为长骨变短及膝和手指关节增粗增大,呈现缺乏青春期生长突增的特点[4-5]。PAPSS2基因作为筛选出的可疑候选疾病相关基因与KBD的发病存在一定的因果关系。本实验初步研究PAPSS2在小鼠成骨样细胞中的作用,以了解其对KBD骨骼代谢影响的机制。
1材料与方法
1.1细胞培养及成骨诱导本研究得到西安交通大学实验动物及伦理委员会的批准。Phoenix包装细胞系,小鼠成骨样细胞株MC3T3-E1购自上海生命科学研究院细胞资源中心。细胞接种密度为1×104cells/cm2,培养液为改良的DMEM培养基加100 mL/L胎牛血清(Gibco)、100 U/mL青霉素以及100 mg/mL链霉素,维持在37 ℃含50 mL/L CO2饱和湿度条件下,每隔5~7 d传代,不超出20代。
在成骨细胞生长培养基中通过加入0.05 mg/mL的抗坏血酸和10 mmol/L β-甘油磷酸盐(OS media),对MC3T3-E1克隆4细胞进行成骨诱导,培养14 d,并进行PAPSS2检测等后续实验。
1.2PAPSS2慢病毒包装、滴度测定和细胞转染为了证明成骨细胞分化的重要性,分析PAPSS2功能,在培养液中采用慢病毒介导的RNAi技术在MC3T3-E1细胞中沉默PAPSS2表达[5]。转染慢病毒的生成采用293FT细胞系,共转染的表达构建体(PAPSS2的Plenti-shRNA和pLenti-P2A、Plenti-P2B)和包装混合物产生病毒(TaKaRa RNAi,大连宝生物)。病毒上清液收获后48~72 h,感染293T细胞,用系列稀释的浓缩慢病毒滴度测定。转染并孵育48 h后,用RT-PCR、Western blot和免疫染色等方法检测,以确定PAPSS2基因沉默的效率。
1.3PAPSS2高表达载体的构建和逆转录病毒转染通过插入一个完整长度的3.64 kb的PAPSS2 cDNA(基因号No:NM_011864)、EcoRⅠ和NotⅠ位点的pBMN-I-GFP(Addgene),构建pBMP-PAPSS2逆转录病毒载体,包装方法来自斯坦福大学加里诺兰实验室[5]。再分别包装逆转录病毒载体pBMN-I-GFP(对照)和pBMN PAPSS2氯化钙沉淀法转染Phoenix-eco细胞。转染后,细胞放置在32 ℃培养箱(32 ℃有助于稳定的病毒)48 h。收集含有感染性病毒的培养液,并通过滴定法0.45 mm的过滤器和过滤感染的MC3T3-E克隆4细胞。观察GFP 阳性细胞证实GFP和PAPSS2蛋白表达,再进行免疫组化和Western blot分析。培养皿长满70%~80%的MC3T3-E1细胞时,使用0.006 mg/mL Polybrene协助逆转录病毒携带pBMP PAPSS2和pBMN-I-GFP感染细胞。
1.4RT-PCR检测PAPSS2表达使用Trizol试剂(Invitrogen)提取MC3T3-E1细胞中RNA,采取两步逆转录PCR法扩增,检测mRNA的表达。引物的序列如下:PAPSS2(正向引物,5′-TGTAAAACGACGGCCAGT-3′,反向引物,5′-CAGGAAACAGCTATGACC-3′),PCR扩增产物通过12 g/L琼脂糖凝胶电泳进行分离,为提高每个转录的准确度,有关频带使用NIH Image J图像量化软件和所产生的条带以GAPDH进行水平标准化。PCR反应条件分别如下:94 ℃ 1 min 35个循环:95 ℃ 30 s和58 ℃ 40 s。实验重复3次。结果与看家基因GAPDH的PCR结果相比较,评估使用循环阈值比较法计算。
1.5Westernblot检测及免疫组化染色用含有蛋白酶抑制剂(Invitrogen公司)的NP40缓冲液(10 g/L NP-40、0.15 mol/L的NaCl、50 mmol/L的Tris,pH值8.0)裂解细胞。细胞裂解液20 min后,在4 ℃下以12 000 r/min离心,上清液-80 ℃存储,使用BCA蛋白测定试剂(Pierce)进行蛋白质定量。等量的蛋白质变性SDS样品缓冲液中,100 g/L的聚丙烯酰胺-SDS凝胶上分离。蛋白质转移的25 mmol/L的Tris,192 mmol/L的甘氨酸和200 mL/L的甲醇,以产生聚偏二氟乙烯。用Tris缓冲盐水(TBS的20 mmol/L的Tris-HCl和137 mmol/L NaCl的pH为7.5)加1 mL/L Tween20的含有30 g/L的干奶粉阻断印迹。使用一抗PAPSS2抗体(ABNOVA),二抗(ABNOVA)和增强的化学发光检测系统。
细胞与PAPSS2作用后,铺于24孔板中,并保温过夜。依次用100 mL/L正常兔或小鼠血清的PBS作用60 min,然后相应地在小鼠的抗PAPSS2抗体(0.001 mg/mL,Sigma公司)孵育10 min,用1 000 mL/L甲醇固定,兔抗PAPSS2的特异性多克隆抗体(1 μg/mL,ABNOVA)在TBS含有15 mL/L正常兔或山羊血清,过夜后将细胞孵育的FITC-或HRP偶联的抗兔鼠IgG(1 μg/mL,ABNOVA),15 mL/L正常兔、驴或山羊血清,分别作用60 min。细胞用FITC标记抗体,然后洗涤3次,在PBS中,用显微镜检查。细胞核进行DAPI染色进行细胞数量的测定。
1.6碱性磷酸酶(ALP)活性的测定采取LOWRY等[6]改良的方法测定。将PAPSS2高表达、低表达及对照组的MC3T3细胞,成骨诱导7、14 d,测定ALP活性。测定混合物中含有0.1 mol/L的2-氨基-2-甲基-1-丙醇,0.001 mol/L的氯化镁,0.008 mol/L的对硝基苯基磷酸二钠(Sigma公司)和细胞匀浆。温育3 min后,停止反应,用0.1 mol/L的NaOH,并在405 nm处读出吸光度值(A)。按照说明,用p-硝基苯酚(Sigma公司)制备标准曲线。细胞的DNA根据Schneider的方法测定[7]。
1.7茜素红染色及vonKossa染色测量细胞外基质钙化结节的形成茜素红染色法可与钙相结合形成矩阵。作用14 d后,用PBS洗涤细胞2次,再用20 mL/L甲醛固定。对细胞进行染色,用40 mmol/L的茜素红溶液(pH 4.4),在室温下代谢40 min,并用去离子水漂洗2次。使用相差显微镜及数码相机(IM50,莱卡,德国)捕获被染色的细胞图像。通过抽吸除去茜素红溶液,将细胞用去离子水漂洗5次。定量采取茜素红染色样品中的浓度测定,通过比较与茜素红标准中得到的吸光率值。用100 g/L cetylpyridinium chloride(Sigma)溶解在10 mmol/L磷酸钠(pH 7.0)中将细胞脱色15 min,然后转移到96孔板中,并用分光光度计测定在562 nm处的吸光度。矿化值进行归一,直接在96孔板中确定的相对数小孔[8]。
由于钙与矩阵中的磷酸根离子共同形成沉淀物,von Kossa染色也用于测定细胞的矿化[9]。PBS洗涤细胞15 min,用20 mL/L甲醛固定。用去离子水洗涤3次后,将细胞培养在室温下,用30 g/L的硝酸银在紫外光下作用1 h。用去离子水洗涤后,使用相差显微镜拍摄染色细胞的图像。
1.8统计分析使用SPSS 17.0软件进行统计分析。数据分析采用单因素方差分析。Tukey HSD test用来作个post hoc检验。P<0.05认为差异有统计学意义。
2结果
2.1成骨细胞分化中PAPSS2mRNA及蛋白的表达变化RT-PCR结果显示,PAPSS2 mRNA水平随着成骨细胞的诱导分化过程,表达呈逐渐增多的趋势,在14 d左右MC3T3-E1分化为成骨细胞时表达比较明显(图1A、1B)。管家基因GAPDH表达在一个几乎不变的水平。进一步Western blot的检测结果显示其蛋白表达水平与mRNA水平表现一致,这些也与文献的报告相符[10](图1C、1D)。
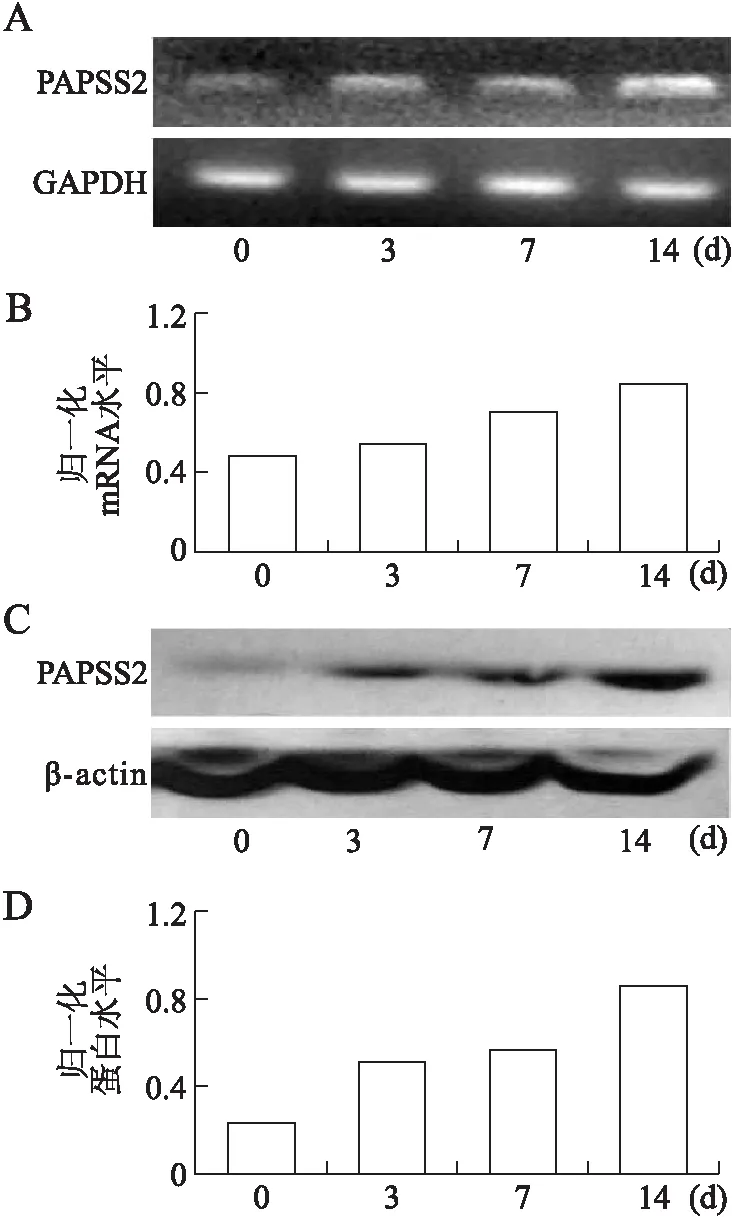
图1 成骨细胞MC3T3-E1诱导分化各时间点PAPSS2 mRNA及蛋白表达的变化
2.2PAPSS2沉默衰减矿化作用和降低ALP活性与空载体细胞转染相比较,编码小分子干扰RNA(siRNA)的PAPSS2结构稳定转染后3、7、14 d, PAPSS2在稳定转染PAPSS2沉默的细胞株中,mRNA的转录和蛋白表达被抑制,而且在转染后第7天,PAPSS2沉默的慢病毒感染的细胞中检测不到PAPSS2蛋白;同时采用干扰7 d后PAPSS2表达的免疫荧光染色,PAPSS2沉默细胞的PAPSS2蛋白表达变化与RT-PCR和Western blot的结果一致(图2)。第7天测定ALP活性,沉默组和对照组比较差异有统计学意义(P=0.0019,图3)。
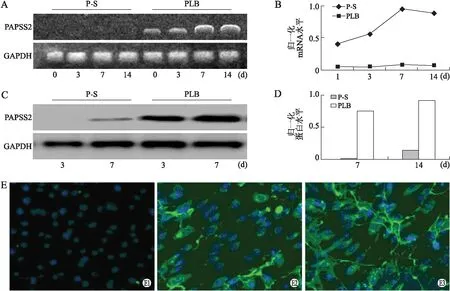
图2 PAPSS2基因沉默病毒转染及其PAPSS2的表达变化
采取von Kossa染色、茜素红染色观察矿化及定量分析,均表明PAPSS2的沉默可显著降低ALP活性(P=0.0213)和细胞矿化(图3)。这些均表明,PAPSS2沉默可以减弱MC3T3-E1细胞成骨的ALP活性和矿化。
2.3PAPSS2高表达对成骨细胞的ALP活性和矿化的影响通过在MC3T3-E1细胞中病毒转染高表达PAPSS2[5],稳定转染后,进行RT-PCR、Western blot及免疫荧光染色,结果显示,病毒感染的细胞与对照组比较, PAPSS2蛋白表达增加(图4)。与转染空载体的细胞株相比较,蛋白水平上的高表达PAPSS2都能检测到PBMN-I-GFP-PAPSS2。
而且转染的MC3T3-E1细胞中,检测到矿化信号,诱导7 d及14 d后,PAPSS2过表达转染细胞的ALP和细胞矿化都增强;茜素红染色矿化量化结果与对照组比较,差异有统计学意义(P<0.05);PAPSS2过表达转染的细胞比转染空载体的细胞的ALP活性更高(P=0.0211,图5)。这些均表明,PAPSS2促进成骨细胞的ALP活性和矿化。
3讨论
PAPSS2是一种广泛参与细胞外基质蛋白聚糖硫代谢相关酶。其异常将会影响整个蛋白聚糖的硫酸化过程,而蛋白聚糖的硫酸化对于软骨细胞的生长发育和转录后功能修饰非常重要。一些研究表明许多骨骼系统疾病与PAPSS2基因有关。曾报道KBD和一些严重的遗传性骨骼发育障碍疾患,如人类干骺端发育不良(spondyloepimetaphyseal),骨软骨发育不良(osteochondrodysplasias)与PAPSS2失活突变相关。华盛顿大学SCHWARTZ等报道外形矮小和短绌为特点Brachymorphism(bm)的小鼠,主要表现为四肢变短(尾巴粗短)及颅骨畸形,同时还伴有其他脏器的损害。发现bm小鼠的发育障碍与其骺板软骨中PAPSS2缺失有关。一种巴基斯坦家庭患有的spondyloepimetaphyseal发育不良(SEMD)与PAPSS2基因的异常有关[11-12]。一个纯合子PAPSS2的突变(S475X)被认定是SEMD的病因[12-13]。表现为不成比例的身材矮短小、下肢关节肿大、脊柱侧后凸畸形和手足过短。Diastrophic发育不良是一种常染色体隐性遗传的骨软骨发育,构成骨骼系统的疾病,增长或骨质密度有缺陷(包括短肢身材,腭裂,全身关节发育不良,搭车拇指等)。IKEDA等[14]参照骨关节炎进行了PAPSS2序列多态性的调查,人类缺乏正常PAPSS2的活性具有长骨缩短和弯曲,也显示退行性骨关节病、膝关节骨关节病的表现。鉴于在突变小鼠和其他相似之处SEMD小鼠和人类缺乏正常PAPSS2的活性过早退行性膝关节病的发展,已经有学者提出,这个突变体人类PAPSS2缺乏相关的关节模型[11]。这些都说明PAPSS2基因在骨骼发育过程中可能参与重要环节,直接影响成骨细胞的代谢。
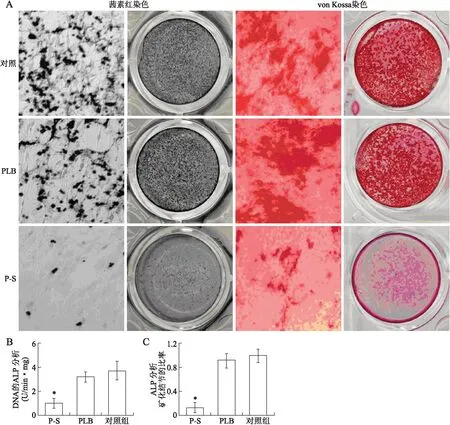
图3 PAPSS2基因沉默病毒转染及其对碱性磷酸酶活性、成骨细胞矿化的影响
本实验室前期成功利用寡核苷酸基因芯片技术,进行了KBD与正常人软骨细胞人类全基因扫描,绘制差异基因表达谱,并进行定量实时反转录聚合酶链反应(qRT-PCR)验证结果的可靠性,应用Cluster和Treeview软件对差异表达基因进行聚类分析,初步的生物信息学研究发现,KBD骨与软骨细胞存在PAPSS2基因水平的变化[4,15-16]。本实验在此基础上,利用前成骨细胞的MC3T3-E1细胞进行分化和矿化基质形成研究。ALP活性在成骨细胞矿化骨形成过程中是非常重要的,因为ALP通过水解焦磷酸盐和无机磷酸盐促进成骨细胞的矿化基质蛋白形成。为确定PAPSS2是否会影响MC3T3-E1细胞ALP活性和矿化,本实验还对ALP活性进行了评价。研究沉默PAPSS2时,显著减少了作为成骨细胞分化的重要调节因子碱性磷酸酶活性,表明PAPSS2在促进成骨细胞的分化中起着重要的作用。与之相反,高表达PAPSS2在转染后,表现出对ALP活性的抑制作用。通过染色及定量分析研究,对骨形成中的矿化作用表现出正性作用。但是这些作用涉及哪些细胞因子的参与,调节通路又是什么,需要进一步研究。
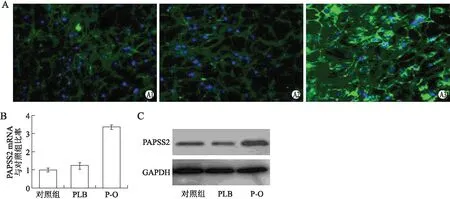
图4 PAPSS2基因高表达病毒转染及其PAPSS2的表达变化
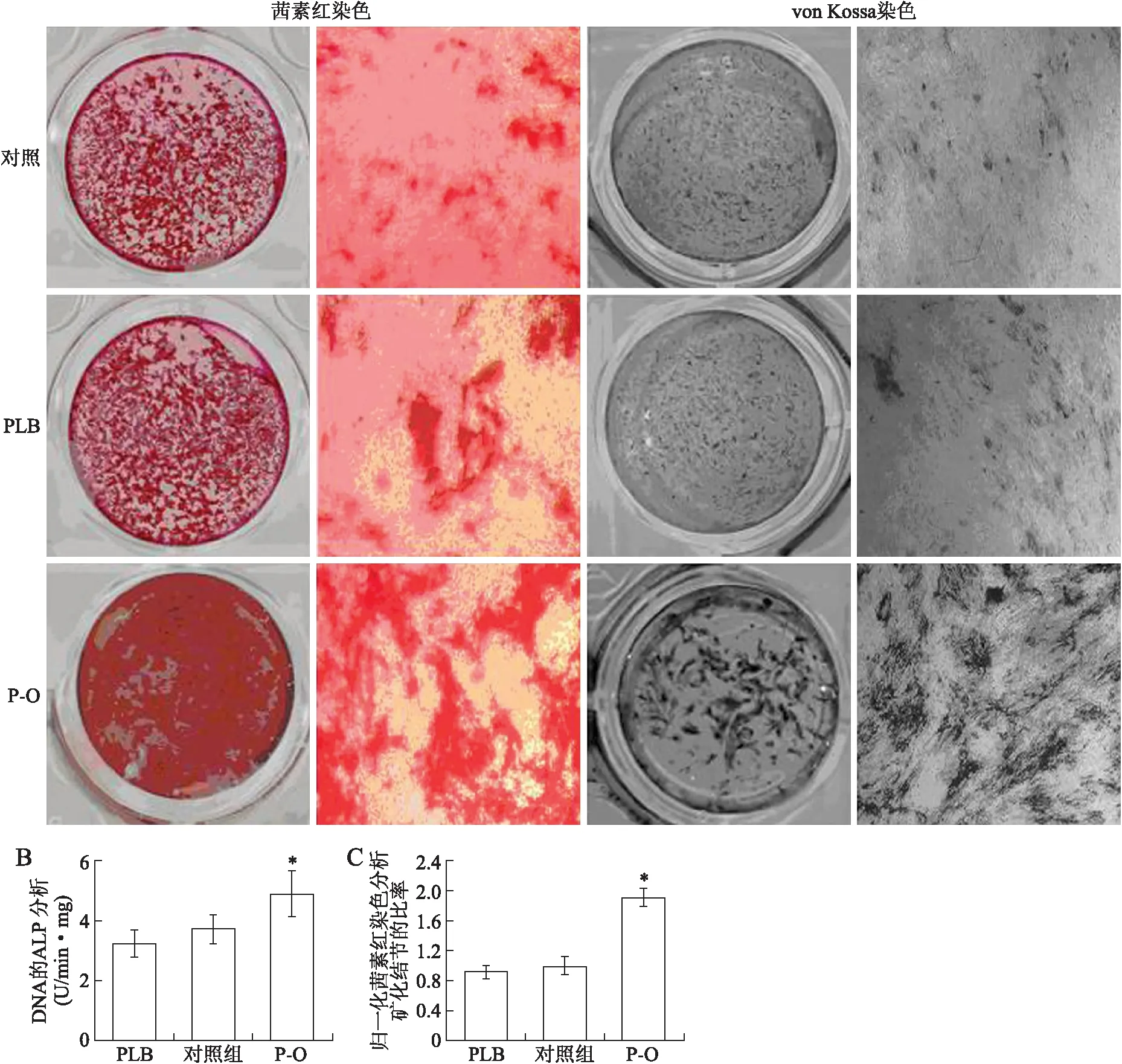
图5 PAPSS2基因高表达病毒转染及其对碱性磷酸酶活性、成骨细胞矿化的影响
以上结果表明,PAPSS2在成骨细胞分化中起着重要的作用,在KBD中的异常表达与KBD关节畸形可能相关,需进一步研究。沉默PAPSS2减少ALP分泌及活性,减弱成骨细胞的矿化作用,增加PAPSS2表达,可以促进ALP分泌及活性,增强成骨细胞的矿化作用。
参考文献:
[1] KARSENTY G. The complexities of skeletal biology[J]. Nature, 2003, 423(6937):316-318.
[2] VENKATACHALAM KV. Human 3’-phosphoadenosine 5’-phosphosulfate (PAPS) synthase: biochemistry, molecular biology and genetic deficiency[J]. IUBMB Life, 2003, 55(1):1-11.
[3] RAMASWAMY G, SOHN P, EBERHARDT A, et al. Altered responsiveness to TGF-β results in reduced Papss2 expression and alterations in the biomechanical properties of mouse articular cartilage[J]. Arthritis Res Ther, 2012, 14(2):R49.
[4] WANG WZ, GUO X, DUAN C, et al. Comparative analysis of gene expression profiles between the normal human cartilage and the one with endemic osteoarthritis[J]. Osteoarthr Cartilage, 2009, 17(1):83-90.
[5] WANG WZ, DOUGLAS O, LIANG G, et al. Collagen XXIV(col24α1)promotes osteoblastic differentiation and mineralization through TGF-β/smads signaling pathway[J]. Int J Biol Sci, 2012, 645(8):1310-1322.
[6] OZEKI K, AOKI H, FUKUI Y. The effect of adsorbed vitamin D and K to hydroxyapatite on ALP activity of MC3T3-E1 cell[J]. J Mater Sci Mater Med, 2008, 19(4):1753-1757.
[7] SCHNEIDER GB, WHITSON SW, COOPER LF. Restricted and coordinated expression of beta3-integrin and bone sialoprotein during cultured osteoblast differentiation[J]. Bone, 1999, 24(4):321-327.
[8] REINHOLZ GG, GETZ B, PEDERSON L, et al. Bisphosphonates directly regulate cell proliferation, differentiation, and gene expression in human osteoblasts[J]. Cancer Res, 2000, 60(21):6001-6007.
[9] RUNGBY J, KASSEM M, ERIKSEN EF, et al. The von kossa reaction for Calcium deposits: Silver lactate staining increases sensitivity and reduces background[J]. Histochem J, 1993, 25(6):446-451.
[10] STELZER C, BRIMMER A, HERMANNS P, et al. Expression profile of Papss2 (3’-phosphoadenosine 5’-phosphosulfate synthase 2) during cartilage formation and skeletal development in the mouse embryo[J]. Dev Dyn, 2007, 236(5):1313-1318.
[11] AHMAD M, FAIYAZ Ul, HAQUE M, et al. Distinct, autosomal recessive form of spondyloepimetaphyseal dysplasia segregating in an inbred Pakistani kindred[J]. Am J Med Genet, 1998, 78(5):468-473.
[12] FAIYAZ UL HAQUE M, KING LM, KRAKOW D, et al. Mutations in orthologous genes in human spondyloepimetaphyseal dysplasia and the brachymorphic mouse[J]. Nat Genet, 1998, 20(2):157-162.
[13] FORD-HUTCHISON AF, ALI Z, SEERATTAN RA, et al. Degenerative knee joint disease in mice lacking 3’-phosphoadenosine 5’-phosphosulfate synthetase 2 (Papss2) activity: a putative model of human PAPSS2 deficiency-associated arthrosis[J]. Osteoarthr Cartilage, 2005, 13(5):418-425.
[14] IKEDA T, MABUCHI A, FUKUDA A, et al. Identification of sequence polymorphisms in two sulfation-related genes, PAPSS2 and SLC26A2, and an association analysis with knee osteoarthritis[J]. J Hum Genet, 2001, 46(9):538-543.
[15] 郭雄. 大骨节病病因与发病机制的研究进展及其展望[J]. 西安交通大学学报:医学版, 2008, 29(5):481-488.
[16] 赵全明,王伟卓,郭雄. PAPSS2在大骨节病和骨关节炎疾病中作用机制的研究进展[J]. 国外医学:医学地理分册, 2012, 33(2):79-82.
