蛇毒半胱氨酸蛋白酶抑制剂重组蛋白对小鼠黑色素瘤血管生成拟态的影响及其机制
2014-06-27林扬元林丽琳翁剑武林建银
谢 群,林扬元,林丽琳,翁剑武,林建银
(1. 福建医科大学分子医学研究中心、消化道恶性肿瘤教育部重点实验室,福建福州 350004;2. 福建省莆田学院基础医学院,福建莆田 351100)
传统观念认为肿瘤血管即内皮依赖性血管是肿瘤获得营养供应的唯一途径,更是肿瘤侵袭转移的重要原因。自从1999年MANIOTIS等报道了在人眼葡萄膜黑色素瘤中存在由肿瘤细胞围成的管道结构血管生成拟态(vasculogenic mimicry, VM)之后[1],不断有研究证实多种恶性肿瘤存在这种与经典肿瘤血管生成途径不同的模式,且VM与肿瘤的进展和预后紧密相关[2],从而为肿瘤的治疗提供了全新思路[3]。
蛇毒半胱氨酸蛋白酶抑制剂(snake venom cystatin, sv-cystatin)是从眼镜蛇(najanajaatra)蛇毒中分离纯化的一种新型小分子蛋白质。本室前期通过基因工程合成sv-cystatin全基因,通过毕氏酵母(pichiapastoris,p.pastoris)系统表达并通过固定化金属离子配体亲和层析法 (immobilized metal affinity chromatography, IMAC)纯化生产sv-cystatin重组蛋白[4],研究发现该重组蛋白可以抑制肿瘤内皮依赖性血管生成[5]。为了进一步探讨sv-cystatin重组蛋白是否具有抗VM作用,本研究拟采用Matrigel胶肿瘤细胞类血管生成模型、免疫细胞化学染色、C57BL/6小鼠黑色素瘤实验性肺转移模型、CD34和过碘酸雪夫(periodic acid-schiff, PAS)双重染色及免疫组织化学染色等方法探讨sv-cystatin重组蛋白对小鼠黑色素瘤B16F10细胞体内外VM形成的影响及相关机制,为sv-cystatin抗肿瘤血管生成作用研究提供实验依据。
1材料与方法
1.1主要材料及试剂胎牛血清、RPMI 1640培养基购自美国Gibco公司;Matrigel胶购自BD公司;CD34、MMP-2和MMP-9抗体为Santa Cruze公司产品;SP法染色试剂盒为福州迈新生物技术开发有限公司产品;PAS试剂盒购自罗基(北京)生物技术有限公司;C57BL/6小鼠、雌性、体质量(18±2)g,6周龄,购自上海斯莱克动物实验有限公司。其余产品均为国产或进口分析纯。
1.2药物和细胞株Sv-cystatin重组蛋白由本室经p.pastoris系统表达、经IMAC纯化获得[4]。小鼠黑色素瘤细胞B16F10引自中国典型培养物保藏中心(武汉),以含100 mL/L胎牛血清的RPMI 1640培养基进行培养。
1.3方法
1.3.1Matrigel胶肿瘤细胞类血管生成模型实验 以每孔15 μL的Matrigel胶(5 mg/mL)包被96孔培养板,收集对数生长期B16F10细胞以每孔1.5×104个接种于培养板内,融合后分别加入终浓度为10、25、50、100和200 mg/L的sv-cystatin重组蛋白,设立PBS对照组。常规培养12、24、36 h后,镜下每孔选取5个视野计算肿瘤细胞类血管样结构即VM的数量。
1.3.2免疫细胞化学染色 取上述Matrigel胶肿瘤细胞类血管生成模型实验中作用12 h后的细胞进行免疫细胞化学染色,按SP法进行操作:滴加MMP-2、MMP-9第一抗体,4 ℃孵育过夜后,以相应的第二抗体室温孵育30 min后,DAB显色、苏木素复染、盐酸酒精分化、中性树胶封片后置显微镜下观察。肿瘤细胞胞质呈棕黄色为阳性表达,采用图像分析系统(Leica Qwin 3)于100倍视野下测定阳性染色吸光度值(A),每张切片随机选取3个大小相等的视野,结果以3个视野的平均值表示。
1.3.3C57BL/6小鼠黑色素瘤实验性肺转移模型 C57BL/6小鼠45只,随机分为对照组,治疗组1(每次25 mg/kg)及治疗组2(每次50 mg/kg)。用0.154 mol/L的NaCl重悬对数生长期B16F10细胞,调整浓度为1×106个/mL,3组小鼠于尾静脉分别注射200 μL瘤细胞悬液,两治疗组则分别在注射瘤细胞前24 h、注射瘤细胞后2 h及注射瘤细胞后24 h分三次于尾静脉注射相应剂量sv-cystatin重组蛋白,对照组则同法注射等体积0.154 mol/L的NaCl。21 d后处死小鼠,取肺组织,计数肺转移灶结节数,组织经固定、包埋、切片与HE染色,镜下观察病理改变。
1.3.4CD34和PAS双重染色 取上述3组小鼠肺组织进行SP法CD34免疫组织化学染色,镜下观察内皮细胞着色后,终止显色反应将切片置于过碘酸溶液氧化20 min,蒸馏水冲洗3次后置于schiff液中,室温下PAS反应15 min,经苏木素衬染、脱水、透明、树胶封片。VM的判定:镜下观察肿瘤细胞围成腔隙样结构,腔内可见红细胞,管壁可见呈樱桃红色的PAS阳性物质围成基底膜样结构将肿瘤细胞和红细胞分开,且CD34染色阴性即没有血管内皮细胞环绕,便为拟态血管VM;管壁有CD34阳性的内皮细胞和PAS染色阳性的结构,无论腔内有无红细胞则为内皮依赖性血管。每张切片随机选取5个视野计数,取其平均值。
1.3.5免疫组织化学染色 3组小鼠肺组织进行SP法免疫组织化学染色,第一抗体为MMP-2及MMP-9,参照上述免疫细胞化学染色方法进行。肺组织转移瘤细胞胞质呈棕黄色为阳性,采用图像分析系统(Leica Qwin 3)于100倍视野下测定图像中的阳性染色的吸光度,每张切片随机选取3个视野,结果以3个视野的平均值表示。
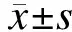
2结果
2.1sv-cystatin重组蛋白抑制B16F10细胞体外VM的形成在相应时间点观察Matrigel胶培养B16F10细胞VM形成情况。重组蛋白作用12、24、36 h时对照组均可见B16F10细胞胞体细长,自发首尾相连形成大量血管腔样网状结构即VM现象,VM形成数量(个/视野)分别达15.78±1.32、18.1±1.342、20.66±1.406,经5种浓度重组蛋白作用后B16F10细胞排列松散,VM数量减少(图1),5个剂量组(n=5)的VM数量及与对照组的比较情况如下:12 h,13.7±1.086(P=0.025)、12±1.523(P=0.000)、10.18±1.632(P=0.000)、9.22±1.301(P=0.000)、8.38±1.312(P=0.000);24 h,15.46±1.122(P=0.004)、13.56±1.531(P=0.000)、12.46±1.469(P=0.000)、10.52±1.228(P=0.000)、9.36±1.161(P=0.000);36 h,18.06±1.652(P=0.007)、16±1.503(P=0.000)、14.62±1.026(P=0.000)、12.32±1.439(P=0.000)、11.48±1.188(P=0.000);各组的差异均具有统计学意义(图2)。
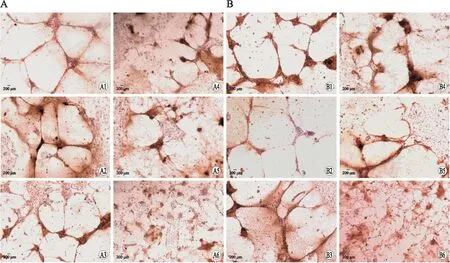
图1 sv-cystatin重组蛋白对B16F10细胞VM形成及MMP-2、MMP-9表达的影响(SP, ×100)
图2 各组VM形成数量的比较
2.2sv-cystatin重组蛋白抑制C57BL/6小鼠黑色素转移瘤VM的形成各组小鼠的肺转移率为100%,对照组可见大量散在转移灶,瘤细胞形状各异,核异型性明显,两治疗组肺转移灶明显减小、减少,提示重组蛋白可以抑制小鼠黑色素细胞肺转移[4](图3);进行CD34和PAS双重染色方法后,如图4A、4B、4C所示,对照组中可见小鼠肺转移瘤内存在较多数量的由B16F10细胞围成的、PAS阳性染色但CD34染色阴性的管腔样结构,形似血管,腔内有红细胞,外围未见血管内皮细胞,提示为拟态血管VM,而仅有CD34染色阳性的内皮细胞围成的管腔则为内皮依赖性血管。对照组VM形成数量(个/视野)为9.04±1.552(n=15);两个治疗组中VM形成的数量(6.36±1.22、3.7±1.07,n=15)与对照组相比均明显减少,差异具有统计学意义(图4D)。
2.3sv-cystatin重组蛋白抑制B16F10细胞体内外MMP-2、MMP-9的蛋白表达在进行体外VM实验的同时,应用免疫细胞化学染色检测重组蛋白作用12 h后B16F10细胞MMP-2、MMP-9蛋白表达。MMP-2(图1A)、MMP-9(图1B)在5种浓度重组蛋白作用12 h后表达逐渐降低,与对照组相比,吸光度值的差异具有统计学意义(P<0.05)(表1)。
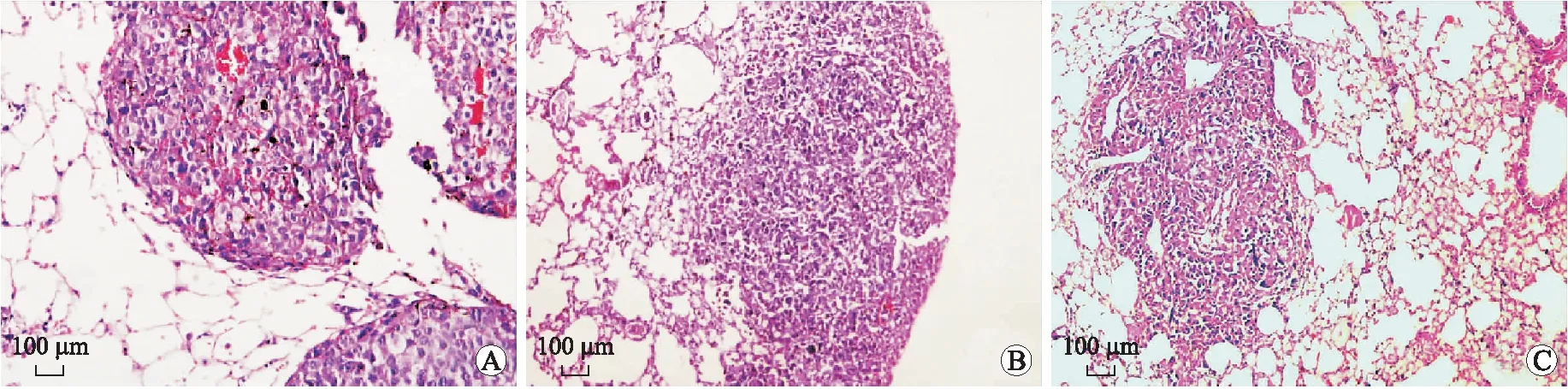
图3 各组C57BL/6小鼠肺转移肿瘤组织病理学变化
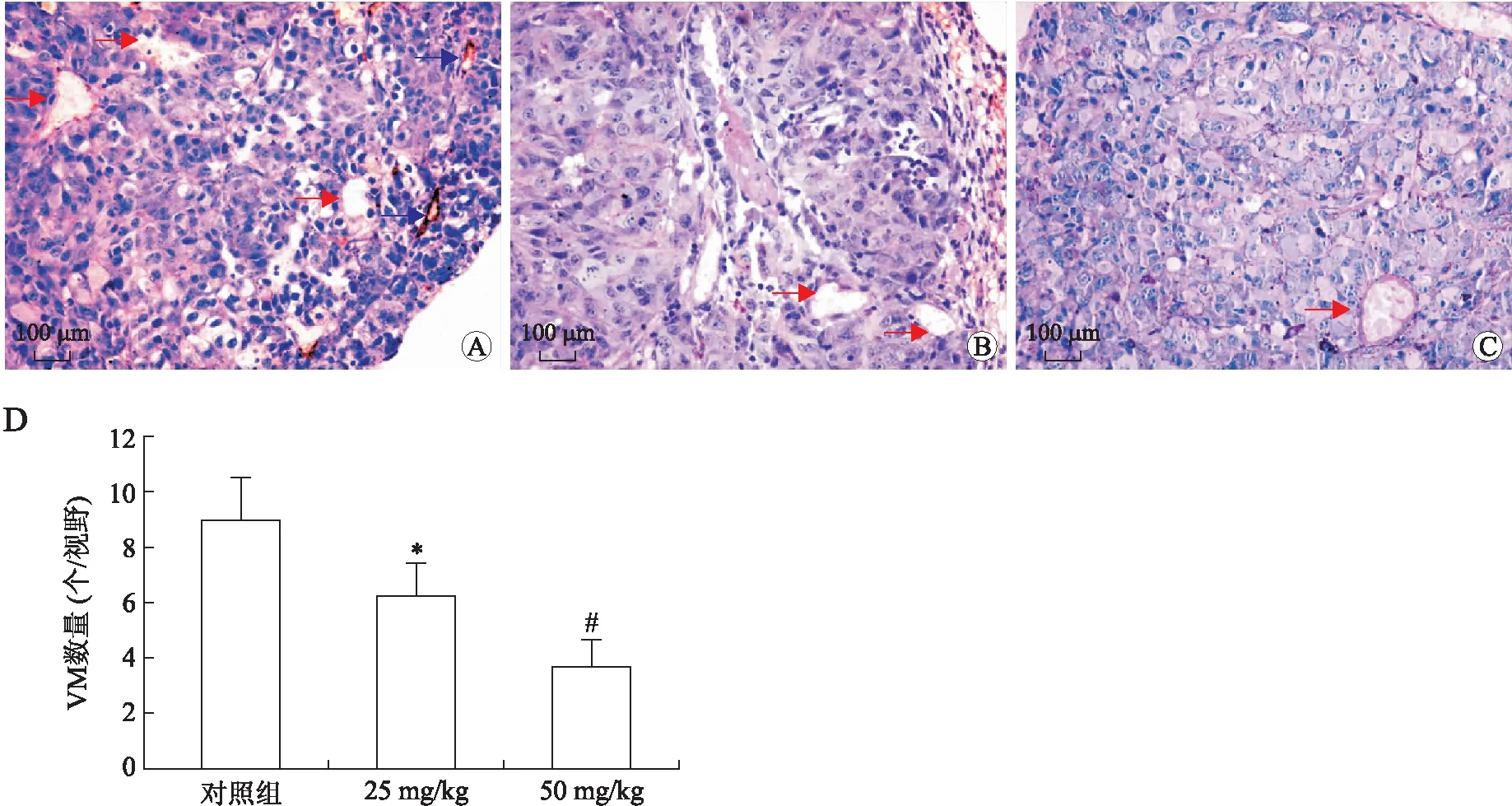
图4 sv-cystatin重组蛋白对C57BL/6小鼠黑色素转移瘤VM形成的影响Fig.4 Effects of recombinant sv-cystatin on VM formation in C57BL/6 miceA、B、C分别为对照、25mg/kg和50mg/kg各组VM及MVD形成;红色箭头示VM,蓝色箭头示MVD;CD34&PAS双重染色(×400),bar=100μm;D:各组C57BL/6小鼠肺转移灶VM数量比较;popu-lation variance F=21.213(P=0.000),∗P<0.05(P=0.007), vs. 对照组,#P<0.05(P=0.000), vs. 对照组。

表1 sv-cystatin重组蛋白对B16F10细胞MMP-2、MMP-9表达的影响
*P<0.05,vs. 对照组;MMP-2:population varianceF=73.541(P=0.000);MMP-9:population varianceF=74.909(P=0.000)。
通过SP法检测小鼠黑色素转移瘤MMP-2、MMP-9蛋白表达,如图5所示:对照组MMP-2蛋白表达呈强阳性(0.395±0.013,n=15),与对照组相比两治疗组重组蛋白抑制MMP-2表达(0.329±0.016、0.299±0.014),差异具有统计学意义(P<0.05)。图6中显示对照组MMP-9蛋白呈强阳性表达(0.355±0.014,n=15),与对照组相比两治疗组重组蛋白抑制MMP-2表达(0.29±0.012、0.26±0.012,n=15),差异具有统计学意义(P<0.05)。
3讨论
肿瘤的生长和转移依赖于血管。高度恶性肿瘤快速生长仅依赖于经典的内皮细胞依赖性血管无法满足血液供应,VM就是最初在黑色素瘤这种恶性肿瘤组织中发现的一种由肿瘤细胞环绕形成的拟态血管,肿瘤细胞通过自身变形及与细胞外基质相互作用,模拟血管壁结构形成由一层肿瘤细胞而不是内皮细胞被覆,管腔内可见血细胞, 有时可见一层PAS阳性的基质膜将肿瘤细胞和血细胞分开,从而重塑肿瘤微循环,为肿瘤生长转移提供更为充足的血液供应[6]。现已在卵巢癌、肝癌、胃癌等多种高度恶性肿瘤组织中发现[7-8]。
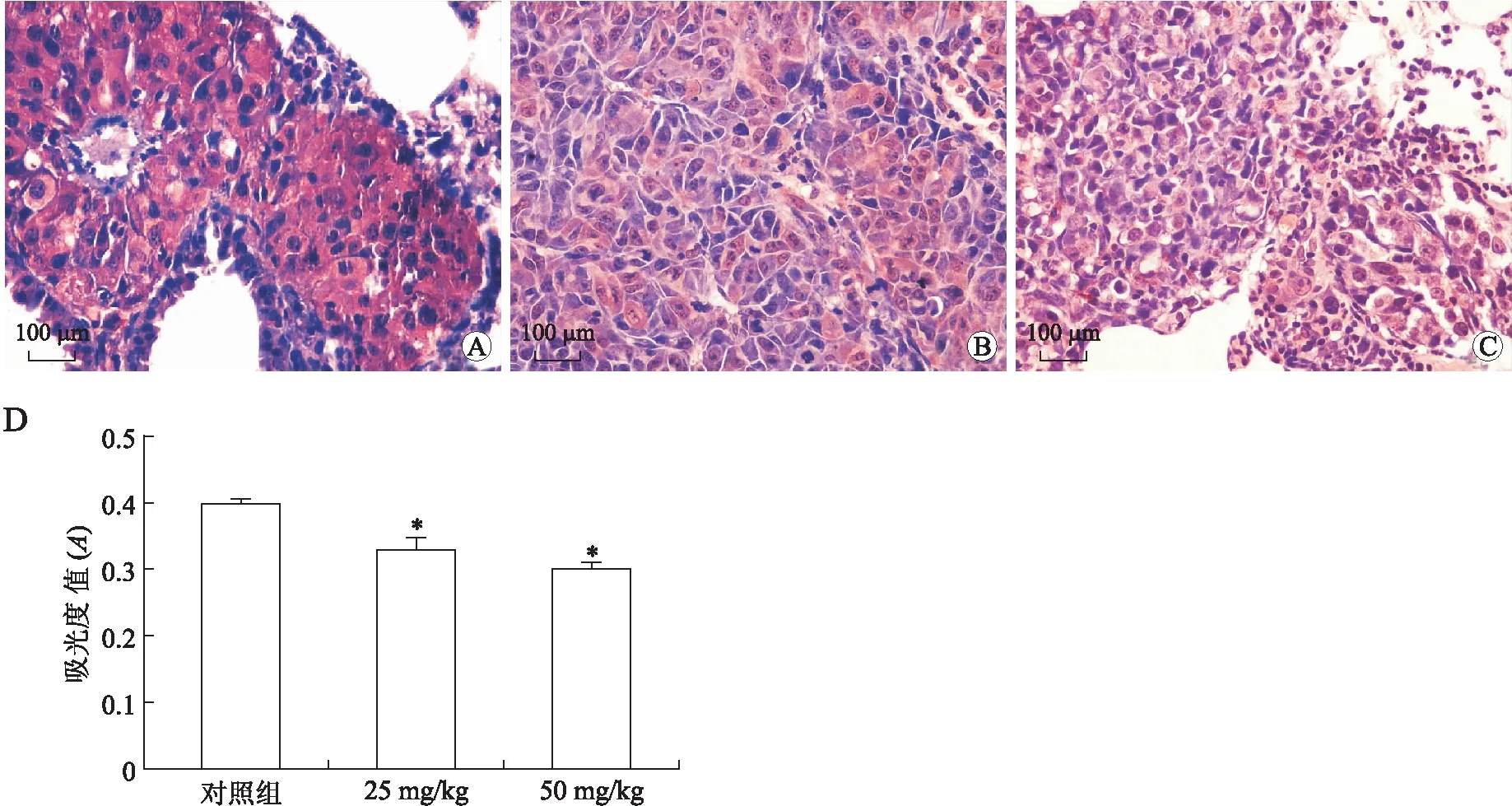
图5 sv-cystatin重组蛋白对C57BL/6小鼠黑色素肺转移瘤MMP-2表达的影响Fig.5 Effects of recombinant sv-cystatin on the expression of MMP-2 in C57BL/6 miceA、B、C分别为对照、25mg/kg和50mg/kg组MMP-2表达情况(SP, ×400),bar=100μm;D:各组C57BL/6小鼠MMP-2表达的比较; population variance F=60.161(P=0.000),∗P<0.05(P=0.000),vs.对照组。
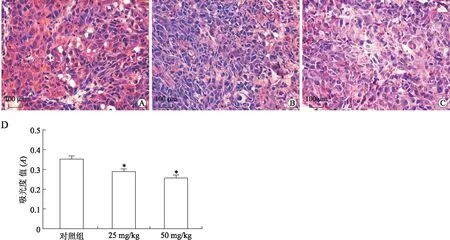
图6 sv-cystatin重组蛋白对C57BL/6小鼠黑色素肺转移瘤MMP-9表达的影响Fig.6 Effects of recombinant sv-cystatin on the expression of MMP-9 in C57BL/6 miceA、B、C分别为对照组、25mg/kg和50mg/kg组MMP-9表达情况(SP, ×400),bar=100μm;D:各组C57BL/6小鼠MMP-9表达的比较;population variance F=71.543(P=0.000),∗P<0.05(P=0.000),vs. 对照组。
本实验中将B16F10细胞进行matrigel胶三维培养,制作肿瘤细胞类血管生成模型,实验中发现sv-cystatin重组蛋白能够抑制B16F10细胞类管腔样结构即体外VM形成,且抑制作用呈剂量依赖;进而在C57BL/6小鼠黑色素瘤实验性肺转移模型的转移瘤灶内也发现B16F10细胞彼此间相连,形成网络状结构,腔内可见红细胞,证实了VM的存在,而经两个不同剂量sv-cystatin重组蛋白治疗后瘤结节变小,VM数量显著减少,说明sv-cystatin重组蛋白具有抑制黑色素瘤侵袭转移作用,且能够抑制VM的形成,结合前期实验已发现sv-cystatin重组蛋白能够抑制内皮细胞增殖、黏附、体外血管生成和微血管密度(microvessel density, MVD)[5],证实sv-cystatin能够同时抑制血管内皮依赖性血管和拟态血管,提示sv-cystatin作为一种作用广泛而全面的肿瘤血管生成抑制剂在抗肿瘤血管生成等方面具有较大的应用开发潜能。
血管生成拟态的形成机制目前尚不清楚,主要认为与肿瘤细胞的可塑性相关,肿瘤细胞能够模仿内皮细胞的生物学行为,表达VEGF、EphA2、MMPs等多种与内皮细胞相关的基因[9]。MMPs是一组Zn2+依赖性肽酶,可以降解多种细胞外基质和基底膜中的胶原成分,在肿瘤侵袭转移及血管生成中起重要作用,其中又以MMP-2和MMP-9最为重要[10]。近年来许多学者发现MMP-2、MMP-9参与了VM的形成[11-12]。本室前期研究也发现转染sv-cystatin基因可以抑制MMP-2、MMP-9的活性,提示MMPs可能是sv-cystatin的作用靶酶[13]。本实验中发现重组蛋白抑制B16F10细胞体内外MMP-2、MMP-9表达,与VM形成受抑制的结果相一致,推测重组蛋白抑制VM的作用可能与降低MMPs的表达有关,sv-cystatin通过抑制MMP-2、MMP-9表达导致其对细胞外基质的降解减少,减少VM形成,进而抑制肿瘤侵袭转移。
总之,sv-cystatin重组蛋白能够抑制肿瘤细胞体内外VM形成,从而阻断恶性肿瘤特殊的血液供应方式,间接抑制转移瘤形成,是抗肿瘤血管生成的重要途径,下调MMP-2、MMP-9表达则可能是其抑制VM形成的机制之一。研究结果将为sv-cystatin重组蛋白作为抗肿瘤侵袭转移药物的进一步研制和开发应用提供理论依据和实验数据,而VM也将有望成为高血行转移恶性肿瘤治疗的新靶点。
参考文献:
[1] MANIOTIS AJ, FOLBERG R, HESS A, et al. Vascular channel formation by human melanoma cellsinvivoandinvitro: vasculogenic mimicry[J]. Am J Pathol, 1999, 155(3):739-752.
[2] 张熙,郭世文,尉春艳. 星形细胞瘤中血管生成拟态的鉴定及其临床意义[J]. 西安交通大学学报:医学版, 2011, 32(2):205-207.
[3] PLATE KH, SCHOLZ A, DUMONT DJ. Tumor angiogenesis and anti-angiogenic therapy in malignant gliomas revisited[J]. Acta Neuropathol, 2012, 124(6):763-775.
[4] XIE Q, TANG N, WAN R, et al. Recombinant snake venom cystatin inhibits the growth, invasion and metastasis of B16F10 cells and MHCC97H cellsinvitroandinvivo[J]. Toxicon, 2011, 57(5):704-711.
[5] XIE Q, TANG N, WAN R, et al. Recombinant snake venom cystatin inhibits tumor angiogenesisinvitroandinvivoassociated with downregulation of VEGF-A165, Flt-1 and bFGF[J]. Anticancer Agents Med Chem, 2013, 13(4):663-671.
[6] SEFTOR RE, HESS AR, SEFTOR EA, et al.Tumor cell vasculogenic mimicry: from controversy to therapeutic promise[J]. Am J Pathol, 2012, 181(4):1115-1125.
[7] LIU WB, XU GL, JIA WD, et al. Prognostic significance and mechanisms of patterned matrix vasculogenic mimicry inhepatocellular carcinoma[J]. Med Oncol, 2011, 28 (Suppl 1):S228-238.
[8] LI M, GU Y, ZHANG Z, et al. Vasculogenic mimicry: a new prognostic sign of gastric adenocarcinoma[J]. Pathol Oncol Res, 2010, 16(2):259-266.
[9] CHEN LX, HE YJ, ZHAO SZ, et al. Inhibition of tumor growth and vasculogenic mimicry by curcumin through down-regulation of the EphA2/PI3K/MMP pathway in a murine choroidal melanoma model[J]. Cancer Biol Ther, 2011, 11(2):229-235.
[10] BISWAS MH, DU C, ZHANG C, et al. Protein kinase D1 inhibits cell proliferation through matrix metalloproteinase-2 and matrix metalloproteinase-9 secretion in prostate cancer[J]. Cancer Res, 2010, 70(5):2095-2104.
[11] ROBERTSON FM, SIMEONE AM, LUCCI A, et al. Differential regulation of the aggressive phenotype of inflammatory breast cancer cells by prostanoid receptors EP3 and EP4[J]. Cancer, 2010, 116(11 Suppl):2806-2814.
[12] ZHANG S, LI M, GU Y, et al. Thalidomide influences growth and vasculogenic mimicry channel formation in melanoma[J]. Exp Clin Cancer Res, 2008, 27:60.
[13] TANG N, XIE Q, WANG X, et al. Inhibition of invasion and metastasis of MHCC97H cells by expression of snake venom cystatin through reduction of proteinases activity and epithelial-mesenchymal transition[J]. Arch Pharm Res, 2011, 34(5):781-789.
