一种检测莱克多巴胺的复合碳纳米材料修饰电化学传感器
2014-06-26谢晶磊曹小妹何婧琳
谢晶磊,曹小妹,寻 艳,陈 丹,何婧琳,曹 忠*
(1.长沙理工大学化学与生物工程学院,电力与交通材料保护湖南省重点实验室,湖南长沙410004)
(2.湖南师范大学化学化工学院,湖南长沙410081)
0 引言
莱克多巴胺(Ractopamine,RAC)是一种β-肾上腺素兴奋剂,临床上常用于治疗支气管哮喘、支气管痉挛和肺气肿[1]。20世纪80年代,科学研究发现使用RAC可以有效提高动物胴体的瘦肉率[2~3],因而被非法应用于畜牧饲养中。然而,RAC在动物体内的残留期较长,且具有一定的毒性,摄入后会对人体的心血管和中枢神经系统具有潜在危害[4~6]。RAC的滥用,不仅对人们的健康和生命安全造成了严重威胁,同时也影响了我国禽畜产品的出口贸易。因此,包括中国在内的多国都严禁在动物性饲料中添加RAC,并对RAC在动物组织中的最大残留限量(Maximal residue limits,MRL)做出了明确规定。其中,世界卫生组织食品添加剂专家联席委员会(JECFA)规定RAC在肝脏和肌肉中的MRL分别为40和10 μg/kg[7]。由此可见,研究和开发检测动物组织中残留的RAC的技术和方法对维护食品安全和国家经济建设具有极其重要的意义。
到目前为止,检测动物组织中残留的RAC的方法技术主要有:高效液相色谱[8]、液相色谱仪-质谱联用[9~10]、气相色谱[11]、免疫法[12~13]和毛细管电泳[14]。这些方法虽然具有高准确性和高灵敏度,但是这些方法需要大型分析仪器、操作过程复杂且检测周期过长,无法满足大量样品的现场检测。因此,有必要建立一种简单和高效的方法来检测RAC。其中,简单高效的电化学分析法对检测RAC更具优势,目前已有不少国内外研究者进行这方面的研究[15~17]。然而,单组份纳米材料修饰电极对RAC的响应灵敏度不高,还存在抗干扰能力较弱以及重现性差等缺点。
因此,为了建立一种更为快速灵敏的RAC电化学传感器,该文将氧化石墨烯掺杂双壁碳纳米管并以Nafion为分散剂,成功地制备出均一且稳定的GO/DWCNT-Nafion复合材料修饰电极。该复合材料修饰电极对RAC表现出了极强的电催化氧化效应,氧化峰电流明显增强。该方法操作简单、灵敏度高、选择性好,在食品安全检测领域具有应用价值。
1 实验部分
1.1 仪器与试剂
CHI760B型电化学工作站(上海辰华仪器有限公司),BS124S电子天平 (北京赛多利斯仪器有限公司),KQ3200B超声波清洗器(昆山市超声仪器公司),95-2型磁力搅拌器(上海司乐仪器有限公司),CZ-500L-W型超纯水制备仪 (北京国之源有限公司)。
盐酸莱克多巴胺(C18H22NO3·HCl,RAC)购自于德国Ehrenstrorfer博士医药股份有限公司,氧化石墨烯(GO)、双壁碳纳米管(DWCNT)购买于南京吉仓纳米科技有限公司,无水乙醇、氯化钡、硫酸锌、硝酸铝、磷酸氢二钠、磷酸二氢钠、尿酸、抗坏血酸、葡萄糖、精氨酸、亮氨酸、半胱氨酸、丙氨酸及酪氨酸购自于上海国药集团化学试剂有限公司,实验用水为超纯水,所用试剂均为分析纯。
1.2 GO/DWCNT-Nafion修饰电极的制备
称取30 mg双壁碳纳米管,加入到盛有15mL浓HNO3溶液的圆底烧瓶中,油浴加热并搅拌回流7 h后,冷却至室温并离心,去除上清液。将所得产物加入到10mL浓HCl中,超声1 h后离心,去除上清液后用去离子水洗涤产物至中性。最后在100℃下真空干燥10 h,得到酸化的双壁碳纳米管,备用。取3 mg处理后的双壁碳纳米管与3 mg氧化石墨烯加入到12mL Nafion(0.1%)的无水乙醇溶液中,超声分散,直至得到均一深棕色GO/DWCNT-Nafion分散液。移取5 μL GO/DWCNT-Nafion分散液,滴加在处理好的玻碳电极表面,待溶剂自然挥发干燥,用超纯水冲洗电极表面去除结合不牢固的修饰物,制得GO/DWCNT-Nafion修饰电极。
1.3 莱克多巴胺的电化学检测
使用电化学工作站,以GO/DWCNT-Nafion修饰的玻碳电极为工作电极,Ag/AgCl电极为参比电极,铂丝电极为对电极构建常规的三电极体系,使用差分脉冲伏安法(DPV),在 pH=7.0 的PBS缓冲液中于-0.3 V下富集120 s后对不同浓度的 RAC 溶液 (1.0×10-8,5.0×10-8,1.0×10-7,2.5×10-7,5.0×10-7,7.5×10-7,1.0×10-6mol/L)进行检测,记录其氧化峰电流值。每次检测前,将GO/DWCNT-Nafion修饰电极置于PBS缓冲液中在0~1.2 V的范围内扫描循环伏安至稳定。
2 结果与讨论
2.1 GO/DWCNT-Nafion修饰电极的表征
通过扫描电子显微镜(SEM)对裸玻碳电极(GCE)、氧化石墨烯-Nafion修饰电极 (GONafion/GCE)、氧化石墨烯/双壁碳纳米管-Nafion修饰电极(GO/DWCNT-Nafion/GCE)的表面形貌进行了表征,结果如图1所示。从图1中可以看到裸玻碳电极(图1A)的表面十分光滑平整;当氧化石墨烯-Nafion修饰到电极上时,可以很直观地观察到氧化石墨烯的褶皱状结构 (图1B);而在将氧化石墨烯与双壁碳纳米管参杂后,氧化石墨烯和双壁碳纳米管均匀分散在电极表面(图1C)。氧化石墨烯与双壁碳纳米管的这种交叠结构使得氧化石墨烯/双壁碳纳米管-Nafion修饰电极具有更大的比表面积,有利于增加莱克多巴胺分子的吸附量。

图1 裸玻碳电极(A),GO-Nafion修饰电极(B),GO/DWCNT-Nafion修饰电极(C)的扫描电镜图Fig.1 SEM images of bare GCE(A),GO-Nafion/GCE(B),GO/DWCNT-Nafion/GCE(C)
2.2 莱克多巴胺在修饰电极上的差分脉冲伏安特性
将GO-Nafion修饰电极、DWCNT-Nafion修饰电极和GO/DWCNT-Nafion修饰电极分别对5.0×10-7mol/L的莱克多巴胺溶液进行差分脉冲伏安实验,结果如图2所示。由图2曲线a、b、c可知,GO/DWCNT-Nafion修饰电极对莱克多巴胺的氧化峰电流要明显强于GO-Nafion修饰电极和DWCNT-Nafion修饰电极,说明GO/DWCNT-Nafion复合材料对莱克多巴胺氧化作用具有更强的电催化氧化效应,这是由于GO和DWCNT之间更紧凑的空间结构导致电极表面在拥有更多的具有电化学活性区域以及更大的比表面积[18],协同增强莱克多巴胺的电催化氧化。
2.3 pH的优化
pH直接影响着莱克多巴胺在GO/DWCNTNafion修饰电极上的电化学行为。在pH值为2.0~9.0 的 PBS 缓冲液(0.01 mol/L)中,莱克多巴胺(2.0×10-7mol/L)的氧化峰电流和氧化峰电位随pH值的变化关系如图3所示。当PBS缓冲液的pH值由2.0增加到7.0时,莱克多巴胺的氧化峰电流逐渐增大:当缓冲液的pH=7.0时,莱克多巴胺的氧化峰电流达到最大值;而当缓冲液的pH值超过7.0之后,氧化峰电流开始降低。因此,选择pH=7.0的PBS缓冲体系检测莱克多巴胺。

图2 不同修饰电极在5.0×10-7mol/L的莱克多巴胺溶液中的差分脉冲伏安图Fig.2 DPV curves of GO-Nafion/GCE(a),DWCNTNafion/GCE(b)and GO/DWCNT-Nafion/GCE(c)in phosphate buffer solution(0.1 mol/L,pH=7.0)containing 5.0×10-7mol/L RAC
2.4 莱克多巴胺的定量检测
在pH=7.0的PBS缓冲液中于-0.3 V下富集120 s后,使用GO/DWCNT-Nafion修饰电极检测不 同 浓 度 的 莱 克 多 巴 胺 (1.0×10-8,5.0×10-8,1.0×10-7,2.5×10-7,5.0×10-7,7.5×10-7,1.0×10-6mol/L),结果如图4所示。莱克多巴胺的电信号随着其浓度的增长而逐渐增强,峰电流与莱克多巴胺浓度在 1.0×10-8mol/L~1.0×10-6mol/L 范围内呈现良好的线性关系,其线性方程为ip(μA)=9.319c(μmol/L)+0.147,相关系数 r=0.998 1,检测限为 5.4×10-9mol/L(S/N=3)。 这说明该电化学传感器对于莱克多巴胺具有较好的电催化氧化响应。
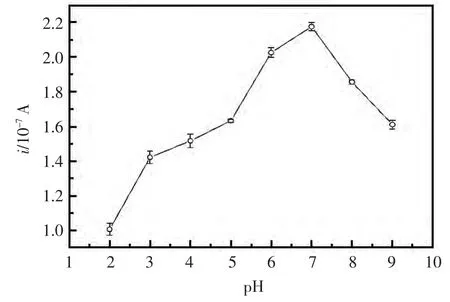
图3 不同pH对检测2.0×10-7mol/L莱克多巴胺的影响Fig.3 Effects of pH on the detection of 2.0×10-7mol/L RAC

图4 GO/DWCNT-Nafion修饰电极对不同浓度莱克多巴胺的差分脉冲伏安图(A)及其响应电流与莱克多巴胺浓度的校正曲线(B)Fig.4 Typical DPV curves(A)of different concentrations of RAC and corresponding calibration curve(B)
2.5 选择性的考察
为了考察该方法对RAC检测的选择性,以常见生物体内的常见分子和结构相似的化合物干扰物进行差分脉冲伏安测试(图5)。固定莱克多巴胺的浓度为2.0×10-7mol/L,含有1 000倍浓度的 Ba2+、Zn2+、Al3+,100 倍浓度的尿酸、 抗坏血酸、葡萄糖、精氨酸、亮氨酸、丙氨酸和半胱氨酸的共存均对莱克多巴胺的检测无干扰;同倍浓度的克伦特罗对莱克多巴胺的检测有较小的干扰,响应电流上升了约9.1%;100倍浓度的酪氨酸有一定的干扰性,响应电流提高了75.3%,当酪氨酸的浓度降到25倍时,对莱克多巴胺的检测无影响。
3 结论
该文将双壁碳纳米管和氧化石墨烯超声分散于Nafion溶液中,成功的制备了均一的GO/DWCNT-Nafion复合纳米材料修饰玻碳电极。与GO-Nafion修饰电极和DWCNT-Nafion修饰电极相比,GO/DWCNT-Nafion修饰电极对莱克多巴胺表现出了强的催化氧化效应,响应电流明显增强。在pH=7.0的PBS缓冲液中于-0.3 V下富集120 s后,GO/DWCNT-Nafion修饰电极对莱克多巴胺在 1.0×10-8~1.0×10-6mol/L 的范围内有着良好的线性响应,检测限为 5.4×10-9mol/L,且选择性好,表明该传感器在食品安全检测领域中具有实际应用价值。
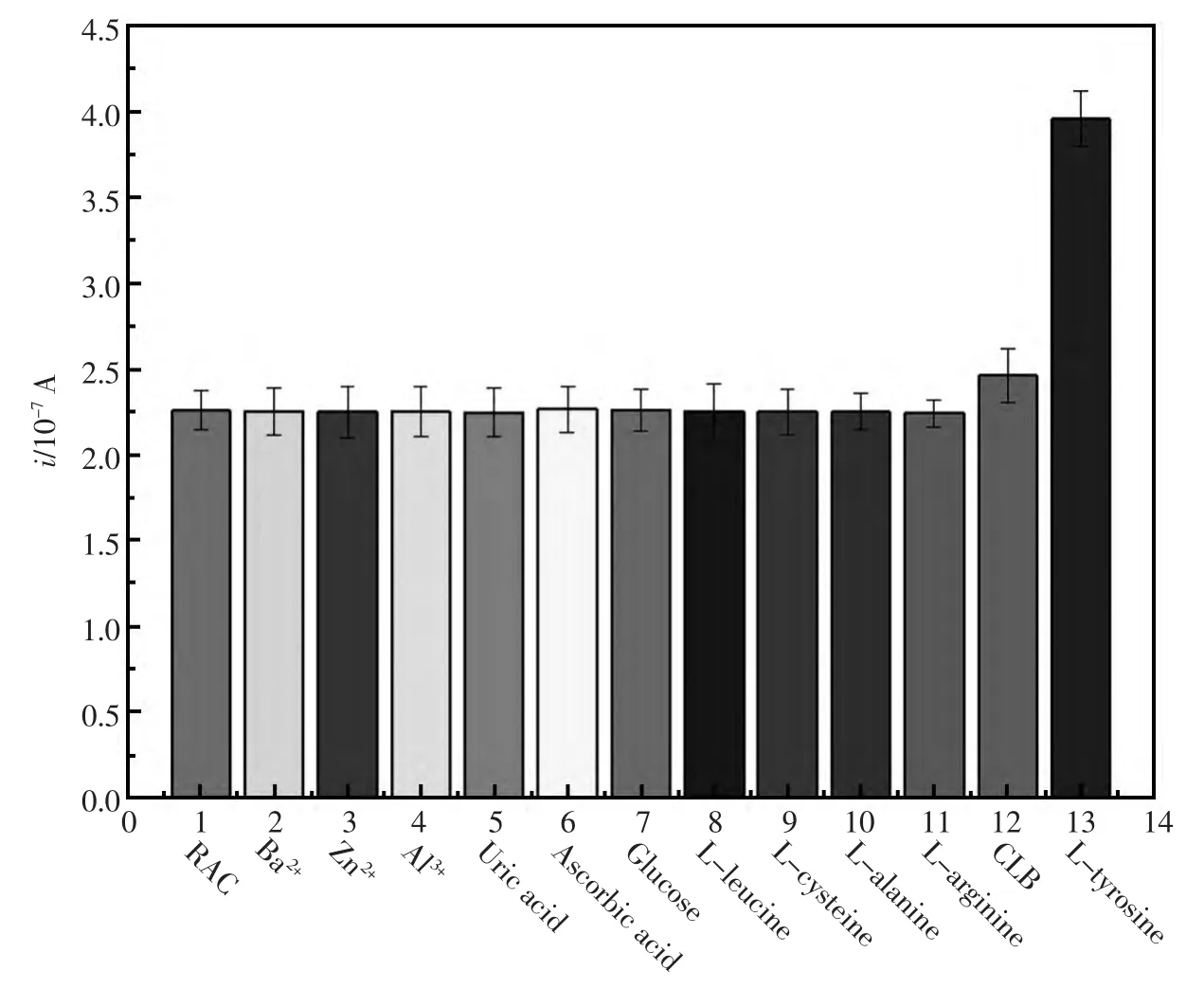
图5 干扰物效应柱状图.莱克多巴胺的浓度为 2.0×10-7mol/L,Ba2+、Zn2+、Al3+的浓度为 2.0×10-4mol/L,尿酸、抗坏血酸、葡萄糖、精氨酸、亮氨酸、丙氨酸和半胱氨酸的浓度为2.0×10-5mol/L,克伦特罗浓度为2.0×10-7mol/LFig.5 Effect of interfering substance on the modified electrode.The concentration of RAC is 2.0×10-7mol/L,and Ba2+,Zn2+,and Al3+are 2.0×10-4mol/L,uric acid,ascorbic acid,glucose,L-leucine,L-cysteine,L-alanine,and L-tyrosine are 2.0×10-5mol/L,and CLB is 2.0×10-7mol/L
[1]Johnson S E,Stelzleni A M,Thrift T A,et al.Effect of ractopamine-HCl supplementation for 28 days on carcass characteristics,muscle fiber morphometrics,and whole muscle yields of six distinct muscles of the loin and round[J].Meat.Sci.,2010,85:379~384.
[2]Dong J X,Li Z F,Lei H T,et al.Development of a singlechain variable fragment-alkaline phosphatase fusion protein and a sensitive direct competitive chemiluminescent enzyme immunoassay for detection of ractopamine in pork[J].Anal.Chim.Acta,2012,736:85~91.
[3]Eshaq S,Chai S C,Jamokha S,et al.Determination of ractopamine in animal tissues by liquid chromatographyfluorescence and liquid chromatography/tandem mass spectrometry[J].Anal.Chim.Acta,2003,483:137~145.
[4]Bolera D D,Shrecka A L,Faulknera D B,et al.Effect of ractopamine hydrochloride(Optaflexx)dose on live animal performance,carcass characteristics and tenderness in early weaned beef steers[J].Meat Sci.,2012,92:458~463.
[5]Vale A.β2-Agonists[J].Medicine,2007,35:597.
[6]Halsey C H C,Weber P S,Reiter S S,et al.The effect of ractopamine hydrochloride on gene expression in adipose tissues of finishing pigs[J].J.Ani.Sci.,2011,89:1 011~1 019.
[7]Residues of Some Veterinary Drugs in Animals and Foods[M].FAO Food and Nutrition paper 41/14,2004,16:90.
[8]Turberg M P,Rodewald J M,Coleman M R.Determination of ractopamine in monkey plasma and swine serum by high-performance liquid chromatography with electrochemical detection[J].J.Chromatogr.B,1996,675:279~285.
[9]Dong Y C,Xia X,Wang X,et al.Validation of an ultraperformance liquid chromatography-tandem mass spectrometry method for determination of ractopamine:Application to residue depletion study in swine[J].Food Chem.,2011,127:327~332.
[10]Li C,Wu Y L,Yang T,et al.Simultaneous determination of clenbuterol,salbutamol and ractopamine in milk by reversed-phase liquid chromatography tandem mass spectrometry with isotope dilution[J].J.Chromatogr.A,2010,1217:7 873~7 877.
[11]He L M,Su Y J,Zeng Z L,et al.Determination of ractopamine and clenbuterol in feeds by gas chromatography–mass spectrometry[J].Ani.Feed Sci.Technol.,2007,132:316~323.
[12]Liu M,Ning B A,Qu L J,et al.Development of indirect competitive immunoassay for highly sensitive determination of ractopamine in pork liver samples based on surface Plasmon resonance sensor[J].Sens.Actuators,B,2012,161(1):124~130.
[13]Dong J X,Li Z F,Lei H T,et al.Development of a singlechain variable fragment-alkaline phosphatase fusion protein and a sensitive direct competitive chemiluminescent enzyme immunoassay for detection of ractopamine in pork[J].Anal.Chim.Acta,2012,736:85~91.
[14]Wang W Y,Zhang Y L,Wang J Y,et al.Determination of β-agonists in pig feed,pig urine and pig liver using capillary electrophoresis with electrochemical detection[J].Meat Sci.,2010,85:302~305.
[15]Liu Z,Zhou Y K,Wang Y Y,et al.Enhanced oxidation and detection of toxic ractopamine using carbon nanotube film-modified electrode[J].Electrochim.Acta,2012,74:139~144.
[16]Wu C,Sun D,Li Q,et al.Electrochemical sensor for toxic ractopamine and clenbuterol based on the enhancement effect of graphene oxide[J].Sens.Actuators,B,2012,168:178~184.
[17]Duan J H,He D W,Wang W S,et al.The fabrication of nanochain structure of gold nanoparticles and its application in ractopamine sensing[J].Talanta,2013,115:992~998.
[18]Wang S C,Yang J,Zhou X Y,et al.Electrochemical properties of carbon nanotube/graphene oxide hybrid electrodes fabricated via layer-by-layer self-assembly[J].J.Electroanal.Chem.,2014,722-723:141~147.
