离子液体修饰碳糊电极方波伏安法测定氨氯地平
2014-06-26蒙丽君高作宁郑志祥
犹 卫,蒙丽君,高作宁,郑志祥
(1.宁夏大学化学化工学院,宁夏银川750021)
(2.宁夏医科大学基础医学院,宁夏银川750004)
0 引言
苯磺酸氨氯地平 (amlodipine besylate,Aml),为 (±)3-乙基-5-甲基-2-(2-氨基乙氧甲基)-4-(2-氯苯基)-1,4二氢-6-甲基-3,5吡啶二羧酸二酯苯磺酸盐[1],是第三代钙通道拮抗剂[2],用于治疗高血压及心绞痛等[3]。由于它较其他钙通道拮抗剂的不良反应少而轻,病人易耐受而得到越来越广泛的应用。对它的测定方法主要为高效液相色谱法[2,4~7],其它测定方法还包括容量法[1],光度法[8]和电化学方法等[9~12]。该文在前期工作[13~15]基础上采用热稳定性好,导电率高[16]的离子液体1-苄基-3-甲基咪唑六氟磷酸盐修饰碳糊电极([BnMIM]PF6/CPE)研究氨氯地平的电化学行为,研究结果显示该修饰电极对氨氯地平的氧化有明显的促进作用,并以此建立了直接定量测定氨氯地平的电化学分析方法。
1 实验部分
1.1 仪器与试剂
CHI660A电化学工作站 (美国CHI仪器公司),以CPE和[BnMIM]PF6/CPE为工作电极,饱和甘汞电极(SCE)为参比电极,CHI115铂丝为辅助电极。
Aml原料药 (宁夏康亚药业有限公司,批号20100608,含量 99.6%),Aml对照品(中国药品生物制品检定所,批号:100374-200301);苯磺酸氨氯地平片 (山西晋华药业有限公司,批号20101001)。离子液体1-苄基-3-甲基咪唑六氟磷酸盐[BnMIM]PF6(上海成捷化学有限公司,纯度99.6%),二甲基亚砜(DMF)(上海英鹏添加剂化工有限公司试剂分公司,优级纯),二甲硅油(江西阿尔法高科药业有限公司,优级纯);石墨粉(国药集团化学试剂有限公司,光谱纯);所用其它试剂均为分析纯。在使用前未经进一步纯化;实验用水均为二次去离子水,在电化学测试前于电解池中通入高纯氮除氧5 min。
该文所涉及到的电位均为相对于SCE电极电位,所有电化学测试均在室温下进行。
1.2 电极制作及电化学阻抗谱表征
CPE和 [BnMIM]PF6/CPE工作电极的制作参照文献[14~15]方法,文献中粘合剂液体石蜡均换成同比例的电阻较低的二甲硅油。每次测试之前推出部分碳糊抛光后使用。所制备的电极在pH6.8的 PBS缓冲溶液(Phosphate buffer solution,PBS)中用循环伏安法(CV)、交流阻抗法(EIS)和方波伏安法(SWV)研究了Aml在 CPE、及[BnMIM]PF6/CPE上的电化学行为,并进行了表征和检测。
通过电极电化学阻抗谱可以提供电极表面修饰过程中电极电阻变化信息[17]。以[Fe(CN)6]3-/4-为探针,考察其在两种电极上的阻抗行为,结果显示(图1),CPE(曲线a)在高频部分出现明显的半圆弧(半圆弧直径代表电荷转移电阻),这是由于不导电的二甲硅油的存在降低了CPE导电能力,因此表现出较大的电阻;[BnMIM]PF6/CPE(曲线b)的电化学阻抗谱图明显的半圆弧直径减小,表明其电阻明显小于CPE,说明[BnMIM]PF6的存在能有效减小电荷传递电阻,这是由于离子液体具有良好的离子导电性[16]而极大地提高了修饰电极的导电效率,加快了电极上电荷传递速度。
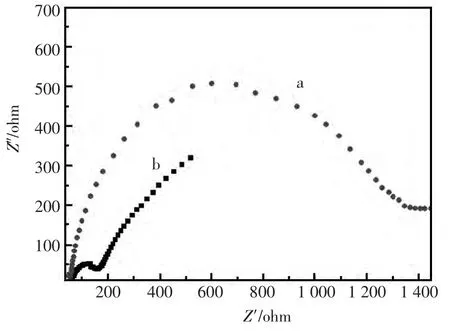
图1 电极电化学阻抗谱图Fig.1 Electrochemical impedance spectra of different electrode a.CPE;b.[BnMIM]PF6/CPE Solution:5.0mmol/L Fe(CN)63-/4-+1.0 mol/L KCl
2 结果与讨论
2.1 Aml伏安行为
在0.10 mol/L PBS中分别以CPE和[BnMIM]PF6/CPE 为工作电极,在 0.0~1.2 V 电位窗口内以20 mV/s扫描速度对浓度为 1.0×10-4mol/L 的Aml进行CV测试得到其循环伏安曲线(图2)。由曲线可知,氨氯地平在 [BnMIM]PF6/CPE上于0.691 V处出现一敏锐的不可逆氧化峰。氧化峰电流为3.712×10-6A,与其在CPE上相比氧化峰电位负移了64 mV,氧化峰电流比在裸电极增大2倍多,该实验结果表明,[BnMIM]PF6/CPE对氨氯地平电化学氧化具有良好的催化作用。该催化的可能原因是离子液体具有高的离子电导率[14~15],作为修饰剂加入到碳糊电极中可以改善电极的导电性,加快电极上的电子交换速度。
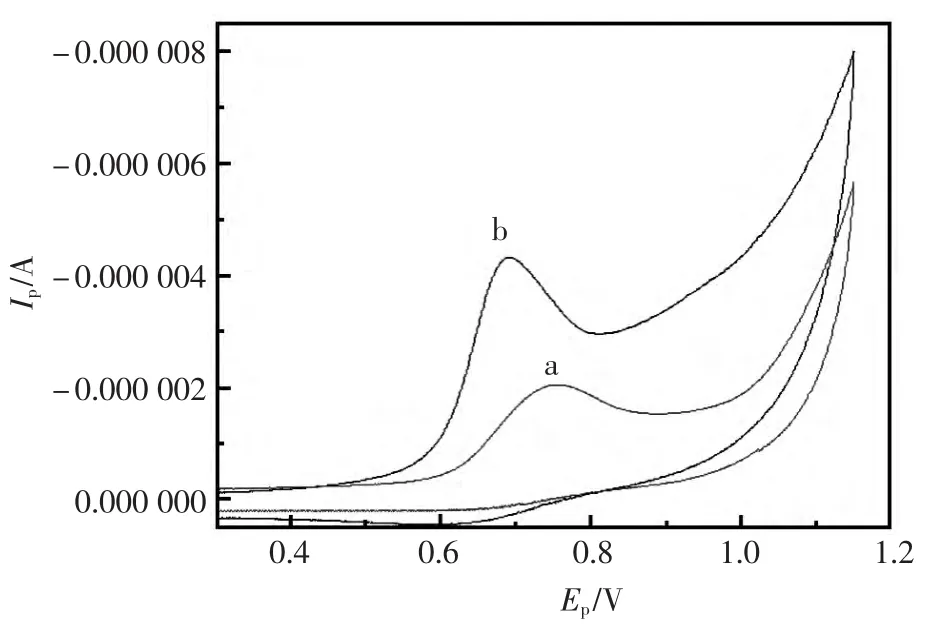
图2 Aml在不同电极上的循环伏安曲线Fig.2 CV curves of Aml at different electrodes a:CPE;b:[BnMIM]PF6/CPE cAml=1.0×10-4mol/L;scan rate:20 mV/s
在扫描速度20~600 mV/s范围内运用CV法研究了扫描速度对氨氯地平电化学行为的影响(图3)。实验结果表明,氨氯地平在[BnMIM]PF6/CPE上的氧化峰电位(Ep)随扫描速度(ν)增加发生正移,氧化峰电流Ip随ν的增加呈增加趋势,并且在此扫描速度范围内Ip与ν呈良好的线性关系,线性拟合方程为 Ip(μA)=1.918+0.024 66(mV/s),r=0.999 3。 此结果表明,Aml在[BnMIM]PF6/CPE上是一受吸附控制的不可逆的电化学氧化反应的电极过程。
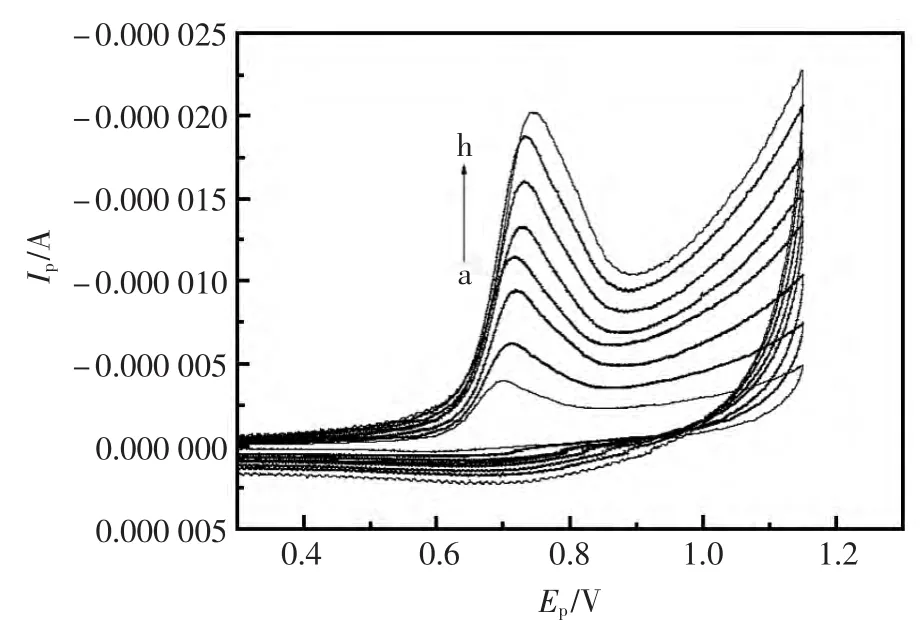
图3 不同扫描速度Aml的CV图Fig.3 Aml Cyclic voltammogram a→h as 0.050,0.10,020,0.25,030,0.40,0.50,0.60 V/s,respectively.c(Aml):1.0×10-4mol/L
2.2 实验条件的影响
在电位窗口 0.0~1.4 V 范围以 50 mV/s扫描速度分别以 0.05~0.10 mol/L KCl,NaClO4,Na2SO4,CH3COONa,PBS 和 B-R(Britton-Robinson buffer,B-R)等水溶液为支持电解质进行CV测试。实验结果表明,在PBS水溶液中,Aml具有良好的电化学行为,因此选用PBS水溶液为支持电解质。同时比较了 Aml在 0.05~0.50 mol/L PBS 浓度范围内的伏安行为。实验结果表明,在浓度为0.10 mol/L PBS溶液中Aml氧化峰形良好,由此确定PBS 最佳浓度为 0.10 mol/L。
考察了介质pH对Aml氧化峰电位Ep与氧化峰电流 Ip的影响。 在 pH2.0~9.0范围内, 对1×10-4mol/L Aml进行CV测试。实验结果表明,随pH增加Aml峰电位明显发生负移,表明其在[BnMIM]PF6/CPE上的电化学氧化反应过程中有质子参与。在 pH2.0~5.0范围内氧化峰电流 Ip随pH增加而增大,在pH5.0~8.0范围内氧化峰电流随pH增加而趋于平稳,随后在pH=8.0开始降低。在研究过程中我们选择pH6.86为最佳实验条件。
2.3 电化学动力学参数
2.3.1 电子转移系数α
在电位窗口0.0~1.2 V及扫描速度20~600 mV/s 范围内对 1.0×10-4mol/L Aml在[BnMIM]PF6/CPE电极进行CV测试,结果表明Ep~logν呈良好线性关系。线性回归方程为E(mV)=908.1+61.03 log ν(mV/s),r=0.995 4。 由直线斜率求得∂Ep/∂(logν)=61.03 mV。
根据完全不可逆扩散控制过程方程式[18]
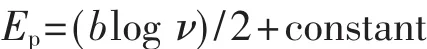
式中b代表Tafel斜率,由此可得Ep-log ν直线斜率为 b/2,即 b=2×∂Ep/∂(log ν)=122.1 mV。根据 b=2.303 RT/n(1-α)F(已知 n=2[12]), 求得α 值为 0.76。
2.3.2 扩散系数D
电位阶跃计时电量法(CC)是电化学研究中用于测定电极面积以及研究扩散性质常用的方法之一,用CC法考察了Aml在[BnMIM]PF6/CPE表面的扩散系数。即施加一阶跃电位,记录Q~t关系曲线。由Cottrell方程[19]可知
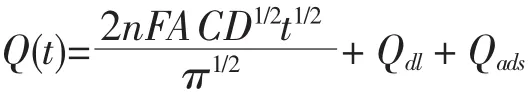
以[Fe(CN)6]3-为模型化合物(在 1.0 mol/L KCl中其扩散系数D=7.6×10-6cm2/s)[19],采用 CC 法测得测定了 [BnMIM]PF6/CPE的电极面积为3.484 × 10-2cm2。对浓度为 1.0 × 10-4mol/L 的 Aml进行CC测定得到Q~t关系曲线,Q~t1/2直线斜率为 1.796×10-4,计算得 D 为 2.86×10-6cm2/s。
2.3.3 电极反应速率常数kf
在平板电极上对于准可逆电极反应,CA法满足以下关系式[20]:
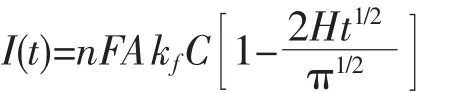
2.4 电分析方法应用
2.4.1 Aml的方波伏安行为、线性范围及检出限
在 0.10 mol/L PBS中以 [BnMIM]PF6/CPE 为工作电极,在0.1~1.2 V电位窗口内用优化了的SWV法(振幅30 mV,频率25 Hz,电位增量4 mV)对Aml进行测定得到SWV曲线(图4)。其氧化峰电流与浓度在 1.2×10-6~1.0×10-3mol/L 范围内呈线性关系, 线性拟合方程:Ip(μA)=9.020+0.020 58 c(10-3mol/L), r=0.996 5, 检出限(3S/N)3.3×10-7mol/L。
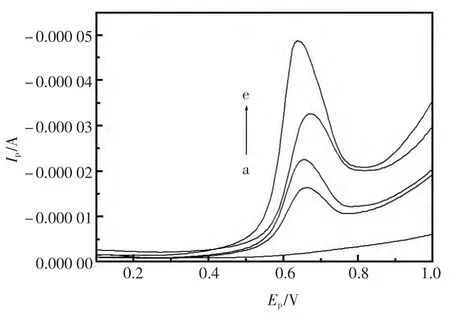
图4 Aml的SWV图Fig.4 Square wave voltammetry of Amlodipine a:0.10 mol/L PBS;b-e:0.20,0.40,0.70,1.0 ×10-4mol/L,respectively.
此前考察了富集电位对Aml氧化峰电流的影响。当富集电位从0 V逐渐增大到0.5 V时,Aml在 [BnMIM]PF6/CPE上的氧化峰电流基本保持不变,此结果说明富集电位对Aml的氧化峰电流没有明显的影响。在15~120 s范围内考察了富集时间对Aml的氧化峰电流的影响,氧化峰电流随着富集时间的增加而逐渐增大,当富集时间达到90 s时,氧化峰电流基本保持不变,因此选择90 s为最佳富集时间。
2.4.2 干扰实验
对 1.0×10-4mol/L Aml在 0.10 mol/L PBS 水溶液中进行干扰实验。实验结果表明,当相对误差不超过±5%范围时,100倍的常用药用辅料(淀粉、糊精、蔗糖、滑石粉、硬脂酸镁、羧甲基淀粉钠、微晶纤维素等),常见离子(K+、Na+、Zn2+、Ca2+、Cl-、NO3-、C2O42-、SO42-) 等存在时对氨氯地平的电流测定响应均不产生影响,而文献报道同类的含有二氢吡啶环的钙通道拮抗剂如硝苯地平、尼莫地平、尼群地平等对测定干扰严重[12]。
2.4.3 电极重现性试验
同一支 [BnMIM]PF6/CPE在相同条件下,对1.0×10-4mol/L Aml,运用 SWV 法考察氧化峰电流的变化。平行测定6次,测得峰电流的RSD为2.1%,表明制作的修饰碳糊电极有良好的重现性。电极在4℃的冰箱放置一周或连续测定50次以上,对Aml的响应电流在测定误差范围内,表明制作的[BnMIM]PF6/CPE具有较好的稳定性,能够应用于定量分析检测。
2.4.4 样品测定
测定了市售苯磺酸氨氯地平片。取市售药品20片,精密称定,研细,精密称取细粉适量(约相当于氨氯地平5 mg),用乙醇定容至10mL,摇匀,滤过。取滤液 0.10mL,如 2.4.1 项下运用 SWV法进行测定;另外加入已知量的氨氯地平标准品进行加标回收率实验,测定结果参见表1。
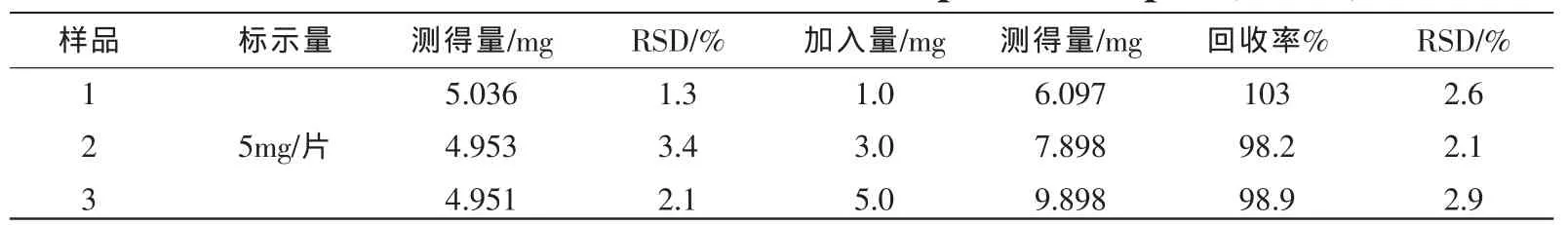
表1 样品测定结果Tab.1 Determination results of Amlodipine in samples(n=5)
由表1测定结果可知,氨氯地平样品测定的相对标准偏差在 1.3%~3.4%之间,回收率在98.2%~103%之间。此结果表明该方法的精密度和准确度符合定量测定要求。
[1]YBH07742006.苯磺酸氨氯地平国家药品标准[S].
[2]徐国津,李新春.高效液相色谱法测定苯磺酸氨氯地平的含量及有关物质[J].中国药学杂志,2008,43(1):60~63.
[3]夏青.氨氯地平的药理和临床应用[J].中外医疗,2008,25:86~87.
[4]陈笑艳,栾 燕,钟大放,等.液相色谱-质谱-质谱联用法测定人血浆中氨氯地平[J].药学学报,2001,36(1):51~54.
[5]李成平,严小平,单伟光.苯磺酸氨氯地平片剂含量的高效液相色谱法测定[J].药物分析杂志,2006,26(12):1 878~1 879.
[6]汪正宇.苯磺酸氨氯地平片的HPLC测定[J].安徽医药,2006,10(8):581~582.
[7]顾洪安,苗积康,张曙华,等.液相色谱-串联质谱法测定人血清中苯磺酸氨氯地平的浓度[J].中国新药与临床杂志,2007,26(10):737~740.
[8]李江,周红,许兴友,等.紫外分光光度法测定氨氯地平含量[J].化工矿物与加工,2001, 3:22~24.
[9]Göksel Altiokka,Dilek Dogrukol-AK,Muzaffer Tuncel,et al.Determination of Amlodipine in Pharmaceutical Formulations by Differential-Pulse Voltammetry with a Glassy Carbon Electrode[J].Arch.Pharm.Pharm.Med.Chem,2002,2:104~108.
[10]李翼,姬政,武丽萍,等.电位滴定法测定苯磺酸左旋氨氯地平的含量[J].药物分析杂志,2004,24(6):619~620.
[11]Azza Abdel Kader Gazy.Determination of amlodipine besylate by adsorptive square-wave anodic stripping voltammetry on glassy carbon electrode in tablets and biological fluids[J].Talanta,2004,62:575~582.
[12]明亮,习霞,陈婷婷,等.多壁碳纳米管修饰电极测定氨氯地平[J].应用化学,2008,25(7):829~833.
[13]马风凯,包佳丽,马明亮,等.沙丁胺醇在SDBS现场自组装膜与 [BnMIM]PF6复合修饰碳糊电极上的电催化氧化及电分析方法[J].分析测试学报,2012,31(8):962~966.
[14]Zhang Y M,You W,Gao Z N,et al.Electrochemical Behaviors of Methocarbamol at an Acetylene Black-Ionic Liquid Modified Carbon Paste Electrode and its Electrochemical Determination[J].Croat.Chem.Acta,2013,86(3):309~315.
[15]Liu L H,You W,Zhan X M,et al.Electrochemical behavior of lansoprazole at a multiwalled carbon nanotubes–ionic liquid modified glassy carbon electrode and its electrochemical determination[J].J.Serb.Chem.Soc,2014,79(1):39~52.
[16]Jairton Dupont,Roberto F de Souza,Paulo AZ Suarez.Ionic Liquid (Molten Salt)Phase Organometallic Catalysis[J].Chem.Rev,2002,102(10):3 667~3 691.
[17]Zhang Q,Wei W,Cao Z G.Direct electrochemistry and electrocatalysis ofheme proteinsimmobilizedongoldnanoparticlesstabilizedbychitosan[J]. Electroanalysis,2008,20(9):1 002~1 007.
[18]Golabi S M,Zare H R.Electrocatalytic oxidation of hydrazine at glassy carbon electrode modified electrodeposited film derived from caffeic acid[J].Electroanalysis,1999,11(17):1 293~1 300.
[19]Adams R N.Electrochemistry at Solid Electrodes[M].New York:Marcel Dekker,1969:220~222.
[20]吴浩青,李永舫.电化学动力学[M].北京:高等教育出版社,1998:95~99.
