2-乙酰基-6-三甲基硅基苯基三氟甲磺酸酯的合成*
2014-06-23孙银蕾刘波
孙银蕾,刘波
(1.中国科学院新疆理化技术研究所,新疆乌鲁木齐 830011;2.中国科学院大学,北京 100049)
2-乙酰基-6-三甲基硅基苯基三氟甲磺酸酯的合成*
孙银蕾1,2,刘波1
(1.中国科学院新疆理化技术研究所,新疆乌鲁木齐 830011;2.中国科学院大学,北京 100049)
以2-三甲基硅基苯酚为原料,经甲酰化、酯化、亲核加成和氧化反应首次合成了3-乙酰基苯炔的前体——2-乙酰基-6-三甲基硅基苯基三氟甲磺酸酯,总收率35%,其结构经1H NMR和13C NMR确证。
2-三甲基硅基苯酚;2-乙酰基-6-三甲基硅基苯基三氟甲磺酸酯;3-乙酰基苯炔前体;密旋霉素;合成
密旋霉素(1)是土壤中链霉菌属微生物的次级代谢产物,于1961年由Upjohn公司首次从Streptomyces pactum var.pactum的发酵液中分离得到。1具有抗癌、抗革兰阴性菌和革兰阳性菌的作用,已被用作蛋白质合成的阻断剂[1]。由于其多手性中心的特殊结构和生物活性,近年来1的合成受到了化学家的关注[1-7]。
1 具有间取代氨基苯乙酮结构。构建该结构可从烷烃C-N键及Ar-N键的形成考虑。在Hanessian等[2]于2011年报道的1的全合成中,是以3-(2-丙烯基)苯胺对环氧乙烷亲核加成的策略构建C-N键。此外,间取代氨基苯乙酮结构的构建还可以通过Ar-N键的形成:(1)在Cu[8]和Pd[9]的催化下间卤代苯乙酮和胺偶联而成;(2)通过苯炔与胺反应形成[10-11](Chart 1)。相较于卤代苯与胺反应,苯炔与胺的反应具有更广的底物适用范围,尤其是对具有较大位阻的胺基化合物的芳基化转化。该方法中3-乙酰基苯炔的逆合成分析可得其前体为2-乙酰基-6-三甲基硅基苯基三氟甲磺酸酯(2)。
到目前为止,2的合成方法还未见报道,因此,对其合成进行研究具有重要意义。值得提出的是,同样可作为3-乙酰基苯炔前体的3-乙酰基-2-三甲基硅基苯基三氟甲磺酸酯(3,Chart 1),SmithⅢ和Kim[12]于2010年报道了其合成方法,该方法的缺点是:作为其合成原料的3-羟基-2-溴苯甲醛价格高昂。
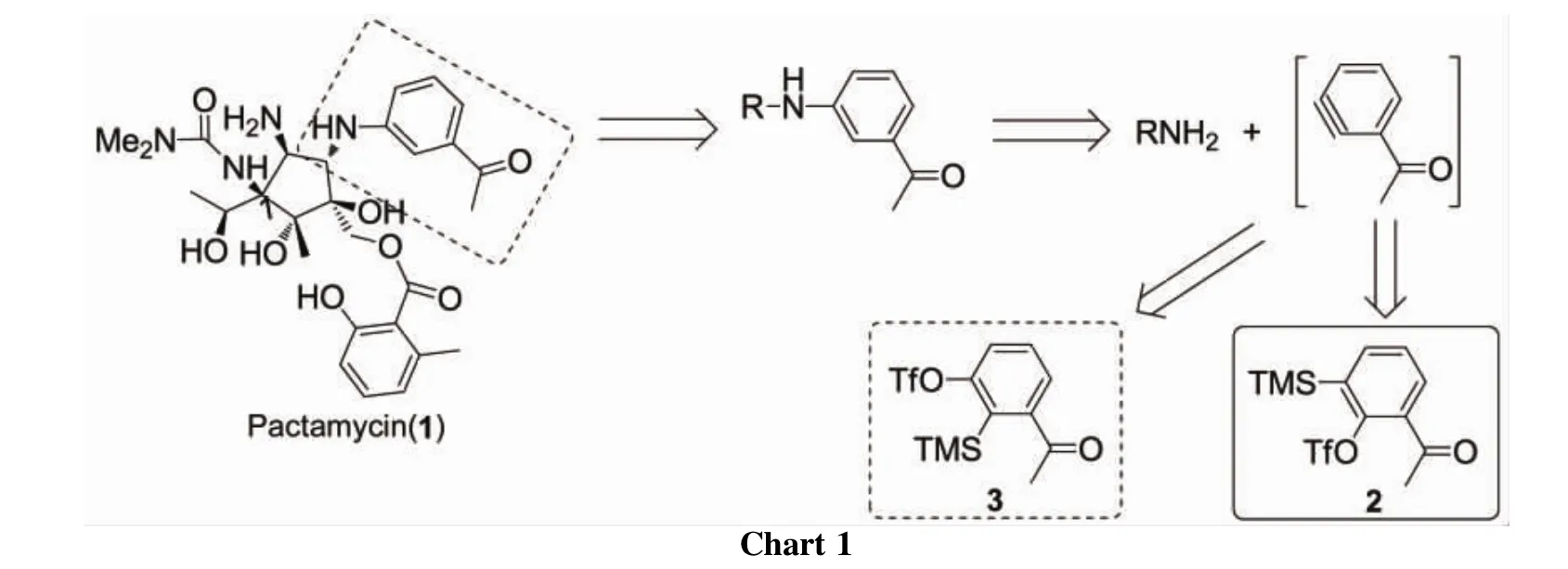
本文首次建立了一种简便、高效合成2的方法。以2-三甲基硅基苯酚(4)为原料,经甲酰化、酯化、甲基格氏试剂对甲酰基的亲核加成、羟基的氧化4步反应合成了2(Scheme 1),总产率35%,其结构经1H NMR和13C NMR确证。
1 实验部分
1.1 仪器与试剂
Varian 400-MR型核磁共振仪(CDCl3为溶剂,TMS为内标);DFY-5/80型低温恒温反应浴。
4 按文献方法以苯酚[13]或邻氯苯酚[14]为原料制备;其余所有试剂均为分析纯,其中THF和乙醚用钠及二苯甲酮除水,二异丙胺用氢化钙除水。
1.2 合成
(1)2-羟基-3-三甲基硅基苯甲醛(5)的合成
氩气保护,在干燥两口瓶中依次加入无水氯化镁6.54 g(68.8 mmol),多聚甲醛3.10 g(103.2 mmol)和无水THF 170 mL,搅拌下缓慢滴加三乙胺9.6 mL(68.8 mmol),滴毕,于室温反应10 min;缓慢滴加4 5.71 g(34.4 mmol),滴毕,回流反应2 h。冷却至室温,用乙醚(70 mL)萃取,有机相依次用1 mol·L-1盐酸(3×70 mL)(有气体产生)、饱和食盐水(3×70 mL)洗涤,无水硫酸钠干燥,浓缩后经硅胶柱层析[洗脱剂:A=V(石油醚)∶V(乙酸乙酯)=20∶1]纯化得淡黄色油状液体5 5.58 g,产率84%;1H NMR δ:0.33(s,9H,CH3),7.02(t,J=7.4 Hz,1H,ArH),7.55(d,J=7.6 Hz,1H,ArH),7.63(d,J=6.8 Hz,1H,ArH),9.90(s,1H,CHO),11.31(s,1H,OH);13C NMR δ:197.0,166.5,142.8,135.1,128.9,119.9,1.1。
(2)2-甲酰基-6-三甲基硅基苯基三氟甲磺酸酯(6)的合成
于-10℃,在Schlenk瓶中依次加入无水THF 35 mL和二异丙胺0.75 mL(5.32 mmol),搅拌下缓慢滴加2.5 mol·L-1BuLi 2.1 mL(5.32 mmol)的正己烷溶液,滴毕,反应30 min;冷却至-78℃,加入5 1.00 g(5.15 mol)的THF(35 mL)溶液,反应1 h;缓慢滴加三氟甲磺酸酐(Tf2O)1.5 mL(10.50 mmol),滴毕,反应6 h。用饱和氯化铵淬灭反应,用饱和食盐水洗涤,无水硫酸钠干燥,浓缩后经硅胶柱层析[洗脱剂:B=V(石油醚)∶V(乙醚)=100∶1]纯化得淡黄色油状液体6 0.94 g,产率56%;1H NMR δ:0.43(s,9H,CH3),7.55(t,J=7.4 Hz,1H,ArH),7.85 (d,J=7.2 Hz,1H,ArH),8.02(d,J=7.2 Hz,1H,ArH),10.22(s,1H,CHO);13C NMR δ: 186.9,152.4,142.6,136.8,131.2,131.1,128.8,118.80(q,J=318.9 Hz,CF3),0.2。
(3)2-(1-羟乙基)-6-三甲基硅基苯基三氟甲磺酸酯(7)的合成
在Schlenk瓶中依次加入Mg屑43 mg(1.77 mmol)和无水Et2O 2 mL,搅拌下缓慢滴加CH3I 0.11 mL(1.77 mmol),待Mg屑溶解后,冷却至0℃。缓慢滴加6 0.56 g(1.72 mmol),滴毕,于室温反应30 min。冰浴冷却至0℃,用饱和氯化铵溶液淬灭反应,用Et2O(3×10 mL)萃取,合并萃取液,用无水硫酸钠干燥,浓缩后经硅胶柱层析(洗脱剂:A=20∶1)纯化得无色油状液体7 0.46 g,产率78%;1H NMR δ:0.39(s,9H,CH3),1.49(d,J=6.8 Hz,3H,CH3),2.20(s,1H,OH),5.24(q,J=6.4 Hz,1H,CH),7.44(t,J=7.4 Hz,1H,ArH),7.51(d,J=7.2 Hz,1H,ArH),7.74(d,J=6.8 Hz,1H,ArH);13C NMR δ:147.6,139.6,136.6,135.3,129.8,129.0,118.8(q,J=318.1 Hz,CF3),63.7,24.0,0.4。
(4)2的合成
在反应瓶中依次加入7 0.46 g(1.35 mmol)和丙酮13 mL,搅拌下滴加Jones reagent 1.3 mL(将三氧化铬26.72 g溶于20%硫酸100 mL),于室温反应至原料反应完。加水10 mL,用乙酸乙酯(3×15 mL)萃取,合并萃取液,用无水硫酸钠干燥,浓缩后经硅胶柱层析(洗脱剂:B=80∶1)纯化得淡黄色油状液体2 0.43 g,产率94%;1H NMR δ:0.41(s,9H,CH3),2.61(s,3H,CH3),7.46(t,J=7.6 Hz,1H,ArH),7.64(d,J=7.6 Hz,1H,ArH),7.70(d,J=7.2 Hz,1H,ArH);13C NMR δ:198.4,147.7,139.6,137.0,135.3,130.6,128.1,118.5(q,J=318.9 Hz,CF3),29.5,0.1。
2 结果与讨论
4 经甲酰化反应合成5时,水对反应较为敏感,反应中所涉及的物料需严格除水干燥;5与Tf2O的酯化反应过程要避免体系温度升高,从而造成体系黏稠,后处理难度增大。
本文首次提出了一种简单、高效地合成2-乙酰基-6-三甲基硅基苯基三氟甲磺酸酯的方法,对天然产物密旋霉素的3-氨基的乙酰基苯基官能化上具有潜在应用价值。
[1]Matsumoto N,Tsujimoto T,Nishikawa T.Synthetic studies on pactamycin,a potent antitumor antibiotic [J].RSC Adv,2012,2(25):9448-9462.
[2]Hanessian S,Vakiti R R,Dorich S,et al.Total synthesis of pactamycin[J].Angew Chem Int Ed,2011,50 (15):3497-3500.
[3]Malinowski J T,McCarver S J,Johnson J S.Diastereocontrolled construction of pactamycin's complex ureido triol functional array[J].Org Lett,2012,14 (11):2878-2881.
[4]Haussener T J,Looper R E.Access to the pactamycin core via an epoxide opening cascade[J].Org Lett,2012,14(14):3632-3635.
[5]Hanessian S,Vakiti R R,Dorich S,et al.Total synthesis of pactamycin and pactamycate:A detailed account[J].J Org Chem,2012,77(21):9458-9472.
[6]Knapp S,Yu Y.Synthesis of the oxygenated pactamycin core[J].Org Lett,2007,9(7):1359-1362.
[7]Nishikawa T,Urabe D,Isobe M.Synthesis of functionalized cyclopentane for pactamycin,a potent antitumor antibiotic[J].Synlett,2005,(3):433-436.
[8]Lindley J.Tetrahedron report number 163:Copper assisted nucleophilic substitution of aryl halogen[J].Tetrahedron,1984,40(9):1433-1456.
[9]Wolfe J P,Marcoux J F,Buchwald S L.Rational development of practical catalysts for aromatic carbon-nitrogen bond formation[J].Acc Chem Res,1988,31 (12):805-818.
[10]Zim D,Buchwald S L.An air and thermally stable one-component catalyst for the amination of aryl chlorides[J].Org Lett,2003,5(14):2413-2415.
[11]Harris M C,Huang X,Buchwald S L.Improved functional group compatibility in the palladium-catalyzed synthesis of aryl amines[J].Org Lett,2002,4 (17):2885-2888.
[12]Surry D S,Buchwald S L.Dialkylbiaryl phosphines in Pd-catalyzed amination:A user's guide[J].Chem Sci,2011,2(1):27-50.
[13]Liu Z,Larock R C.Facile N-arylation of amines and sulfonamides[J].Org Lett,2003,5(24):4673-4675.
[14]Liu Z,Larock R C.Facile N-arylation of amines and sulfonamides and O-arylation of phenols and arenecarboxylic acids[J].J Org Chem,2006,71(8):3198-3209.
[15]SmithⅢA B,Kim W S.Diversity-oriented synthesis leads to an effective class of bifunctional linchpins uniting anion relay chemistry(ARC)with benzyne reactivity[J].PNAS,2011,108(17):6787-6792.
[16]Bronner S M,Garg N K.Efficient synthesis of 2-(trimethylsilyl)phenyl trifluoromethanesulfonate:A versatile precursor to o-benzyne[J].J Org Chem,2009,74 (22):8842-8843.
[17]Atkinson D J,Sperry J,Brimble M A.Improved synthesis of the benzyne precursor 2-(trimethylsilyl)phenyl trifluoromethanesulfonate[J].Synthesis,2010,(6):911-913.
Synthesis of 2-Acetyl-6-(trimethylsilyl)phenyl Trifluoromethanesulfonate
SUN Yin-lei1,2,LIU Bo1
(1.Xinjiang Technical Institute of Physics&Chemistry,University of Chinese Academy of Sciences,Urumqi 830011,China;2.University of Chinese Academy of Sciences,Beijing 100049,China)
2-Acetyl-6-(trimethylsilyl)phenyl trifluoromethanesulfonate in total yield of 35%was synthesized from 2-(trimethylsilyl)phenol by formylation,esterification,nucleophilic addition of methyl Grignard reagent to carbonyl group and further oxidation of the resulting benzylic alcohol for the first time.The structure was confirmed by1H NMR and13C NMR.
2-(trimethylsilyl)phenol;2-acetyl-6-(trimethylsilyl)phenyl trifluoromethanesulfonate;3-acetyl aryne precursor;pactamycin;synthesis
O621.3
A
1005-1511(2014)03-0395-03
2013-03-18;
2014-03-13
国家自然科学基金资助项目(21202197)
孙银蕾(1986-),女,汉族,山东潍坊人,硕士研究生,主要从事有机合成方法学的研究。E-mail:syl200606@163.com
刘波,理学博士,副研究员,E-mail:liubo@ms.xjb.ac.cn
