虾青素预处理对体外氧化应激诱导内皮祖细胞凋亡的保护作用
2014-06-23龚志刚张再伟姜其钧丁世芳
龚志刚,张再伟,姜其钧,丁世芳
(1.南方医科大学研究生院,广东广州 510515;2.广州军区武汉总医院心内科,湖北武汉 430070;3.西安交通大学医学院第一附属医院心血管内科,陕西西安 710061)
虾青素预处理对体外氧化应激诱导内皮祖细胞凋亡的保护作用
龚志刚1,2,张再伟3,姜其钧2,丁世芳2
(1.南方医科大学研究生院,广东广州 510515;2.广州军区武汉总医院心内科,湖北武汉 430070;3.西安交通大学医学院第一附属医院心血管内科,陕西西安 710061)
目的探讨虾青素对体外氧化应激诱导的人外周血内皮祖细胞凋亡的影响及机制。方法体外培养人外周血单核细胞源的内皮祖细胞,分为正常对照组、模型组(叔丁基过氧化氢100μmol/L)、虾青素+叔丁基过氧化氢(虾青素0.1、1、10 nmol/L预处理24 h后,再加终浓度为100μmol/L的叔丁基过氧化氢溶液继续培养6 h)组。MTT法检测细胞存活率;DAPI染细胞检测细胞凋亡率;DCFH-DA法检测细胞内活性氧(reactive oxygen species,ROS)水平;比色法检测半胱氨酸天冬氨酸蛋白酶(Caspase-3)活性;JC-1法测定线粒体膜电位。结果与正常对照组比较,叔丁基过氧化氢(100μmol/L)能明显造成内皮祖细胞凋亡(P<0.05)。虾青素可降低叔丁基过氧化氢引起的内皮祖细胞凋亡,表现为细胞凋亡率减少(P<0.05),线粒体膜电位增加,Caspase3表达减弱。结论虾青素对叔丁基过氧化氢诱导的内皮祖细胞凋亡具有保护作用,其机制可能与保护线粒体功能有关。
氧化应激;内皮祖细胞;虾青素;细胞凋亡;线粒体膜电位
内皮祖细胞(endothelial progenitor cells,EPCs)是成人最重要的一组调节血管新生和形成血管内皮的祖细胞,其在外周循环血中的数量与功能是促进内皮修复,进行再内皮化,维持其完整的重要因素[1]。
近年来的研究表明,EPCs对氧化应激损伤敏感[2];临床观察也证实,冠心病的危险因素如吸烟、高氧化低密度脂蛋白血症、高血压、糖尿病,缺血再灌注损伤、经皮冠脉介入治疗损伤[3]。由此引起内皮祖细胞损伤和凋亡的,可能是患者外周血EPCs的数量及功能受损的直接原因。因此,增强EPCs抗氧化应激能力,降低凋亡的发生,改善其功能,可能是血管损伤后再内皮化治疗的新靶点[4]。
虾青素(astaxanthin,ASX)是雨生红球藻在受到环境胁迫时,细胞为抵御不良环境而形成的应激机制中的一种分子,对氧化应激引起的多种细胞,如人神经干细胞、脐静脉内皮细胞、肾小球系膜细胞、视网膜细胞等的凋亡具有显著保护作用[5-8]。但ASX对EPCs是否抗氧化应激损伤引起凋亡,目前尚未见报道。
本研究利用体外培养人外周血单核细胞源的EPCs,叔丁基过氧化氢(tert-butyl hydroperoxide,tBHP)干预EPCs制作氧化应激损伤模型,观察ASX对t BHP诱导EPCs凋亡的保护作用,探讨ASX对人EPCs的抗凋亡功能及可能机制,为深入研究ASX的心血管保护作用提供实验依据。
1 材料与方法
1.1 主要药物及试剂Histopaque1077淋巴细胞分离液(美国Amersham Biosciences公司);M199培养基、胎牛血清、细胞培养板(美国Gibico公司);胰酶(上海博光生物技术公司);硫氰酸荧光标记荆豆凝集
素I(FITC-UEA-I)、人纤维连接蛋白、ASX、tBHP、MTT(甲基噻唑蓝)(美国Sigma公司);乙酰化低密度脂蛋白(DiI-Ac-LDL)(美国Molecular Probe公司);重组人血管内皮生长因子(rh-VEGF165)、重组人碱性成纤维细胞生长因子(rh-b-FGF)(英国Pepro Tech公司);PE标记鼠抗人CD133单克隆抗体(德国Miltenyi Biotec公司);FITC标记鼠抗人CD34单克隆抗体(美国Southern Biotech公司);PE标记鼠抗人VEGF-R2单克隆抗体、Caspases活性检测试剂盒(美国R&D System公司);ROS检测试剂盒、线粒体膜电位检测试剂盒(JC-1)、DAPI Apoptosis Detection试剂盒购自碧云天生物技术研究所。
1.2 人内皮祖细胞的分离、培养、鉴定取健康志愿者外周血,以1∶2比例的PBS稀释后,缓慢移至Histopaque1077淋巴细胞分离液上方,400×g室温离心30 min,分离出中间单个核细胞层。将分离好的单核细胞用含有100 m L/L PBS、200 m L/L胎牛血清、rh-VEGF 10 ng/m L、rh-b-FGF 10 ng/m L的M199培养液稀释成5×106/m L,放置于37℃、50 m L/L CO2孵箱中培养;培养到第4天,用PBS洗掉非贴壁细胞,换培养液继续培养;取第7天的细胞,加入2.4 mg/L DiI-Ac-LDL和10 mg/L FITC-UEA-I于37℃孵育1h后,用荧光显微镜检测双染色阳性细胞百分比。另取第7天的细胞,用2.5 g/L胰蛋白酶消化,分别加入10 mg/L PE标记的VEGF-R2单克隆抗体、10 mg/L PE标记的CD133单克隆抗体、10 mg/L FITC标记的CD34抗体,4℃孵育30 min后,上流式细胞仪检测细胞表面标志物表达率。于第7天加入无血清的培养液同步化细胞24 h,进行后续实验。
1.3 人内皮祖细胞tBHP损伤模型的建立同步化后的EPCs用2.5 g/L胰酶消化,以1×103/孔的密度接种于96孔板,分别加入浓度为30、60、120、240 μmol/L的tBHP干预6 h,加入10μL MTT(5 g/L)在37℃孵育4 h后吸去上清,加入100μL二甲基亚砜,振荡10 min溶解结晶,酶标仪检测450 nm处的吸光度(A)值。根据细胞存活情况选择合适的tBHP作用浓度用于后续干预实验。细胞存活率(%)=(实验组A值/正常对照组A值)×100%
1.4 ASX对正常和损伤细胞存活率的影响待细胞长到铺满板底70%~80%时,加入终浓度分别为0.1、1、10 nmol/L的ASX溶液,于37℃孵育24 h后换为无血清MEM,再加终浓度为100μmol/L的tBHP溶液继续培养6 h后,MTT法检测细胞存活率。
1.5 细胞凋亡率的测定药物处理好的细胞除去培养基,用PBS洗2遍,binding buffer重悬并调整细胞数为1×106/m L,然后用40 g/L的多聚甲醛固定15 min,用DAPI(2.5μg/m L)染核20 min,在荧光显微镜下拍摄细胞图像观察细胞核形态。荧光显微镜下,活细胞核呈弥散均匀荧光,细胞凋亡时,细胞核或细胞质内可见浓染致密的颗粒块状荧光,核出现不同程度的固缩,可见DNA荧光碎片(凋亡小体)。分别选取5个视野,并计数100个细胞,计算细胞凋亡小体形成率(凋亡小体细胞数/总的细胞数×100%),取5次结果的平均值来评价细胞凋亡率。
1.6 Caspase-3活性的测定按Caspase-3 Colorimeric Assay Kit说明书进行。1×106细胞溶于50μL细胞溶解液后,加入2×反应缓冲液50μL和酶底物(DEVD-pNA)5μL,37℃孵育1 h,用酶标仪在405 nm波长下测吸光度(A)值。
1.7 细胞内ROS水平的测定采用DCFH-DA检测细胞内ROS水平。接种于96孔板,经药物处理后的各组EPCs,用10μmol/L DCFH-DA荧光探针的培养液于37℃细胞培养箱内孵育20 min,用无血清细胞培养液洗3次以去除探针,酶标仪检测DCF,激发波长488 nm,发射波长525 nm。DCF相对荧光强度(%)=处理组的荧光值/对照组的荧光值×100%。
1.8 细胞线粒体膜电位的测定采用JC-1法。接种于96孔板,经药物处理后的各组EPCs,除去培养基,PBS洗2遍,滴加100μL JC-1工作液,37℃、50 m L/L CO2孵箱中培养20 min,1×Incubation Buffer洗2遍,于荧光显微镜下观察。JC-1是一种阳离子脂质荧光染料,作为检测线粒体跨膜电位指示剂。JC-1有单体和多聚体两种存在状态,低浓度时以单体形式存在,高浓度时以多聚体形式存在,两者的发射光谱不同,JC-1可透过正常细胞膜以单体状态聚集胞内,正常细胞线粒体的膜电位(ΔΨ)具有极性,JC-1依赖于ΔΨ的极性被迅速摄入线粒体内,并因浓度增高而在线粒体内形成多聚体,多聚体发射光为红色荧光;而在线粒体膜通透性改变,线粒体膜电位去极化时,JC-1从线粒体内释放,红光强度减弱,以单体的形式存在于胞质内发绿色荧光。根据这一特征检测线粒体膜电位的变化。
1.9 统计学分析采用SPSS 13.0统计分析软件分析。所有数据用均数±标准差()表示,采用单因素方差分析(One way ANOVA)和LSD进行多样本间均值比较,采用Levene进行方差齐性检验,以P<0.05为差异具有统计学意义。
高校第二课堂是第一课堂的补充,它不受时间和空间的限制,具备多种形式,成为素质发展、创新意识培养和实践能力提升的重要载体,正是由于第二课堂教学的灵活性和新颖性,使其越来越受到高校的重视。
2 结 果
2.1 EPCs的形态与鉴定EPCs体外培养48 h后出现集落,4 d后多数集落已经形成,于第7天后加入DiI-Ac-LDL和FITC-UEA-I染色,其中90%细胞吞噬DiI-Ac-LDL(荧光显微镜下呈红色),FITC-UEA-I (荧光显微镜下呈绿色)染色阳性(图1)。采用PE标记的鼠抗人CD133、FITC标记的鼠抗人CD34以及PE标记的鼠抗人VEGF-R2抗体于流式细胞仪检测细胞表面标志,结果显示,CD133、CD34及VEGF-R2阳性率分别为(89.5±5.3)%、(66.3±6.3)%和(93.1± 8.3)%,证实所分离培养的细胞为EPCs。
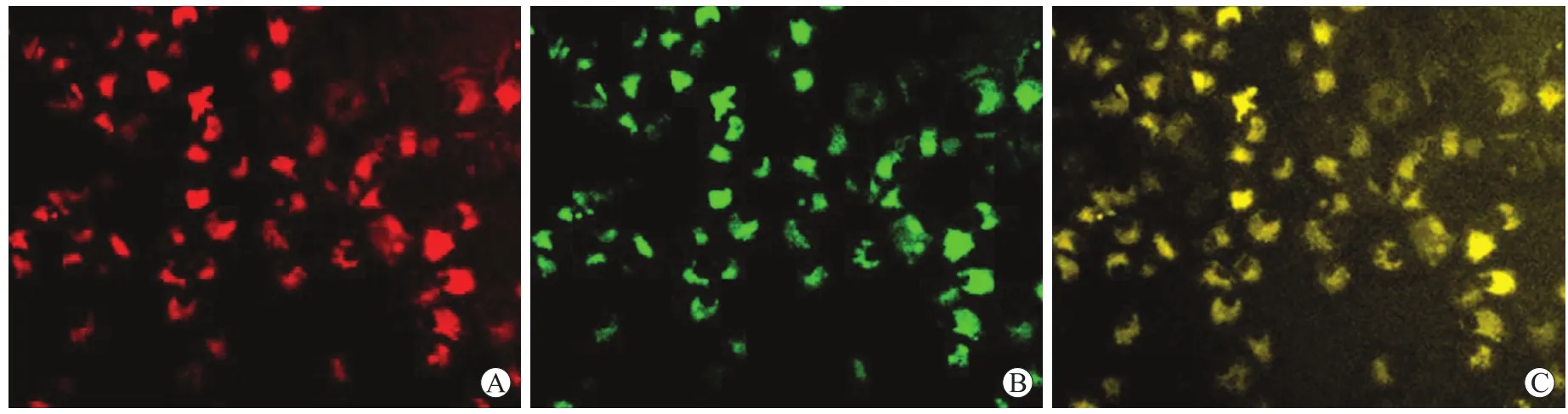
图1 EPCs的荧光染色鉴定Fig.1 Fluorescent staining of EPCs
2.2 tBHP损伤EPCs模型的建立MTT检测结果显示,不同浓度t BHP作用EPCs 6 h后,细胞存活率表现为随药物浓度增加而降低的剂量依赖关系。当tBHP浓度在30μmol/L时,细胞存活率为(83.61± 10.12)%,60μmol/L时为(65.11±8.86)%,120 μmol/L时为(34.72±13.22)%,至最大浓度240 μmol/L时,细胞大部分死亡,细胞存活率为(6.34± 4.66)%,其与对照组(100%)相比,差异有统计学意义(P<0.05)。当tBHP浓度为100μmol/L左右时,细胞存活率约维持在50%,后续实验选择该条件建立tBHP诱导EPCs的氧化损伤模型。
2.3 ASX对tBHP诱导的内皮祖细胞存活率下降的影响MTT结果显示,预实验中给予浓度0.1、1、10 nmol/L的ASX对EPCs的存活率没有影响。与损伤模型组相比较,各实验浓度的ASX呈剂量依赖性提高细胞存活率,当ASX的浓度达到10 nmol/L时,细胞存活率从47.6%升高至85.3%,显著提高EPCs存活率(P<0.05,图2)。
2.4 ASX对tBHP诱导EPCs凋亡的影响应用DAPI染细胞检测ASX对tBHP引起EPCs凋亡的影响。tBHP 100μmol/L处理EPCs 6 h后,细胞出现典型的凋亡核形态学改变。与对照组相比,细胞染色质浓缩,核固缩明显,凋亡小体数目显著增加,ASX预处理24 h后,可显著改善细胞凋亡状况,随着作用浓度的增加,作用逐步增强,在10 nmol/L ASX浓度时,改善最为显著。经过凋亡小体计算统计,正常对照组凋亡小体形成率为(4.8±0.7)%,100μmol/L t BHP损伤6 h组凋亡小体形成率(27.8±3.2)%,与正常对照组相比明显增多,差异有统计学意义(P<0.05,n=6),ASX在0.1、1、10 nmol/L预处理24 h后再加100μmol/L tBHP处理6 h,凋亡小体形成率分别为(20.4±2.9)%,(14.9±1.7)%和(7.8±0. 7)%(P<0.05,n=6),可见,ASX对tBHP诱导的细胞凋亡具有明显的保护作用(图3)。


图2 各组内皮祖细胞存活率的检测及观察Fig.2 EPCs viability test(,n=6)


图3 各组内皮祖细胞凋亡的检测Fig.3 EPCs apoptosis test(,n=6)
2.5 ASX对tBHP诱导EPCs caspase-3活性的影响应用紫外分光光度法进行检测,结果显示,与正常对照组相比,t BHP诱导EPCs Caspase-3活性显著升高(P<0.05);而经ASX预处理24 h后,Caspase-3活性出现逆转现象,随着剂量加大而下降(P<0.05),提示ASX可通过调节Caspase-3活性抑制tBHP诱导的EPCs细胞凋亡(表1)。
2.6 ASX对细胞内ROS的影响tBHP渗透进入细胞,迅速转化为叔丁氧基,并进而促进细胞内ROS的形成。DCHF-DA是检测细胞内ROS的分子探针,其本身无荧光,当它进入细胞与细胞内ROS结合时,产生一种荧光物质DCF,DCF的荧光强度反映了细胞内ROS水平。本实验结果显示,100μmol/L t BHP损伤组,EPC细胞内ROS水平显著增加;而经ASX(0.1、1、10 nmol/L)预处理组,EPCs细胞内ROS水平呈剂量依赖性降低,在10 nmol/L ASX浓度时,降低ROS水平最为显著,荧光强度较损伤模型组明显减弱(图4)。
表1 ASX对tBHP诱导EPCs Caspase-3活性的影响Tab.1 Effect of ASX on Caspase-3 activity of EPCs injured by tBHP(n=6,)

表1 ASX对tBHP诱导EPCs Caspase-3活性的影响Tab.1 Effect of ASX on Caspase-3 activity of EPCs injured by tBHP(n=6,)
与对照组比较,△P<0.05,与tBHP损伤模型组比较,*P<0.05。
组别Caspase-3活性(A405nm) 0.096±0.014 tBHP 0.345±0.018△0.1 nmol/L ASX+tBHP 0.291±0.013*1 nmol/L ASX+tBHP 0.209±0.004*10 nmol/L ASX+tBHP 0.169±0.013对照组*
2.7 EPCs线粒体膜电位的检测结果结果显示,正常对照组(Control)为黄绿色,100μmol/L tBHP处理6 h(tBHP+/ASX-),线粒体膜电位丢失,绿色荧光强度变强,而经10 nmol/L ASX预处理24 h后(tBHP+/ASX+),其线粒体膜电位丢失得以明显抑制,呈现黄绿素荧光,但较对照组黄绿色稍偏绿。说明ASX能抑制tBHP引起的EPCs线粒体膜电位去极化,从而提高线粒体膜电位水平,进而对线粒体膜电位丢失促发的EPCs凋亡具有一定的保护作用(图5)。

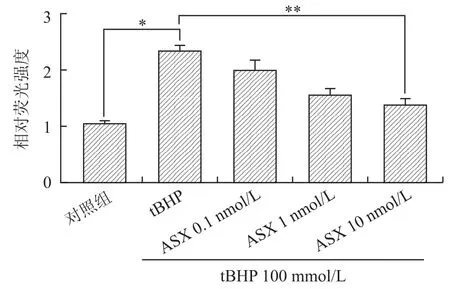
图4 ASX对细胞内ROS的影响Fig.4 Effects of ASX on intracellular ROS(,n=6)

图5 各组内皮祖细胞线粒体膜电位的检测Fig.5 Mitochondrial membrane potential of EPCs in each group
3 讨 论
ASX分子式:C4OH52O4,相对分子量596.86,是一种酮式类胡萝卜素,源自雨生红球藻类受到较长时间环境胁迫时,细胞内产生的一种抵御不良环境,具有多种生物活性的物质,其极高的抗氧化活性,可应对细胞内氧化应激造成的损伤,使细胞渡过难关[10]。tBHP是用于构建细胞氧化损伤的常用试剂,其化学性质与过氧化氢(H2O2)相似,但更稳定,不易降解。tBHP能模拟氧化应激损伤,直接破坏膜结构,最终导致细胞或线粒体膜的破坏[11]。
细胞凋亡是多基因、多种分子参与的复杂生命过程。研究发现,Caspase-3是细胞凋亡发生和调控机制中的重要分子,是凋亡途径下游进行底物酶解的关键蛋白酶,Caspase-3的激活是凋亡发生的最早期事件,它对染色质固缩、DNA片段化起重要的执行作用[12]。本研究通过DAPI检测发现,tBHP可明显的引起内皮祖细胞的凋亡,单纯ASX对内皮祖细胞无损伤作用,ASX对tBHP诱导的内皮祖细胞凋亡具有明显的保护作用。在ASX抑制EPCs的凋亡中发现ASX对Caspase-3的活性有下调效应,在10 nmol/L水平能显著抑制其激活。
线粒体是最重要的细胞凋亡调控靶点,同时,线粒体还是ROS的主要来源,并易受氧化应激损伤。研究表明,胞质内ROS可作为信号诱导线粒体通透转换孔(mitochondrial permeability transition pore,MPTP)的开放、Ca2+内流和线粒体电子传递链解偶联,同时促进自身线粒体及其他线粒体产生ROS,ROS升高又进一步诱导MPTP开放,两者互为因果,形成恶性循环[13]。线粒体膜电位(mitochondrial membrane potential,MMP)下降是MPTP开放的表征,MMP下降,氧化磷酸化解偶联,线粒体基质肿胀,外膜破裂,导致各种凋亡因子包括最重要的细胞色素C释放于胞质中,启动细胞线粒体途径凋亡级联反应,激活Caspase-3,从而使细胞发生凋亡。本实验发现,tBHP损伤组细胞内ROS显著增加,线粒体膜电位明显低于空白对照组,而ASX保护组的细胞内ROS水平下降,线粒体膜电位较损伤组有明显的提高。可见,tBHP增加细胞内ROS,降低EPCs线粒体膜电位,启动了线粒体途径细胞凋亡,而ASX能明显减少ROS生成,提高EPCs线粒体膜电位,抑制tBHP诱导的线粒体途径细胞凋亡。
综上所述,本研究结果显示,ASX通过提高线粒体膜电位,抑制细胞内ROS生成造成的线粒体氧化应激损伤,可能进而下调Caspase-3活性,最终起到抗EPCs凋亡的功能。本研究为ASX抗氧化应激损伤,改善EPCs数量和功能,促进损伤血管再内皮化提供了实验依据。
[1]WERNER N,KOSIOL S,SCHIEGL T,et al.Circulating endothelial progenitor cells and cardiovascular outcomes[J].N Engl J Med,2005,353(10):999-1007.
[2]INGRAM DA,KRIER TR,MEAD LE,et al.Clonogenic endothelial progenitor cells are sensitive to oxidative stress[J].Stem Cells,2007,25(2):297-304.
[3]TURGEON J,DUSSAULT S,HADDAD P,et al.Probucol and antioxidant vitamins rescue ischemia-induced neovascularization in mice exposed to cigarette smoke:Potential role of endothelial progenitor cells[J].Atherosclerosis,2010,208(2):342-349.
[4]IMANISHI T,TSUJIOKA H,AKASAKA T.Endothelial progenitor cells dysfunction and senescence:contribution to oxidative stress[J].Curr Cardiol Rev,2008,4(4):275-286.
[5]KIM JH,CHOI W,LEE JH,et al.Astaxanthin inhibits H2O2-mediated apoptotic cell death in mouse neural progenitor cells via modulation of P38 and MEK signaling pathways[J].J Microbiol Biotechnol,2009,19(11):1355-1363.
[6]ADLURI RS,THIRUNAVUKKARASU M,ZHAN L.et al. Cardioprotective efficacy of a novel antioxidant mix vitae proagainst ex vivo myocardial ischemia-reperfusion injury[J].Cell Biochem Biophys,2013,67(2):281-286.
[7]MANABE E,HANDA O,NAITO Y,et al.Astaxanthin protects mesangial cells from hyperglycemia-induced oxidative signaling[J].J Cell Biochem,2008,103(6):1925-1937.
[8]DONG LY,JIN J,LU G,et al.Astaxanthin attenuates the apoptosis of retinal ganglion cells in db/db mice by inhibition of oxidative stress[J].Mar Drugs,2013,11(3):960-974.
[9]DERNBACH E,URBICH C,BRANDES RP,et al.Antioxidativstress-associated genes in circulating progenitor cells:evidence for enhanced resistance against oxidative stress[J]. Blood,2004,104(12):3591-3597.
[10]PASHKOW F,WATUMULL D,CAMPBELL C.Astaxanthin:a novel potential treatment for oxidative stress and inflammation in cardiovascular disease[J].Am J Cardiol,2008,101(10A):58-68.
[11]HAIDARAK,MOREL I,ABALEA V.Mechanism of tertbutylhydroperoxide induced apoptosis in rat hepatocytes:involvement of mitochondria and endoplasmic reticulum[J].Biochim Biophys Acta,2002,1542(1-3):173-85.
[12]CASE J,INGRAM DA,HANELINE LS,et al.Oxidative stress impairs endothelial progenitor cell function[J].Antioxid Redox Signal,2008,10(11):1895-1907.
[13]DAI DF,CHEN T,SZETO H,et al.Mitochondrial targeted antioxidant peptide ameliorates hypertensive cardiomyopathy[J].J Am Coll Cardiol,2011,58(1):73-82.
(编辑 卓选鹏)
Astaxanthin attenuates endothelial progenitor cell apoptosis induced by oxidative stress via mitochondria-targeted protective mechanism
GONG Zhi-gang1,2,Zhang Zai-wei3,JIANG Qi-jun2,DING Shi-fang2
(1.Graduate School,Southern Medical University,Guangzhou 510515;2.Department of Cardiology,Wuhan General Hospital of Guangzhou Command,Wuhan 430070;3.Department of Cardiovascular Medicine,the First Affiliated Hospital,Medical School of Xi'an Jiaotong University,Xi'an 710061,China)
ObjectiveTo investigate the effects of astaxanthin on oxidative stress-induced apoptosis of endothelial progenitor cells(EPCs)in vitro and to explore its underlying mechanisms.MethodsEPCs cultured in vitro were divided into normal control group,model group(100μmol/L tBHP),and astaxanthin plus tBHP(pretreated with 0.1,1,10 nmol/L astaxanthin for 24 h and then cultured with 100μmol/L tBHP for 6 h).The cell viability was measured by MTT method;the level of reactive oxygen species(ROS)was determined by DCFH-DA method;the changes of mitochondrial membrane potential(MMP)and apoptosis ratio were detected by JC-1 method and DAPI method,respectively.Caspase 3 was assayed by colorimetry.ResultsCompared with normal control group,100μmol/L tBHP obviously caused the apoptosis of EPCs(P<0.05),while astaxanthin could reduce this damage,which was presented by the significantly decreased cell apoptosis ratio(P<0.05),increased MMP and downregulated Caspase-3 expression.ConclusionAstaxanthin inhibits oxidative stress-induced apoptosis of EPCs,and its mechanisms may be related to protecting the mitochondrial function.
oxidative stress;endothelial progenitor cell;astaxanthin;cell apoptosis;mitochondrial membrane potential
R285
A
1671-8259(2014)05-0599-06
10.7652/jdyxb201405007
2014-01-05
2014-03-20
湖北省自然科学基金资助项目(No.2012FFB06803) Supported by the Natural Science Foundation of Hubei Province(No.2012FFB06803)
丁世芳,主任医师,教授.研究方向:心血管内科临床与基础研究.E-mail:dingshifangmd@yahoo.com.cn
龚志刚(1971-),男(汉族),副主任医师,博士研究生.研究方向:心血管内科临床研究.E-mail:13397199595@189.cn;张再伟(1970-),男(汉族),医学博士,副主任医师.研究方向:心血管内科疾病.E-mail:zhzw2001@stu.xjtu.edu.cn,共同第一作者.
时间:2014-05-16 16∶03 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140524.2118.004.html
