水产食品中组胺的丹磺酰氯柱前衍生反相高效液相色谱测定方法的建立及应用
2014-06-21胡家伟曹敏杰蔡秋凤张凌晶苏文金刘光明
胡家伟,高 榕,曹敏杰,蔡秋凤,张凌晶,苏文金,刘光明,*
(1.集美大学生物工程学院,福建 厦门 361021;2.杏林出入境检验检疫局,福建 厦门 361022)
组胺是一种重要的生物活性物质,在体内可以发生多种生理反应[1]。它不仅是炎症反应和免疫损伤的重要介质之一,而且对应答炎症反应有着重要的调节作用[2]。但是当人体摄入过量组胺时,会引起组胺中毒。其症状主要包括口腔麻木、头晕、心悸、血压下降、吞咽困难和口渴等,同时伴有荨麻疹、皮疹和面部肿大等过敏反应,严重者甚至危及生命[3]。组胺中毒事件多发生在一些游离组氨酸含量丰富的鲭科鱼类中,如金枪鱼、鲭鱼、鲐鱼等,因为此类中上层鱼类死后若不加以合理控制,极易产组胺[4]。因此各国都制定了水产品中组胺的限量标准,美国食品药品监督管理局(Food and Drug Adiministration,FDA)要求进口水产品的组胺含量不得超过50 mg/kg[5]。欧盟规定鲭科鱼类中的组胺含量不得超过100 mg/kg[6]。而我国规定鲐鱼中组胺不得超过1 000 mg/kg,其他海水鱼中不得超过300 mg/kg[7]。我国鱼类资源丰富,水产品在国民经济和消费中都占有重要地位。但是,每年都会有因组胺含量超标而导致水产食品被禁止出口的事件,使企业蒙受了巨大损失,给水产品出口贸易带来很大影响。因此,监测水产食品中组胺的水平,控制水产品中组胺的形成对于保障水产食品的质量安全具有重要意义。
目前,水产品中组胺的检测方法主要有比色法[8-9]、薄层色谱法[10-11]、酶联免疫吸附法[12-13]、生物传感器法[14-15]、毛细管电泳法[16-17]和高效液相色谱法等[18-21]。其中高效液相色谱法具有检测灵敏度高、线性关系良好、分析定量准确等优点,是目前水产品组胺含量分析测定的主要手段。由于组胺既没有紫外发色基团也没有荧光发色基团,因此在检测前一般要先对组胺进行衍生化处理。丹磺酰氯(dansyl chloride,Dns-Cl)作为液相色谱柱前衍生试剂具有衍生操作简单、衍生物稳定性好、可定量完成磺酰化反应、有较强的荧光和紫外吸收、灵敏度高、反应范围宽、基体干扰不明显等优点[22]。本研究以Dns-Cl作为组胺的柱前衍生剂,采用反相高效液相色谱对组胺进行定量分析,优化了组胺的最适衍生条件和色谱条件,建立了快速检测水产食品中组胺的方法,与国内其他学者的高效液相色谱法[18-20]相比较,该方法具有衍生反应时间短、组胺检出时间早等优点,缩短了样品的前处理时间和检测时间,提高了检测效率。此外,还研究了鲣鱼、鲭鱼和蓝圆鲹在不同贮藏温度条件下组胺的变化情况,以探索控制水产品中组胺的方法。
1 材料与方法
1.1 材料与试剂
鲣鱼、鲭鱼、秋刀鱼、蓝圆鲹、大黄鱼、鳗鱼、鲤鱼、罗非鱼、南美白对虾、克氏原螯虾、拟穴青蟹、梭子蟹、菲律宾蛤仔、杂色鲍、章鱼和鱿鱼16 种水产品厦门集美菜市场和厦门第八农贸市场;鱼露、鱼酱、淡水鱼糜、盐渍巴浪鱼、盐渍银鱼、石斑鱼鱼片、鳕鱼鱼片、鳗鱼鱼片、桂花鱼鱼片、小黄鱼鱼片、红娘鱼鱼片、鲭鱼罐头、鲮鱼罐头、凤尾鱼罐头、沙丁鱼罐头、小银鱼罐头、马面鱼罐头、红娘鱼罐头和蟹肉罐头19种水产加工食品 厦门集美新华都超市和厦门集美永辉超市;冷冻鲣鱼、鲭鱼和蓝圆鲹由福建省石狮市瑞兴冷冻食品有限公司提供,实验前一直储存于-30 ℃冰箱。
组胺二盐酸盐(CAS号:56-92-8,纯度99%) 比利时Acros Organics公司;丹磺酰氯(纯度99%) 美国Sigma公司;丙酮(色谱纯) 上海化学试剂研究所;三氯乙酸(分析纯) 西陇化工股份有限公司;氢氧化钠(分析纯) 广东光华化学厂有限公司;乙腈(色谱纯) 美国Fisher Scientific公司;实验用水由Millipore Milli-Q Academic超纯水系统制备。
1.2 仪器与设备
1260高效液相色谱仪(配有G1311C四元泵、G1329B自动进样器、G1316A柱温箱、G1314F紫外检测器(variable wavelength detector,VWD)和B.04.03液相化学工作站) 美国Agilent公司;高速冷冻离心机 德国Sigma公司;组织捣碎机 瑞士Kinematica公司;恒温水浴锅 德国Memmert公司。
1.3 方法
1.3.1 组胺标准溶液的配制和衍生
准确称取组胺二盐酸盐标准品0.5 g于50 mL容量瓶中,用超纯水定容至刻度,配制成质量浓度为10 mg/mL的组胺标准储备液,避光,4 ℃保存。吸取1 mL组胺标准储备液于10 mL容量瓶中,用超纯水稀释,采用逐级稀释法分别得到质量浓度为1、5、10、20、50、100、200、500 μg/mL的组胺标准溶液,现配现用。
取300 μL组胺标准溶液于2 mL的离心管中,加入40 μL 0.1 mol/L氢氧化钠溶液,再加入600 μL 10 mg/mL Dns-Cl溶液,盖塞混匀后,置于40 ℃恒温水浴锅内反应20 min。加入100 μL氨水,混匀,静置30 min。用乙腈定容至1.5 mL,振荡混匀后,过0.22 μm的有机相针式滤器后待测。
1.3.2 样品的提取和衍生
准确称取5.0 g样品于50 mL离心管中,加入15 mL 5%三氯乙酸捣碎匀浆,4℃、6 000×g离心15 min,上层清液移入25 mL棕色容量瓶中。沉淀物再加10 mL 5%三氯乙酸按照上述操作重复提取1 次,上清液合并于容量瓶中,5%三氯乙酸定容至刻度,过0.22 μm的水相针式滤器。
取300 μL样品提取液于2 mL的离心管中,加入40 μL 2 mol/L氢氧化钠溶液,调pH值至9.5左右,再加入600 μL 10 mg/mL Dns-Cl溶液,盖塞混匀后,置于40 ℃恒温水浴锅内反应20 min。反应完毕后,加入100 μL氨水,混匀,静置30 min。乙腈定容至1.5 mL,振荡混匀后,4 ℃、10 000 r/min离心5 min,上清液过0.22 μm的有机相针式滤器后待测。
1.3.3 色谱条件
色谱柱:Agilent ZORBAX Extend-C18色谱柱(50 mm×4.6 mm,5 m);流动相:乙腈-水(70∶30,V/V);流速:1 mL/min;柱温:35 ℃;进样量:20 L;紫外检测波长:254 nm。
2 结果与分析
2.1 组胺衍生条件的确定
2.1.1 Dns-Cl质量浓度的确定
Dns-Cl的用量是影响衍生反应的重要因素,为了选择一个合适的Dns-Cl质量浓度,本实验测定了300 μL 100 μg/mL的组胺标准溶液添加600 μL质量浓度分别为1、3、5、8、10 mg/mL的Dns-Cl溶液衍生反应的完全程度。每个质量浓度点做3次平行取测量值的平均值。分析Dns-Cl质量浓度对组胺衍生物峰面积的影响,结果如图1所示,组胺衍生物的生成量随着Dns-Cl质量浓度的增大而增加,当Dns-Cl质量浓度达到10 mg/mL时,组胺与Dns-Cl完全反应,组胺衍生物的生成量基本趋于稳定。因此,为了保证衍生反应的彻底完成,选用10 mg/mL的Dns-Cl作为衍生剂。

图 1 Dns-Cl质量浓度对组胺衍生物峰面积的影响Fig.1 Effect of dansyl chloride concentrations on peak area of histamine derivative
2.1.2 衍生反应pH值的确定
组胺和Dns-Cl在碱性条件下才能发生反应,因此选择用0.1 mol/L的氢氧化钠溶液将反应体系的pH值分别调至8.0、8.5、9.0、9.5和10.0,每个pH值点做3 次平行取测量值的平均值。分析衍生反应pH值对组胺衍生物峰面积的影响,结果如图2所示,组胺衍生物的生成量随着pH值的增大逐渐增加,pH为9.5时,组胺衍生物的生成量最大,此时0.1 mol/L氢氧化钠溶液的添加量为40 μL。当pH值继续增大至10.0时,组胺衍生物的生成量下降,因此衍生反应的最适pH 9.5。

图 2 衍生反应pH值对组胺衍生物峰面积的影响Fig.2 Effect of derivative reaction pH on peak area of histamine derivative
2.1.3 衍生反应温度的确定
将反应体系分别在30、40、50、60 ℃和70 ℃条件下反应30 min。每个温度点做3 次平行取测量值的平均值。分析衍生反应温度对组胺衍生物峰面积的影响,结果如图3所示,组胺衍生物的生成量随着温度的增加呈现先上升后下降的趋势,反应温度为40 ℃时,组胺衍生物的生成量最大。因此衍生反应的最适反应温度为40 ℃。

图 3 衍生反应温度对组胺衍生物峰面积的影响Fig.3 Effect of derivative reaction temperature on peak area of histamine derivative
2.1.4 衍生反应时间的确定

图 4 衍生反应时间对组胺衍生物峰面的影响Fig.4 Effect of derivative reaction time on peak area of histamine derivative
将反应体系在40 ℃条件下分别反应10、20、30、40、50、60 min。每个时间点做3 次平行取测量值的平均值。分析衍生反应时间对组胺衍生物峰面积的影响,结果如图4所示,反应时间增加至20 min时,组胺衍生物的生成量最大。之后随着反应时间的继续延长,组胺衍生物的生成量逐渐减少,因此衍生反应的最适反应时间为20 min。而邢丽红等[18]研究的高效液相色谱紫外检测法组胺的衍生反应时间需要60 min。
以上结果表明,衍生反应的最适条件为Dns-Cl质量浓度10 mg/mL、衍生反应pH 9.5、温度40 ℃、反应时间20 min。
2.2 色谱图与标准曲线
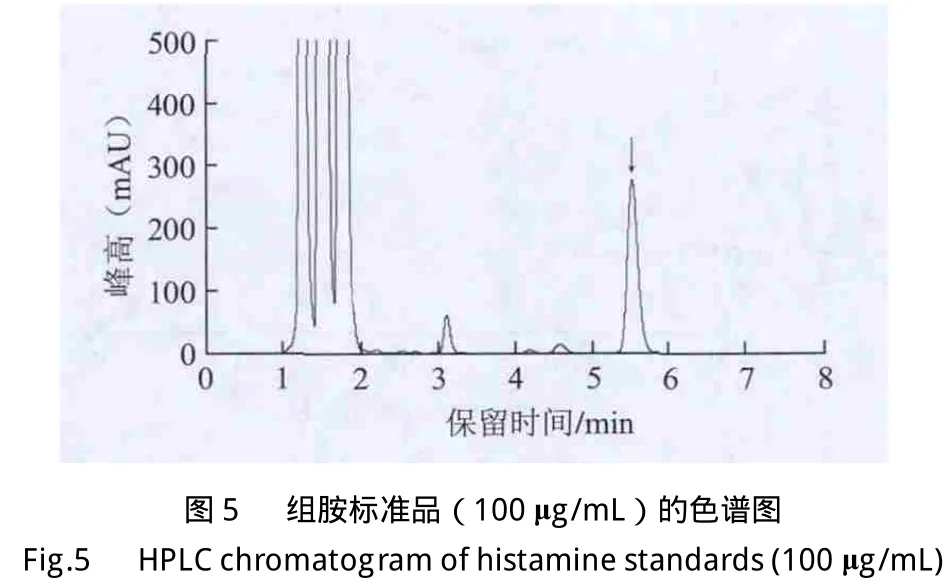
依据本实验建立的最适衍生条件和色谱条件,组胺的保留时间在5.5 min左右,且峰形良好,表明该方法快速准确。与肖琴等[19]的高效液相色谱法相比,组胺的保留时间由21.5 min提前至5.5 min,提高了检测效率。100 μg/mL组胺标准品的色谱图见图5。分别配制质量浓度为1、5、10、20、50、100、200、500 μg/mL的组胺标准溶液按1.3.1节中的衍生方法和1.3.3节中的色谱条件进行测定,以组胺衍生物色谱峰面积(y)为纵坐标,以相应的组胺质量浓度(x)为横坐标,绘制标准曲线。组胺标准溶液在1~500 μg/mL范围内,峰面积与质量浓度的线性关系良好,其线性回归方程为y=32.166x-5.496 5,R2=0.999 9。
2.3 精密度、检出限和定量限的确定
对10 μg/mL的组胺标准溶液连续进样10 次,组胺的保留时间稳定且峰面积的相对标准偏差为0.19%,小于3%,说明仪器精密度良好。将组胺标准溶液稀释成不同的低浓度溶液,通过测定信噪比(RSN)来确定检出限(RSN=3)和定量限(RSN=10)。结果发现,组胺标准溶液质量浓度为0.5 μg/mL时,RSN=3,组胺标准溶液质量浓度为1.0 μg/mL时,RSN=10。因此,仪器的检出限为0.5 μg/mL,定量限为1.0 μg/mL。
2.4 样品的检测
采用该方法测定了16 种水产品和19 种水产加工食品中的组胺,每种样品做3 次平行取测量值的平均值。由表1可见,鲣鱼、鲭鱼、秋刀鱼和蓝圆鲹等青皮红肉鱼均有检出组胺,而其他白肉鱼(大黄鱼、鳗鱼、鲤鱼和罗非鱼)以及甲壳类(南美白对虾、克氏原螯虾、拟穴青蟹和梭子蟹),贝类(菲律宾蛤仔和杂色鲍)和软体动物(章鱼和鱿鱼)等均未检出,说明组胺的分布同水产品种有密切的联系。通常组氨酸是组胺产生的前体物质,而组氨酸以咪唑二肽的形式存在于水产品中,游离的组氨酸与咪唑二肽是支撑水产品活泼运动时的缓冲物质。对于游泳能力强的鱼类,其肌肉中组氨酸与咪唑二肽含量较多,所以这些水产品腐败时可能会产生大量的组胺。然而,贝类、乌贼、章鱼、虾、蟹类动物的运动能力相对较弱,其肌肉中几乎没有游离组氨酸和咪唑二肽[23],所以几乎不会产生组胺。

n=3)=3 Table 1 Histamine contents in aquatic products samples (表 1 不同水产品中组胺的含量(Table 1 Histamine contents in aquatic products samples (n = 3) = 3)mg/kg样品名称 组胺含量 样品名称 组胺含量鲣鱼 4.72±0.81 南美白对虾 ND鲭鱼 10.52±0.56 克氏原螯虾 ND秋刀鱼 23.25±0.95 拟穴青蟹 ND蓝圆鲹 9.30±0.64 梭子蟹 ND大黄鱼 ND 菲律宾蛤仔 ND鳗鱼 ND 杂色鲍 ND鲤鱼 ND 章鱼 ND罗非鱼 ND 鱿鱼 ND注:含量为“平均值±标准偏差”;ND.未检出(组胺含量低于0.5 mg/kg)。下同。表 2 不同水产加工食品中组胺的含量(n=3)=3 Table 2 Histamine contents in processed aquatic products samples (Table 2 Histamine contents in processed aquatic products samples (n n = 3)= 3)mg/kg样品名称 组胺含量 样品名称 组胺含量鱼露 682.22±10.90 红娘鱼鱼片 ND鱼酱 241.04±8.27 鲭鱼罐头 116.55±2.32淡水鱼糜 ND 鲮鱼罐头 ND盐渍巴浪鱼 31.46±0.69 凤尾鱼罐头 4.12±0.20盐渍银鱼 ND 沙丁鱼罐头 48.36±0.62石斑鱼鱼片 ND 小银鱼罐头 37.00±3.12鳕鱼鱼片 44.07±0.52 马面鱼罐头 11.69±1.21鳗鱼鱼片 ND 红娘鱼罐头 17.87±1.44桂花鱼鱼片 ND 蟹肉罐头 ND小黄鱼鱼片 ND
由表2可见,鱼露、鱼酱等发酵食品中的组胺很高,含量为682.22、241.04 mg/kg,严重超出了美国FDA的限量标准[5]。鱼罐头也几乎全部都有组胺检出,含量在4.12~116.55 mg/kg之间,其中鲭鱼罐头中组胺含量达116.55 mg/kg,也超出了美国FDA的限量标准[5]。而鱼片食品仅有盐渍巴浪鱼和鳕鱼鱼片有组胺检出。说明水产加工食品中发酵食品由于有利于微生物的生长最容易产生组胺,其次是罐头食品,而鱼片食品由于水分含量低不利于微生物的生长,因此组胺较低。
2.5 样品的组胺加标回收率
选择拟穴青蟹、梭子蟹、鱼露和沙丁鱼罐头4 种样品为研究对象,分别添加一定量的组胺标准溶液(20、50、100 mg/kg),每个加标水平平行测定3 次,计算不同加标水平的回收率和平均回收率,结果见表3。样品添加不同质量浓度的组胺,平均回收率在89.54%~101.92%,说明该方法准确性较高。

表 3 4 种样品的组胺加标回收率Table 3 Recoveries of histamine from 4 spiked samples Table 3 Recoveries of histamine from 4 spiked samples%样品名称 添加量/(mg/kg) 平均回收率(n=9) RSD(n=9)20 50 100拟穴青蟹 96.69±1.97 98.70±0.84 94.96±1.75 96.78 1.87梭子蟹 93.93±0.99 84.01±0.77 90.69±0.27 89.54 5.65鱼露 99.43±0.85 99.68±0.97 101.67±0.46 100.26 1.23沙丁鱼罐头 104.41±0.76 99.74±0.53 101.61±0.69 101.92 2.30
2.6 不同贮藏温度条件下组胺的变化情况
2.6.1 鲣鱼、鲭鱼和蓝圆鲹在25 ℃贮藏条件下的组胺变化情况
分别将冷冻鲣鱼、鲭鱼和蓝圆鲹解冻后取肉,放置于25 ℃贮藏48 h,每隔6 h测定1 次组胺含量,每个时间点做3 次平行取平均值,结果如图6所示,前12 h 3 种鱼中的组胺含量变化都很小,12 h以后鲭鱼中的组胺含量呈指数型增长,到24 h时组胺含量已经达到3 097.62 mg/kg,之后趋于稳定。18 h以后鲣鱼和蓝圆鲹中的组胺含量开始呈指数型增长,42 h时鲣鱼和蓝圆鲹中的组胺含量分别达到了7 902.70 mg/kg和2 487.88 mg/kg,之后趋于稳定。当25 ℃贮藏48 h后,鲣鱼、鲭鱼和蓝圆鲹中的组胺含量分别达到了8 484.82、3 760.35 mg/kg和2 531.29 mg/kg,这可能是由于在25 ℃贮藏时,产组胺菌在鱼肉中迅速生长繁殖,产生大量组胺。

2.6.2 鲣鱼、鲭鱼和蓝圆鲹在4 ℃贮藏条件下的组胺变化情况

分别将冷冻鲣鱼、鲭鱼和蓝圆鲹解冻后取肉,放置于4 ℃条件下贮藏1 周,每隔1 d测定一次组胺含量,每个时间点做3 次平行取平均值,结果如图7所示,随着时间的延长,3 种鱼中的组胺含量逐渐增加,但相比25 ℃贮藏增加幅度不明显,贮藏1 周后,鲣鱼、鲭鱼和蓝圆鲹中的组胺含量分别达到了88.66、79.24 mg/kg和61.00 mg/kg,均低于100 mg/kg,说明4 ℃贮藏能够较好的控制鱼肉中组胺的增加。
2.6.3 鲣鱼、鲭鱼和蓝圆鲹在-30 ℃贮藏条件下的组胺变化情况
分别将冷冻鲣鱼、鲭鱼和蓝圆鲹解冻后取肉,在-30 ℃贮藏7、14、21 d和28 d后的组胺含量,结果发现样品中组胺均未检出。结合3 种鱼在25 ℃和4 ℃贮藏的结果可以发现,温度越高越有利于组胺的产生,低温贮藏则可以有效抑制组胺的产生。
3 结 论
本实验采用Dns-Cl柱前衍生反相液相色谱法测定水产食品中的组胺,与我国出入境检验检疫行业标准[24]相比,样品的衍生时间由45 min缩减至20 min,组胺的保留时间由14.2 min提前至5.5 min,定量限由10 μg/mL降低至1.0 μg/mL。由此可见该方法缩短了样品的衍生时间和检测时间,提高了检测效率和灵敏度,表明其快速准确、灵敏度高、重复性好,适用于水产食品中组胺的测定。
采用该方法测定了不同水产品和水产加工食品中的组胺,结果显示受检样品的组胺含量在0~682.22 mg/kg之间,其中鱼露、鱼酱和鲭鱼罐头均超过了美国FDA规定的限量标准[5],且大部分鱼类罐头食品均有组胺检出,说明我国水产食品质量安全存在一定的风险。进一步运用该方法监测了鲣鱼、鲭鱼和蓝圆鲹贮藏在不同温度下的组胺变化情况。结果发现,25 ℃贮藏48 h后3 种鱼的组胺都超过了2 000 mg/kg,4 ℃贮藏1 周后3 种鱼的组胺均在100 mg/kg以下,而-30 ℃贮藏样品中组胺则均未检出。这与文献[25]报道的蓝圆鲹在不同贮藏温度条件下组胺的变化规律相一致,说明温度越高越有利于组胺的产生,低温贮藏可有效抑制组胺产生。
[1]SMOLINSKA S, JUTEL M, CRAMERI R, et al. Histamine and gut mucosal immune regulation[J]. Allergy, 2014, 69(3): 273-281.
[2]何韶衡, 刘志刚, 林小平. 基础过敏反应学[M]. 北京: 科学出版社,2009: 838-839.
[3]HUNGERFORD J M. Scombroid poisoning: a review[J]. Toxicon,2010, 56(2): 231-243.
[4]STRATTA P, BADINO G. Scombroid poisoning[J]. Canadian Medical Association Journal, 2012, 184(6): 674-674.
[5]FDA (Food and Drug Administration, USA). Decomposition and histamine: raw frozen tuna and mahi-mahi; Canned tuna; and Related species;availability of revised compliance policy guide[S]. FDA:Federal Registration, 1995, 149: 39754-39756.
[6]European Commission (EC). Commision recommendation of 10 January 2003 concerning a coordinated programme for the official control of foodstuffs for 2003[S]. Official Journal of the European Commission, 2003.
[7]卫生部. GB 2733—2005 鲜、冻动物性水产品卫生标准[S]. 北京:中国标准出版社, 2005.
[8]郝宏兰. 水产品中组胺的测定方法研究[J]. 食品科学, 2000, 21(8):46-48.
[9]PATANGE S B, MUKUNDAN M K, ASHOK K K. A simple and rapid method for colorimetric determination of histamine in fish flesh[J]. Food C ontrol, 2005, 16(5): 465-472.
[10]SHAKILA R J, VASUNDHARA T S, KUMUDAVALLY K V.A comparison of the TLC-densitometry and HPLC method for the determination of biogenic amines in fish and fishery products[J]. Food Chemistry, 2001, 75(2): 255-259.
[11]TAO Zhihua, SATO M, HAN Yali, et al. A simple and rapid method for histamine anal ysis in fish and fishery products by TLC determination[J]. Food Control, 2011, 22(8): 1154-1157.
[12]郑海松, 杨小娇. 进出口食品中组胺的ELISA快速测定[J]. 食品工业, 2011, 32(10): 110-112.
[13]麻丽丹, 巴中华. 酶联免疫吸附试验法检测盐渍鳀鱼中的组胺[J].中国酿造, 2008, 27(14): 85-86.
[14]KEOW C M, ABU B F, SALLEH A B, et al. An amperometric biosensor for the rapid assessment of histamine level in tiger prawn(Penaeus monodon) spoilage[J]. Food Chemistry, 2007, 105(4):1636-1641.
[15]PEREZ S, BARTROLI J, FABREGAS E. Amperometric biosensor for the determination of histamine in fish samples[J]. Food Chemistry,2013, 141(4): 4066-4072.
[16]VITALI L, VALESE A C, AZEVEDO M S, et al. Development of a fast and selective separation method to determine histamine in tuna fish samples using capillary zone electrophoresis[J]. Talanta, 2013,106: 181-185.
[17]ROSSANO R, MAST RANGELO L, UNGARO N, et al. Influence of storage temperature and freezing time on histamine level in the European anchovy Engraulis encrasicholus (L., 1758): a study by capillary electrophoresis[J]. Journal o f Chromatography B, 2006,830(1): 161-164.
[18]邢丽红, 冷凯良, 孙伟红, 等. 高效液相色谱-紫外检测法测定水产品中组胺的含量[J]. 安徽农业科学, 2011, 39(13): 7832-7834.
[19]肖琴, 王充, 郑琳, 等. 高效液相色谱法测定发酵食品中组胺的含量[J].粮油食品科技, 2012, 20(2): 31-33.
[20]翟红蕾, 杨贤庆, 郝淑贤, 等. 生物胺高效液相色谱法测定条件的选择与优化[J]. 食品科学, 2011, 32(18): 180-184.
[21]TAHMOUZI S, KHAKSAR R, GHASEMLOU M. Development and validation of an HPLC-FLD method for rapid determination of histamine in skipjack tuna fish (Katsuwonus pelamis)[J]. Food Chemistry, 2011, 126(2): 756-761.
[22]LEGUA C M, FALCO P C, CABEZA A S, et al. Urine polyamines determination using dansyl chloride derivatization in solid-phase extraction cartridges and HPLC[J]. Analyst, 1999, 124(4): 477-482.
[23]鸿巢章二, 桥本周久. 水产利用化学[M]. 北京: 中国农业出版社,1994: 111-113.
[24]上海出入境检验检疫局. SN/T 2209—2008 进出口水产品中有毒生物胺的检测方法: 高效液相色谱法[S]. 北京: 中国标准出版社, 2008.
[25]HU Yue, HUANG Zhiyong, LI jian, et al. Co ncentrations of biogenic amines in fish, squid and octopus and their changes dur ing storge[J].Food Chemistry, 2012, 135(4): 2604-2611.
