用气相色谱-质谱联用比较牛耳草代谢物的提取方法
2014-06-19张晓飞段礼新龚月桦邓馨
张晓飞,段礼新,龚月桦,邓馨
1 西北农林科技大学生命科学学院,陕西 杨凌 712100 2 宜宾学院 生命科学与食品工程学院,四川 宜宾 644000 3 中国科学院植物研究所 资源植物研发重点实验室 植物分子生理学重点实验室,北京 100093
复苏植物是植物界一个特殊的类群,能够忍受极度脱水,以类似休眠的方式度过干旱期,在水分适宜时又迅速恢复生活状态,继续其生活史,在这个过程中表现出形态结构上的可见变化[1-4]。最早对复苏植物研究的文献记录可以追溯到1919年,Dinter研究发现密罗木科植物密罗木Myrothamnus flabellifolius的失水叶片可以在有水的情况下恢复正常的生理状态[5]。虽然人们很早就注意到了复苏现象,但是对复苏植物耐脱水机制的研究则是最近几十年才迅速展开的。随着研究技术的进步和仪器的改进,对复苏植物的研究已经从最初的对其生态适应的解释[6-9]到对其生理生化特别是抗氧化酶系统[10-11]、光合[12-13]、呼吸等方面的研究及至到现在运用分子生物学手段和方法从分子水平上研究其耐脱水机制[14-16]。
牛耳草Boea hygrometrica(Bunge) R. Br.是苦苣苔科,旋蒴苣苔属的一种复苏植物,主要分布在干旱频繁发生的石灰质岩石上,具有极端耐旱的特性,可以在失去90%–95%水分的“超干状态”存活数年,是研究植物耐脱水机制的良好材料[17-18]。目前,已有研究从细胞水平[19]、蛋白水平[17]和基因水平[20-23]研究揭示了牛耳草抗旱的一些分子机制,但是对其内源代谢物在抗旱中的变化和作用尚未有系统性的研究。由于复苏植物次生代谢产物异常丰富,而传统的提取方法只是针对某一类物质有较好的提取效果[24-26],无法全面反映所有代谢物的情况。为了解决以上问题,文中采用代谢组学方法对牛耳草的代谢物进行测定,系统地鉴定和分析小分子代谢物的变化,为揭示牛耳草耐旱复苏机制、筛选关键代谢物质提供重要信息。但目前的代谢物提取方法往往是针对新鲜植物样品设计,而对脱水材料、尤其是脱水达到 95%以上的复苏植物叶片的提取效率未知。因此摸索一种能够对牛耳草“干”、“鲜”两种状态植物都有较高效率的提取技术是研究牛耳草脱水复苏机制的代谢组学分析的前提。我们针对这个问题,对牛耳草代谢物提取方法进行比较和优化,为后续研究提供有效的技术和方法。
1 材料与方法
1.1 仪器与试剂
仪器:Agilent 6890气相色谱仪 (美国Agilent 公司),LECO Pegasus IV 气相-飞行时间质谱联用仪 (美国Leco公司),Sigma 3-18K高速冷冻离心机 (美国 Sigma公司),超低温冰箱,TTL-DC型多功能氮吹仪 (北京),FD-1T冷冻干燥机 (北京),MS-100恒温混匀仪 (浙江),QL-901旋涡混合器 (江苏),色谱注射器(上海)。
试剂:甲醇 (色谱纯,美国 Fisher公司),氯仿 (色谱纯,美国Mreda公司),水 (色谱纯,美国Fisher公司),核糖醇 (美国Sigma公司),无水吡啶 (色谱纯,北京),N-甲基-N-三甲基硅烷基三氟乙酰胺 (MSTFA,美国Sigma公司),甲氧氨基盐酸盐 (美国Sigma公司)。
1.2 植物材料
牛耳草种子采自北京植物园樱桃沟,4 ℃春化2 d后播种在培养盘中,于培养室中土培,温度为 (25±2) ℃,光周期为 16 h/8 h (昼/夜),正常供水。选取3–4月龄的植株用于实验,即“鲜”植物。将“鲜”植物置于相对湿度30%–50%、25 ℃条件下干旱48 h后达到脱水状态 (叶片相对含水率<10%,用于实验,即“干”植物[17](以下未特别注明的提取对象均为鲜样)。
1.3 样品的采集和提取方法
样品采集:选取 4–6棵生长状况良好的牛耳草植株,将其叶片混合,置于研钵中,用液氮充分研磨至粉末,之后置于冷冻干燥仪中冷冻干燥24 h。
样品提取方法:分为A法和B法。
A法:提取过程参照Lisec等[27]和Weckwerth等[28]的方法,稍作改动。具体如下:称取干燥的样品20 mg,放入2 mL的离心管中,加入1.5 mL预冷 (−20 ℃) 的甲醇溶液,再加入 10 μL 浓度为5 mg/L的核糖醇作为内标,涡旋混匀。37 ℃振荡反应提取 2 h,之后放入冷冻离心机中,12 000×g离心10 min。取上清1 mL转移至另一个新的2 mL离心管中,加入400 μL氯仿、400 μL水,涡旋混匀,使极性相和非极性相充分溶于水和氯仿中。12 000×g离心5min,取上清200 μL (极性相) 放入1.5 mL的尖底色谱进样瓶中,低温氮气流吹干,加入 50 μL浓度为20 mg/mL 肟化试剂甲氧氨基盐酸盐,37 ℃、200 r/min振荡反应2 h。之后加入80 μL硅烷化试剂MSTFA,37 ℃、200 r/min振荡反应0.5 h,上样进行GC-MS分析。每个处理设3个重复。
B法:将 A法中的甲醇溶液用甲醇-氯仿-水溶液 (甲醇:氯仿:水体积比为5 2 2) 替换,其他操作同A法。每个处理设6个重复。
1.4 色谱质谱条件
VF-5MS 型色谱柱 (30 m×250 μm ×0.25 μm);进样口温度280 ℃;分流比4 1;进样量1 μL;载气:氦气;溶剂延迟5 min;载气流速:1 mL/min,色谱柱初始温度80 ℃,保持2 min,以8 /min℃升至300 ℃,保持13 min。传输线温度280 ℃,EI离子源:温度,210 ℃,电子能量,70 eV;全扫描模式,扫描范围m/z: 70–650。
1.5 数据分析与统计检验
VF-5MS 型色谱柱 (30 m×250 μm ×0.25 μm);进样口温度280 ℃;分流比4∶1;进样量1 μL;载气:氦气;溶剂延迟5 min;载气流速:1 mL/min,色谱柱初始温度80 ℃,保持2 min,以8 ℃/min升至300 ℃,保持13 min。传输线温度280 ℃,EI 离子源:温度,210 ℃,电子能量,70 eV;全扫描模式,扫描范围m/z: 70–650。
2 结果与分析
2.1 两种提取方法的PLS-DA分析
将牛耳草代谢物GC-MS数据经过预处理后导入SIMCA-P软件进行PLS-DA分析,得到两种方法的 scatter plot图 (图 1)。从图上可以看出,同一方法的重复数据点都集中在一起,说明在实验操作、仪器稳定性等方面都是可靠的,数据的质量是良好的,可以用于后续分析。而两种提取方法的数据点在空间上可以得到明显区分,分布差异表明两种方法提取的代谢物在种类、数量和浓度等方面均存在差异。
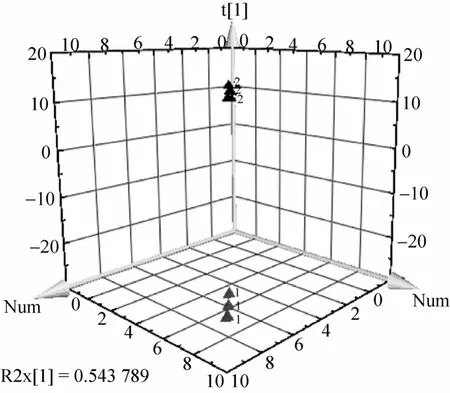
图1 A法 (▲1) 和B (▲2) 法提取牛耳草代谢物的PLS-DA分析散点图Fig. 1 Scatter plot of the method A (▲1) and method B (▲2) by PLS-DA.
2.2 两种提取方法提取效果的比较
为了更直观地比较这两种方法的提取效果,把两者的总离子色谱图叠加在一起进行分析 (图 2)。由图可知,两种提取方法的提取效果存在明显区别,就 B法而言,其色谱峰的数目明显多于A法,且色谱信号强度也优于A法。对两种方法检测到的色谱峰数目进行数学统计(图3),结果显示,两种方法提取的色谱峰的数目差异显著 (P<0.05)。对干样的提取效果进行分析, A法提取的干样色谱峰总数只有155个,明显低于鲜样 (数据未显示),表明此方法不适于干样样品提取。
2.3 两种提取方法提取效率的比较
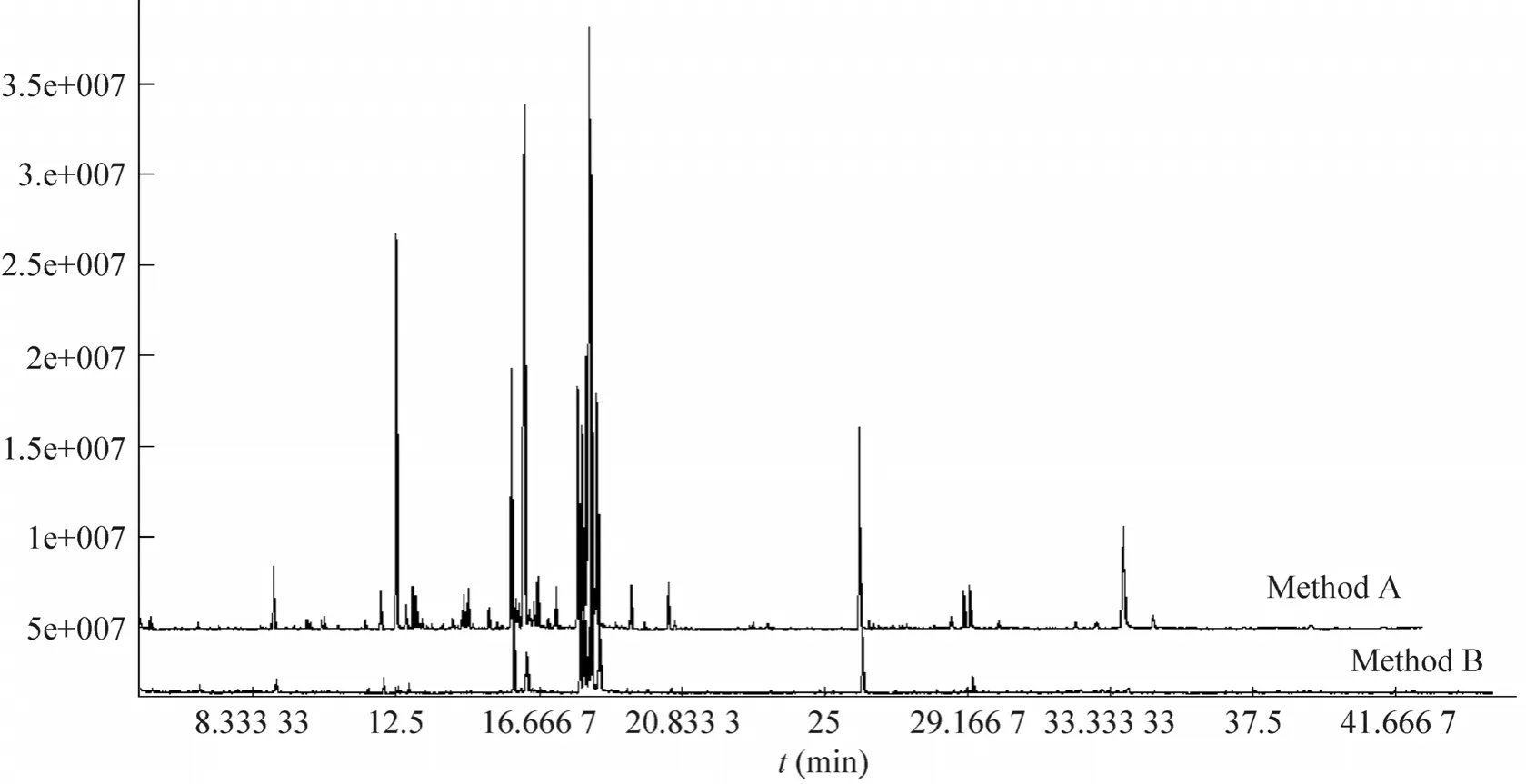
图2 两种方法的总离子色谱图Fig. 2 Stack of total ion current chromatograms of the method A and B.
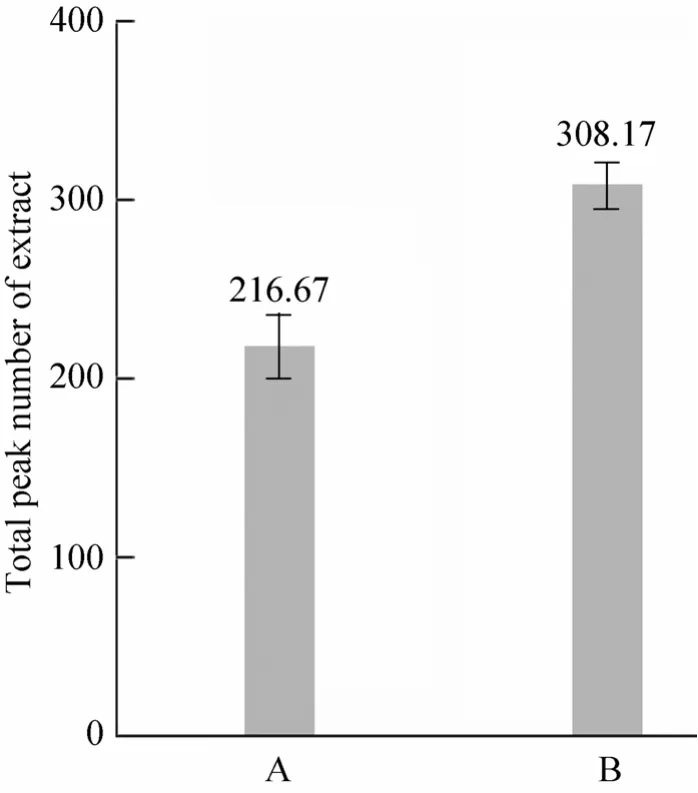
图3 两种方法提取的色谱峰数目Fig. 3 Total peak numbers of extract by method A and B.
由于代谢组学的检测对象主要是生物样品中小分子量的代谢物,如氨基酸、糖类、有机酸和脂肪酸类[30]等,因此文中从所有代谢物中选取了9种共有峰变量,包括3种有机酸、3种氨基酸及3种糖类,以代谢物和内标核糖醇的峰面积比来表示代谢物的相对含量,以 B法和 A法相对含量的比值衡量两种提取方法的优劣。采用SPSS 17.0统计软件进行t检验 (表1),结果显示,多数代谢物的提取率B法均高于A法,仅蜜二糖例外;且除苏氨酸外,其余7种代谢物的提取效率A法和B法的差异程度均达到了显著水平。
2.4 方法稳定性比较
植物代谢物的成分非常复杂,色谱峰数量众多,如何对色谱峰进行鉴定就显得尤为重要。鉴于色谱峰保留时间的稳定性对色谱峰的匹配很重要,我们根据总检测时间的长度随机挑选了10个色谱峰,对两种方法中色谱峰保留时间的稳定性进行了比较分析,同时对这10个色谱峰的相对峰面积,即提取效率的稳定性也进行了考察 (表2)。结果显示,两种方法的10个色谱峰保留时间的相对标准偏差RSD值均小于1%,表明两种方法提取的代谢物保留时间稳定性良好。提取效率稳定性结果显示,A法中,RSD≤5%的仅有1个,比例为10%,5%<RSD≤10%的5个,比例为50%,RSD≥10%的4个,比例为40%,而B法中分别为40%、60%和0。由此可知,在提取效率的稳定性方面,B法远远优于A法。
通过以上各项指标的比较分析可知,B方法更适合于牛耳草叶片代谢物的提取分析。

表1 两种提取方法的提取效率Table 1 Extract efficiencies of method A and B
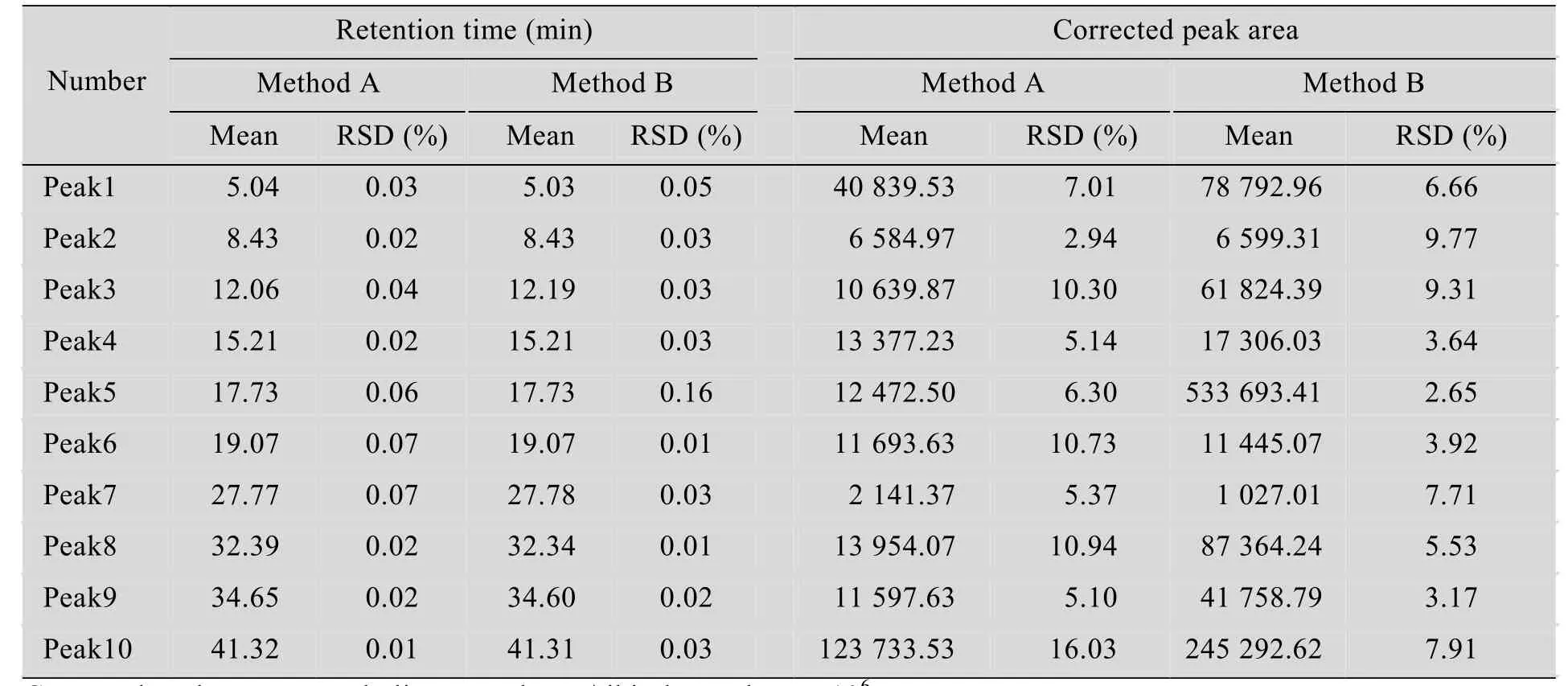
表2 色谱峰保留时间稳定性及提取效率稳定性考察Table 2 Peak stability of retention time and extract efficiency
2.5 干鲜植物样品提取效果的比较
前期结果显示,A法提取的干样色谱峰总数只有155个,明显低于鲜样,所以我们重点比较了 B法对“干”、“鲜”两种状态下的样品的提取效果。将鲜样 (CK) 和干样 (D48 h) 的色谱图叠加在一起分析 (图4),由图可知,除差异峰以外 (两种状态的差异代谢物),绝大部分色谱峰在两种状态的样品中都可以检测得到,而且在保留时间上基本吻合。这说明 B方法同样也适用于牛耳草干样代谢物的提取,不会造成大量代谢物的“丢失”。对两种状态的样品提取的色谱峰数目进行统计 (图5),两者均达到300个以上,没有显著差异。对干样的色谱峰保留时间和提取效率的稳定性进行分析 (表3),保留时间的RSD值均小于1%,提取效率的RSD值在5%左右,稳定性良好 (10个色谱峰与表2中的相对应)。
2.6 干鲜植物样品代谢物变化的比较
前期结果显示,鲜样中检测到308.17个峰,干样中检测到317个峰,而把鲜样和干样总离子色谱图叠加进行分析则共检测到580个峰。这说明两者间特异的色谱峰数目众多,即存在数量众多的差异物质。580个色谱峰中,2个处理都检测到的 265个,Match≥750的99个,其中有15个有机酸峰,51个糖类峰,13个氨基酸峰,这3大类物质占了所检测到的物质种类的绝大部分,与代谢组所能检测到的物质对象是相吻合的。进一步分析,鲜样中特有的代谢物质峰为106个,Match≥750的14个,5个有机酸峰,4个糖类峰,1个氨基酸峰。干样中特有的代谢物质峰为 89个,Match≥750的17个,12个糖类峰,1个有机酸峰,2个氨基酸峰。干样中糖类物质不仅在种类上远大于鲜样,而且总含量也较鲜样明显上升。牛耳草在脱水过程中糖类物质明显增多,这可能与糖类作为渗透调节物质来抵御干旱胁迫有关。而脱水过程中其他物质的具体变化与脱水的关系及牛耳草作为复苏植物特异的代谢物变化还有待进一步分析。

图4 B法提取牛耳草鲜样 (CK) 和干样 (D48 h) 的总离子色谱图Fig. 4 Stack of total ion current chromatograms of the extracts from fresh (CK) and dehydrated (D48 h) materials of B.hygrometrica using method B.

图5 B法提取牛耳草鲜样 (CK) 和干样 (D48 h) 的色谱峰数目Fig. 5 Total peak numbers of the extracts from fresh (CK)and dehydrated (D48 h) materials of B. hygrometrica using Method B.
3 讨论
复苏植物在自然界广泛存在,其种类几乎覆盖了所有的植物生命形式 (裸子植物除外)[4]。以往的研究主要集中在分子水平上,本研究旨在通过应用代谢组学方法测定牛耳草脱水前后代谢物种类及含量的变化,对牛耳草的代谢物进行比较全面的检测及研究,从中找出对牛耳草耐脱水机制有重要影响的关键代谢物,为进一步探明复苏植物的抗旱复苏机制提供理论依据。在全球干旱缺水的背景下,能为寻找强效抗旱基因资源和小分子抗旱调节剂以及作物抗旱育种提供基础。

表3 B法提取牛耳草干样的色谱峰保留时间稳定性及提取效率稳定性Table 3 Peak stability of retention time and extract efficiency of the extracts from dehydrated materials of B. hygrometrica using Method B
一种良好的代谢物提取方法是代谢组学研究的基础,既要求能提出尽可能多的代谢物,还要求检测方法的稳定性良好。本研究用两种方法对牛耳草叶片代谢物进行提取,以GC-MS为代谢物分析方法,对提取效果进行了比较,发现甲醇-氯仿-水法提取物在色谱峰数目及信号强度方面均优于甲醇法;在提取效率方面,为了尽可能全面反映整体情况,选择了氨基酸、糖类及小分子有机酸这 3类可以代表代谢组学检测对象的物质进行分析;在考察方法学稳定性方面,则依据检测时间的总长度均匀随机进行选择,因此能够更好地反映整体情况。结果显示,甲醇-氯仿-水法在各方面都优于甲醇法,而且对干样的提取效果也达到相似水平,表明该方法适用于不同含水量的植物样品的代谢物提取及后续分析。在此基础上,对牛耳草干鲜样品代谢物的初步统计分析结果显示鲜样和干样的差异色谱峰数目有300多个,说明牛耳草在脱水前后体内生理生化活动发生了明显的改变,而这些改变可能与牛耳草耐脱水机制有密切的关系。
以往对牛耳草小分子代谢物的研究仅鉴定了少数物质,如蔡祥海等[24]用醋酸乙酯对牛耳草进行提取,得到了7个甾体类和 1个三萜类化合物,郑晓珂等[26]利用 Diaion HP-20、Sephadex LH-20、Toyopearl HW-40、硅胶柱等柱色谱技术对牛耳草成分进行分离纯化,得到了 5种糖醇类物质,而本研究则检测到了 200余种物质,远高于其他方法。而鲜样和干样中代谢物的具体变化及这些变化与牛耳草脱水前后生理生化活动变化及其耐脱水复苏机制的关系还有待进一步研究。
致 谢:本研究得到中科院植物所分子生理重点实验室漆晓泉研究员和薛震工程师的指导,解丽霞和孟献斌等同学参与部分数据分析,在此一并致谢!
[1]Black M, Pritchard HW. Desiccation and Survival in Plants: Drying without Dying. London: CABI Publishing, 2002.
[2]Moore JP, Nguema-Ona E, Chevalier L, et al.Response of the leaf cell wall to desiccation in the resurrection plantMyrothamnus flabellifolius. Plant Physiol, 2006, 141(2): 651–662.
[3]Vicre M, Lerouxel O, Farrant J, et al. Composition and desiccation-induced alterations of the cell wall in the resurrection plantCraterostigma wilmsii.Physiol Plant, 2004, 120(2): 229–239.
[4]Wu RH. A drought-induced 1-aminocyclopropane-1-carboxylate ethylene forming and ethylene regulated dirigent protein in the resurrection plantBoea hygrometrica[D]. Beijing: Institute of Botany, Chinese Academy of Sciences, 2008 (in Chinese).
吴仁花. 复苏植物牛耳草干旱诱导的 ACC氧化酶基因与乙烯合成及乙烯调控的引导蛋白基因[D]. 北京: 中国科学院植物研究所, 2008.
[5]Chen Y, Xiang CB, Ye X. Recent progress on the molecular mechanisms of desiccation tolerance of resurrection plants. Plant Physiol Com, 2010,46(8): 759–766 (in Chinese).
陈钰,向成斌,叶昕. 植物复苏性状的分子机理研究进展. 植物生理学通讯, 2010, 46(8):759–766.
[6]Pessin LJ. A physiological and anatomical study of the leaves ofPolypodium polypodioides. Amer J Bot, 1924, 11: 370–381.
[7]Child GF. Brief notes on the ecology of the resurrection plant (Myrothamnus flabellifolia) with mention of its water-absorbing abilities. J South African Bot, 1960, 26: 1–8.
[8]Patterson PM. Problems presented by bryophytic xerophytism. Bryologist, 1964, 67(4): 390–396.
[9]Hambler DJ. A poikilohydrous, poililochlorophyllous angiosperm from Africa. Nature, 1961, 191:1415–1416.
[10]Yahubyan G, Gozmanova M, Denev I, et al.Prompt response of superoxide dismutase and peroxidase to dehydration and rehydration of the resurrection plant Haberlea rhodopensis. Plant Growth Regul, 2009, 57(1): 49–56.
[11]Kranner I, Beckett RP, Wornik S, et al. Revival of a resurrection plant correlates with its antioxidant status. Plant J, 2002, 31(1): 13–24.
[12]Huang W, Yang SJ, Zhang SB, et al. Cyclic electron flow plays an important role in photoprotection for the resurrection plantParaboea rufescensunder drought stress. Planta, 2012,235(4): 819–828.
[13]Yang WL, Hu ZA, Wang HX, et al. The protective role of xanthophy II ycle in resurrection angiospermBoea hygrometricaduring dehydration and rehydration. Acta Bot Sin, 2003, 45(3):307–310.
[14]Peters S, Mundree SG, Thomson JA, et al.Protection mechanisms in the resurrection plantXerophyta viscosa(Baker): both sucrose and raffinose family oligosaccharides (RFOs)accumulate in leaves in response to water deficit. J Exp Bot, 2007, 58(8): 1947–1956.
[15]Martinelli T, Whittaker A, Bochicchio A, et al.Amino acid pattern and glutamate metabolism during dehydration stress in the resurrection plantSporobolus stapfianus: a comparison between desiccation-sensitive and desiccation-tolerant leaves. J Exp Bot, 2007, 58(11): 3037–3046.
[16]Ingle RA, Schmidt UG, Farrant JM, et al.Proteomic analysis of leaf proteins during dehydration of the resurrection plantXerophytaviscosa. Plant Cell Environ, 2007, 30(4): 435–446.
[17]Jiang GQ, Wang Z, Shang H, et al. Proteome analysis of leaves from the resurrection plantBoea hygrometricain response to dehydration and rehydration. Planta, 2007, 225(6): 1405–1420.
[18]Wu RH, Wang LL, Wang Z, et al. Cloning and expression analysis of a dirigent protein gene from the resurrection plantBoea hygrometrica. Prog Nat Sci, 2009, 19: 347–352.
[19]Shang HH. A cytological study of drought tolerance mechanisms of the resurrection plantBoea hygrometrica(Bunge) R. Br. [D]. Chongqing:Southwest University, 2006 (in Chinese).
商海红. 更苏植物牛耳草Boea hygrometrica(Bunge) R. Br. 叶片耐旱复苏的细胞学研究[D].重庆: 西南大学, 2006.
[20]Wang Z, Liu YX, Wei JH, et al. Cloning and expression of a gene encoding a raffinose synthase in the resurrection plantBoea hygrometrica. Chin Bull Bot, 2012, 47(1): 44–54 (in Chinese).
王智, 刘永秀, 魏建华, 等. 复苏植物旋蒴苣苔棉子糖合酶基因的克隆和表达. 植物学报, 2012,47(1): 44–54.
[21]Zhu Y, Wang Z, Jing Y, et al. Ectopic over-expression ofBhHsf1, a heat shock factor from the resurrection plantBoea hygrometrica,leads to increased thermotolerance and retarded growth in transgenic Arabidopsis and tobacco.Plant Mol Biol, 2009, 71(4): 451–467.
[22]Deng X, Hu ZA, Wang HX, et al. Effects of dehydration and rehydration on photosynthesis of detached leaves of the resurrection plantBoea hygrometrica. Acta Bot Sin, 2000, 42(3): 321–323(in Chinese).
邓馨, 胡志昂, 王洪新, 等. 脱水和复水对复苏植物牛耳草离体叶片光合作用的影响. 植物学报, 2000, 42(3): 321–323.
[23]Wang Z, Zhu Y, Wang LL, et al. A WRKY transcription factor participates in dehydration tolerance inBoea hygrometricaby binding to the W-box elements of the galactinol synthase(BhGolS1) promoter. Planta, 2009, 230: 1155–1166.
[24]Cai XH, Deng DS, Ma YB, et al. Research onChirita eburneaHance chemical composition. Chin Trad Herbal Drugs, 2005, 36(4): 510–514 (in Chinese).
蔡祥海, 邓德山, 马云保, 等. 牛耳朵化学成分的研究. 中草药, 2005, 36(4): 510–514.
[25]Feng WS, Li YJ, Zheng XK, et al. Chemical Constituents ofBoea hygrometrica. Chin J Nat Med, 2011, 9(6): 406–409 (in Chinese).
冯卫生, 李原京, 郑晓珂, 等. 旋蒴苣苔的化学成分. 中国天然药物, 2011, 9(6): 406–409.
[26]Zheng XK, Lü PF, Feng WS. Study on chemical Constituents of Boea hygrometrica. Proceedings of the eighth national conference on traditional Chinese medicine and natural medicine and the fifth national conference on medicinal plants and plant medicine, 2005 (in Chinese).
郑晓珂, 吕鹏飞, 冯卫生. 牛耳草化学成分的研究. 第八届全国中药和天然药物学术研讨会与第五届全国药用植物和植物药学学术研讨会论文集, 2005.
[27]Lisec J, Schauer N, Kopka J, et al. Gas chromatography mass spectrometry-based metabolite profiling in plants. Nat Prot, 2006, 1(1):387–396.
[28]Weckwerth W, Wenzel K, Fiehn O. Process for the integrated extraction, identification and quantification of metabolites, proteins and RNA to reveal their co-regulation in biochemical networks.Proteom, 2004, 4: 78–83.
[29]Yang HH, Ren HJ, Li LQ, et al. Multiple samples alignment for GC-MS data in parallel on Sector/Sphere. J Compu Chem, 2013, 33(1):215–218 (in Chinese).
杨辉华, 任洪军, 李灵巧, 等. 基于 Sector/Sphere的气相色谱-质谱联用多样本并行对齐算法. 计算机应用, 2013, 33(1): 215–218.
[30]Yin H, Li SG, Bai XF, et al. Research advances in plant metbolomics. Chin Bull Bot, 2005, 22(5):532–540 (in Chinese).
尹恒, 李曙光, 白雪芳, 等. 植物代谢组学的研究方法及其应用. 植物学通报, 2005, 22(5):532–540.
