过表达miR-155抑制C2C12成肌分化
2014-06-15熊燕王禹卫宁许儒祥杨公社庞卫军西北农林科技大学动物脂肪沉积与肌肉发育实验室陕西杨凌712100
熊燕,王禹,卫宁,许儒祥,杨公社,庞卫军西北农林科技大学 动物脂肪沉积与肌肉发育实验室,陕西 杨凌 712100
动物及兽医生物技术
过表达miR-155抑制C2C12成肌分化
熊燕,王禹,卫宁,许儒祥,杨公社,庞卫军
西北农林科技大学 动物脂肪沉积与肌肉发育实验室,陕西 杨凌 712100
为明确miR-155在C2C12成肌分化中的作用及分子机制,本研究构建了miR-155过表达腺病毒载体,运用过表达miR-155的腺病毒感染C2C12,并诱导其成肌分化。通过形态学观察,成肌标志基因mRNA和蛋白表达水平的检测,以及双荧光素酶报告基因系统对预测的miR-155靶基因 (TCF4) 的验证,结果表明,C2C12细胞分化中,过表达miR-155明显降低了肌管的形成,成肌标志基因MyoG和MyHC的mRNA表达量极显著地下降 (P<0.01),而MyoD差异不显著 (P>0.05),成肌标志基因蛋白检测结果与mRNA检测结果一致;进一步研究显示miR-155与预测的TCF4基因的3' UTR 3个靶点(1487-1493,1516-1522,4532-4583) 中的1个 (4532-4538) 结合,并发现过表达miR-155显著降低了TCF4的mRNA水平 (P<0.05)。表明miR-155可能通过靶向TCF4抑制C2C12成肌分化。
miR-155,C2C12,成肌分化,TCF4,腺病毒
miRNA是一类长度约 18–22 nt 的短链非编码RNA,通过结合基因的 3' UTR调控靶基因mRNA的翻译[1]。研究表明,许多 miRNA 是骨骼肌形成的关键调节子[2],其中miR-1、miR-133和miR-206是肌肉组织特异性miRs[3]。Dey 等发现miR-206和miR-486通过直接与Pax7的3' UTR结合,下调Pax7的表达来促进成肌细胞分化[4]。miR-1和miR-133位于同一基因簇,能同时被转录,但二者功能相反,miR-1促进成肌细胞分化,抑制其增殖;而miR-133促进成肌细胞增殖,对分化起抑制作用[5]。此外,miR-214[6]、miR-148a[7]和miR-378[8]也能促进成肌细胞分化,其中miR-378在成肌分化中形成了反馈环调节,其与成肌分化抗原 (Myogenic differentiation antigen,MyoD) 的内源性抑制物(MyoR) 的3' UTR结合抑制其翻译,同时MyoD与miR-378基因启动子近端结合,引起miR-378染色质重组和反式激活[8]。同时成肌分化也受到miRNA的负向调控,如miR-23a直接靶向肌球蛋白重链亚型1 (Myosin heavy chain 1,MyHC1)、MyHC2和MyHC4的3' UTR[9];miR-146a能与Notch信号通路的关键成员Numb的3' UTR结合抑制其翻译,进而抑制该信号通路促肌管形成的作用[10]。由此可见,成肌分化受到多种miRNA的共同调节,发掘新的miRNA调控成肌细胞分化机制,是从miRNA层面全面揭示肌形成机理的研究热点。
miR-155是机体中重要的miRNA,参与多种生理功能,包括造血细胞的生成、炎症反应、免疫应答、前体脂肪细胞分化、血管平滑肌的收缩[11]。近年来,研究发现miR-155在肌肉组织发育中起调控作用[12],但是具体的作用及机制还需进一步研究。基于前人的研究基础,利用TargetScan、PicTar、PITASites及MIRDB等在线软件预测miR-155的靶基因,发现T细胞因子4 (T cell factor 4,TCF4) 存在3个miR-155的潜在靶位点。TCF4作为经典wnt信号通路的下游元件,正向调节成肌细胞分化,并且促进肌球蛋白重链的表达[13-14],推测miR-155可能靶向结合TCF4,抑制其翻译,从而抑制C2C12成肌分化。
本研究通过制备miR-155过表达腺病毒,感染C2C12细胞并诱导分化,运用qPCR 和Western blotting 技术检测肌细胞分化标志基因,如MyoD、肌细胞生成素 (Myogenin,MyoG)及MyHC的表达水平,明确了miR-155在成肌分化中的作用。为探索miR-155调控成肌细胞分化的分子机制,构建TCF4的3' UTR双荧光素酶报告载体,与miR-155过表达载体共转染HEK293T细胞,检测荧光素酶活性,并进一步检测过表达miR-155对C2C12中TCF4的mRNA水平影响,揭示了miR-155调控C2C12成肌分化的分子机制,将为miRNA调控成肌分化提供理论基础。
1 材料与方法
1.1 材料
腺病毒载体系统由本实验室保存;HEK293T、HEK293A、C2C12 细胞系均购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。限制性内切酶 (XhoⅠ和KpnⅠ)、Taq 酶和 T4 DNA连接酶 (TaKaRa),PmeⅠ、PacⅠ(NEB),反转录和qPCR 试剂盒(TaKaRa),BCA蛋白定量试剂盒 (Beyotime);质粒小量抽提试剂盒、凝胶回收试剂盒(Omega);双荧光素酶检测试剂盒 (Promega);胎牛血清、马血清 (HyClone);DMEM 培养基和胰蛋白酶 (Gibco);青霉素、链霉素(四季青公司);TurboFect Transfection Reagent (Thermo Scientif);MyoD 抗体 (Santa Cruz,1∶500),MyoG抗体 (Millipore,1∶500),MyHC抗体(Developmental Studies Hybridoma Bank, Universityof Iowa, IA,1∶500)。其他试剂均为进口或国产化学分析纯。引物合成以及测序由北京三博远志有限公司完成。
1.2 方法
1.2.1 miR-155成熟序列的保守性分析
在miRbase数据库中,搜索小鼠、人、猪、牛、大猩猩、鲤鱼、非洲爪蟾、斑马鱼、鸡、狗、黑猩猩、猕猴的miR-155成熟序列,利用Clustal W软件对序列进行保守性分析。
1.2.2 鼠miR-155腺病毒的载体构建、包装与扩繁
用带有限制性内切酶 XhoⅠ与 KpnⅠ序列的引物扩增 miR-155 前体,并连接到腺病毒穿梭载体 pAdTrack-CMV 中,经 PmeⅠ线性化后,与pAd-Easy骨架载体共转化BJ5183感受态细胞,并涂于卡那霉素抗性的平板,使pAdTrack-CMV-miR-155与pAd-Easy 骨架载体重组,次日挑选菌落 (选择最小的菌落),碱裂解法提取质粒,最后进行 PacⅠ酶切与测序鉴定。构建好的重组载体用 PacⅠ酶切线性化后,乙醇沉淀纯化。将293A细胞以 2×104细胞/cm2的密度接种于 60 mm 培养皿,待细胞融合至70%–80%时,参考TurboFect说明书,用纯化的腺病毒线性化质粒转染HEK293A细胞进行包装。待 7–14 d,整皿细胞都出现荧光,细胞部分脱落,分别收集上清和细胞。细胞放于冻存管中,加入1 mL培养基于–80 ℃和 37 ℃反复冻融3–4次,收集细胞毒,–80 ℃保存。将HEK293A细胞以 5×106细胞接种于 100 mm培养皿中,待细胞融合至90%加入上清毒进行扩繁,36–48 h后收集细胞,以同样的方法收集病毒,用于后续实验使用。
1.2.3 C2C12细胞体外成肌分化模型的建立
未分化的C2C12细胞以含有 10% FBS的高糖DMEM 培养基 (生长培养基, growth medium, GM) 在 37 ℃、5% CO2孵箱中培养。当细胞长至 80%–90%的汇合度时,换以含2%马血清的DMEM 培养基 (分化培养基,differentiation medium,DM) 诱导其成肌分化。每隔2天换液,持续诱导5 d,以倒置显微镜观察肌管的形成。
1.2.4 过表达miR-155的腺病毒感染C2C12细胞
以 5×104细胞/cm2的密度接种于 60 mm培养皿,待细胞汇合到 60%–70%,弃去培养基,加入miR-155 腺病毒上清500 μL 和miR-155细胞毒100 μL,同时用仅表达GFP的腺病毒作为对照,并且与处理组的病毒量一致。病毒感染细胞4 h 后,换成GM,待细胞汇合至80%–90%,按实验室优化的方案进行诱导分化。1.2.5 荧光定量PCR (q-PCR)
收集细胞,用 Trizol 法提取细胞总 RNA,并用RNA-free水溶解,分别用 1%琼脂糖凝胶电泳和核酸定量仪检测总 RNA 的质量及浓度,–80 ℃保存。用U6与microRNA或oligdT与随机引物反转录合成cDNA。参照 TaKaRa公司的 qPCR 说明书,采用20 μL体系对miR-155及成肌标志基因进行定量分析,以U6和GADPH作为内参,引物序列见表1。

表1 实时定量PCR相关基因的引物序列及参数Table 1 Primer sequences and parameters for real-time PCR of related gene
1.2.6 Western blotting
培养皿中的细胞用PBS清洗3次,并用胰酶消化,收集细胞,–80 ℃保存。使用时,加入200 μL含1% PMSF (蛋白酶抑制剂) 的细胞裂解液,冰上裂解30 min,然后4 ℃、12 000 r/min离心5 min,取上清,用 BCA法将蛋白定量后,用细胞裂解液调整蛋白浓度,使样品浓度均一化。按与上清1∶4的比例加入5×上样缓冲液,100 ℃煮沸 10 min,分装后保存。配制蛋白质电泳胶,吸取 20 μL 蛋白样品上样,电泳分离,然后转移到 PVDF 膜 (硝酸纤维素膜) 上,5%脱脂奶粉封闭 2 h,用MyoD、MyoG、MyHC与GAPDH的一抗孵育过夜,次日再用二抗孵育2 h,Bio-Rad GS-800曝光系统显示结果,使用Quantity One Manuel软件进行灰度分析,绘制柱形图。
1.2.7 双荧光素酶报告基因分析
HEK293T以8×104细胞/ cm2的密度接种于24孔板。培养24 h后,按照TurboFect Transfection Reagent操作手册进行转染,每孔加入100 ng 的psiCHECK-2-3' UTR和900 ng pAdTrack-CMV-miR-155 或者pAdTrack-CMV载体,并设置4个重复。转染36 h后,每孔加入500 μL的被动裂解液,根据双荧光素酶试剂盒说明书,利用PerkinElmer VicTOR ×5系统分别检测萤火虫荧光素酶和海参荧光素酶活性。结果显示为海参荧光素酶/萤火虫荧光素酶活性的比值,处理组再与对照组进行比较。
1.2.8 统计学分析
采用SPSS 11.5统计软件One-way ANOVA进行方差分析与显著性检验。实验数据以x±s表示。*P<0.05,差异显著;**P<0.01,差异极显著。
2 结果与分析
2.1 miR-155在不同物种的保守性分析
在miRbase数据库中分别搜索小鼠、人、猪、牛、大猩猩、鲤鱼、非洲爪蟾、斑马鱼、鸡、狗、黑猩猩、猕猴的miR-155成熟序列进行Clustal W比对。结果显示其成熟序列在物种间存在差异,其中猪和小鼠第12位碱基为U,其余为C (图1)。通常miR成熟序列5'端的2–8个碱基为种子序列,其与mRNA的结合很重要。但是最新的研究发现,种子序列附近的核苷酸变异会改变miRNA与靶位点形成二级结构的稳定程度 (即最低自由能大小),从而影响其靶向作用[15-16]。因此miR-155在小鼠和猪中的靶基因可能与其他物种存在差异。此外,其他物种miR-155的成熟序列仅在3'端最后一个碱基存在缺失变异 (图1),其不会影响miRNA与靶基因结合物的稳定性[16],所以miR-155在这些物种中功能具有一定的保守性。

图1 miR-155成熟序列在不同物种中的保守性分析Fig. 1 Conservative analysis of miR-155’s mature sequence among 13 species. “*” represent base consistent perfectly.
2.2 miR-155腺病毒载体构建
用带有XhoⅠ和KpnⅠ酶切位点的引物,以小鼠DNA为模板克隆长为321 bp、含酶切位点序列的 pre-miR-155,并胶回收目的片段 (图2A,泳道13),随后插入到 pAdTrack-CMV 载体中,转化大肠杆菌 DH5α 后经XhoⅠ和KpnⅠ酶切 (图2A,泳道1–12)、测序鉴定以及pre-miR-155的穿梭载体与pAd-Easy 骨架载体重组。经 PacⅠ酶切后,出现一条4.5 kb的小片段和一条23 kb的大片段 (图2B),获得了阳性重组质粒,测序鉴定与miRbase中序列完全一致,表明成功构建了miR-155腺病毒重组载体。
2.3 miR-155腺病毒的载体的包装与扩繁
将构建好的重组腺病毒载体 pAd-miR-155用 PacⅠ酶切后,乙醇沉淀纯化,用TurboFect转染融合率为60%–70%的HEK293A细胞。荧光显微镜下观察,第3天有大量荧光,第6天出现“彗星尾”现象 (图3A),待大部分细胞脱落,表明病毒成熟,收集病毒,进行病毒扩繁,加毒36 h后几乎所有细胞被病毒感染 (图3B),48 h观察超过50%的细胞脱落 (图3B),此时是收毒的最佳时间。

图2 pre-miR-155腺病毒过表达载体的构建Fig. 2 Construction of miR-155 adenovirus over-expression vector. (A) pAdTrack-CMV-miR-155 was identified by restriction enzyme digestion (Kpn I and Xho I). M1, M2: DNA marker; 1–12: the digested production of pAd-CMV recombinant plasmids; 13: the pre-miR-155 fragment purified by DNA gel extraction. (B) The easy vector contains pre-miR-155 digested with Pac I. M: DNA marker; 1: easy vector and pAdTrack-CMV-miR-155 recombinant plasmid; 2: pAdTrack-CMV-miR-155; 3–6: the digested production of easy vector and pAdTrack-CMV-miR-155 recombinant plasmid.
2.4 miR-155腺病毒感染C2C12细胞及其过表达效率检测
miR-155腺病毒感染汇合率为60%–70%的C2C12细胞,并用GFP处理为对照。24 h后观察,感染效率大约为50% (图4A),48 h收集细胞,提取总RNA,用特异性反转录引物反转成cDNA,qPCR分析miR-155成熟序列的表达量,以U6作为内参。结果显示,过表达 miR-155 后其表达量升高了8.8倍 (P<0.01)。表明构建的载体能在C2C12中高效表达。
2.5 过表达miR-155抑制C2C12细胞成肌分化
对腺病毒处理的C2C12细胞进行分化诱导,观察分化第5天细胞的形态学变化。结果发现,对照GFP腺病毒处理5 d后,细胞正常分化,并有大量肌管形成 (图5A)。然而,过表达miR-155细胞分化受到抑制,肌管明显减少(图5A)。同时,提取细胞总RNA,qPCR检测成肌分化转录因子MyoD、MyoG及MyHC的表达水平,结果显示MyoG和MyHC的mRNA水平极显著下降 (P<0.01),而MyoD的mRNA略
有下降,但差异不显著 (图5B、C和D)。Westernbloting分析蛋白表达,结果与qPCR结果一致,MyoD和MyHC蛋白表达明显下降 (图5E和F)。以上结果从形态学及分子水平表明过表达miR-155抑制C2C12成肌分化。
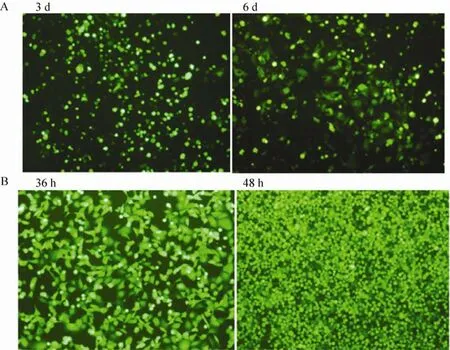
图3 重组腺病毒载体 pAd-miR-155 的包装与扩繁Fig. 3 Package and amplification of recombinant adenovirus vector pAd-miR-155. (A) The third day after HEK 293A cells transfected with pAd-pre-miR-155, 30%–40% cells expressed GFP. In the sixth day, the GFP expression increased rapidly, and the shape of GFP was like a comet tail (100×). (B) The GFP expression when pAd-miR-155 proliferated in HEK 293A cells (100×).

图4 miR-155腺病毒感染C2C12及过表达效率检测Fig. 4 miR-155 adenovirus infected C2C12 and the efficiency of overexpression was detected. (A) C2C12 cells before being infected by adenovirus and the GFP expression in C2C12 cells infected with adenovirus containing miR-155 (40×). (B) Real-time PCR analysis mRNA expression of mature miR-155. ** P<0.01 compared with GFP group.
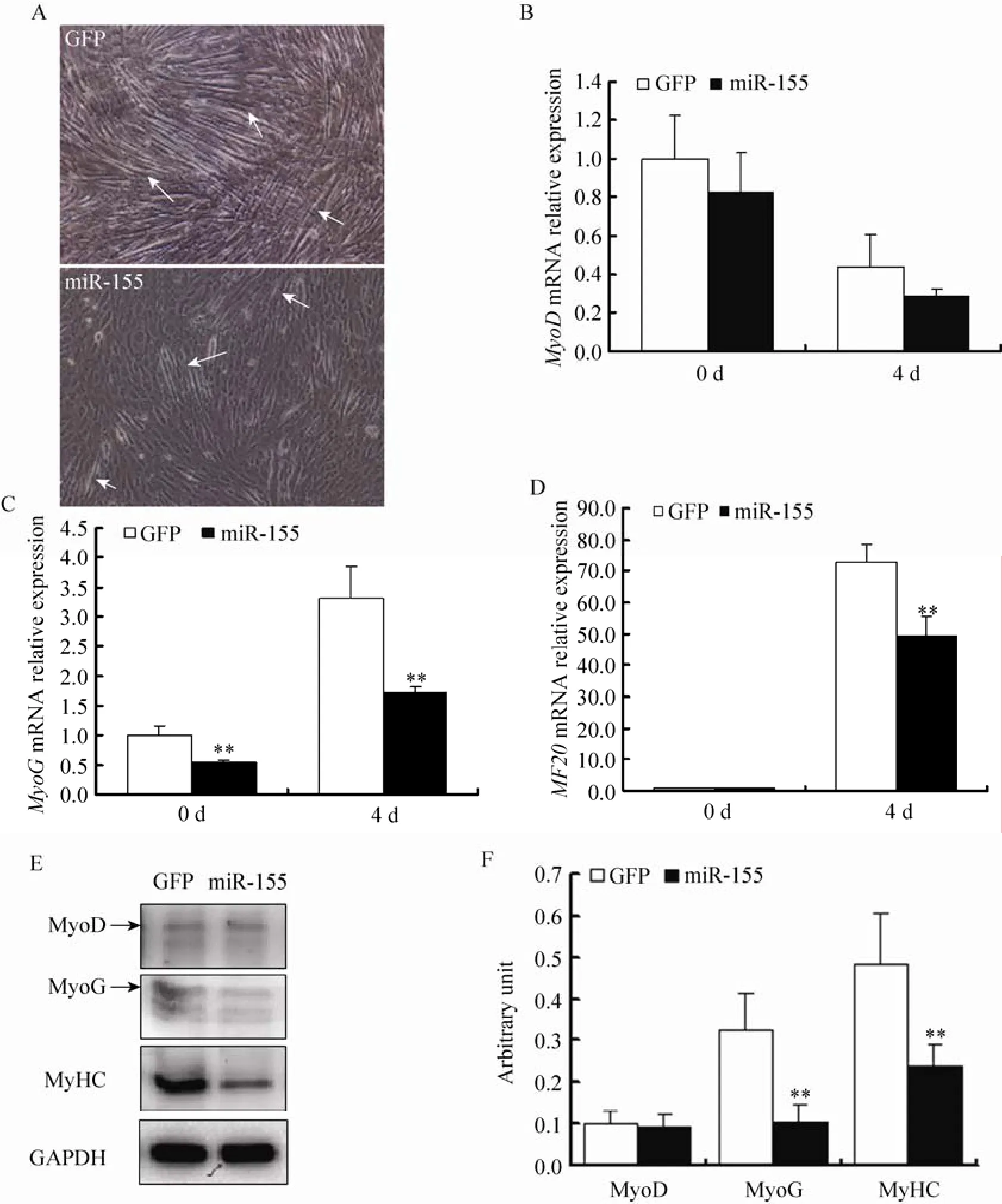
图5 miR-155抑制C2C12成肌分化Fig. 5 miR-155 inhibits the C2C12 myogenic differentiation. (A) Morphometric observation of C2C12 myoblast differentiation at day 5 (100×), white arrows indicate myotubes. (B–D) Q-PCR showed the relative mRNA expression of MyoD, MyoG, and MyHC between over-expression miR-155 and GFP group. (E) The protein expressions of MyoD, MyoG and MyHC were analyzed by Western blotting at day 5 after differentiation. (F) Densitometric analysis of MyoD, MyoG and MyHC, normalized against GAPDH. ** P<0.01 compared with GFP group at the same time point.
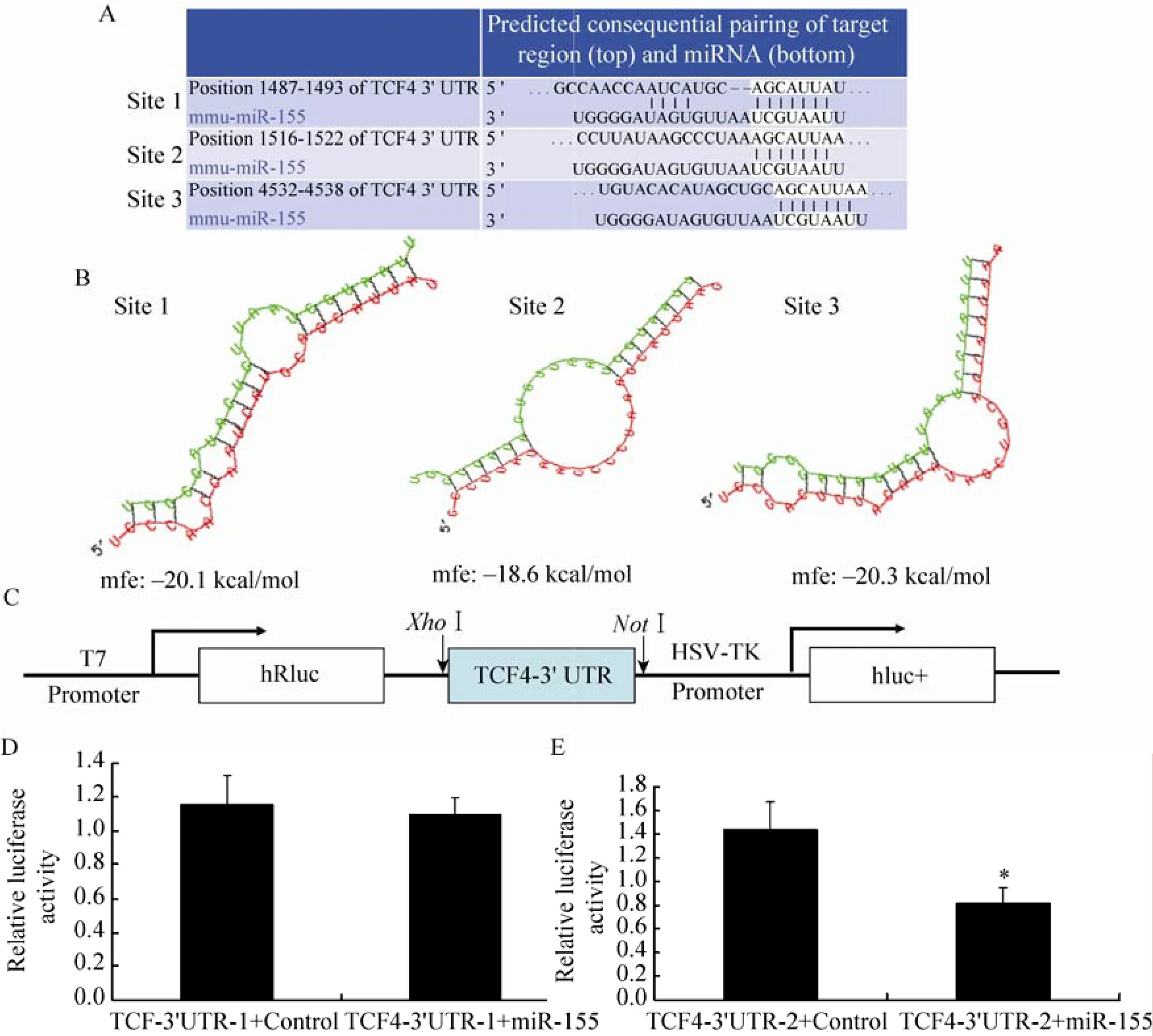
图 6 TCF4是miR-155的靶基因Fig. 6 TCF4 is a target gene of miR-155. (A) Three putative target sites of TCF4 were predicted by TargetScan and PicTar. (B) miR-155: TCF4 3' UTR duplex among different putative target sites. The sequence marked in red is TCF4 3' UTR, and the sequence marked in green is the mature sequence of miR-155 in mouse. mfe: minimum free energy. (C) Schematic representation of the construct used in the luciferase assay. (D and E) miR-155 directly binds to 3' UTR (4532-4538) of TCF4. HEK293T cells in 24-well plates were transfected with 3'UTR reporters (psiCHECK-1-3'UTR contains site1 and site2, psiCHECK-2-3'UTR contains site3, 100 ng) and pAdTrack-CMV-miR-155 (900 ng). Lysates were harvested 36 h after transfection, and reporter activity was measured with the dual luciferase assay. * P<0.05 compared with control.
2.6 miR-155靶基因TCF4的验证
利用TargetScan (http://www.targetscan.org/ vert_50/) 和PicTar (http://pictar.mdc-berlin.de/)等在线预测软件发现TCF4的3'UTR有3个保守的靶向位点 (图6A),该转录因子在调控肌肉发育方面有重要作用[14,17]。进一步分析miR-155成熟序列与预测的靶向位点结合的二级结构(http://bibiserv.techfak.uni-bielefeld.de/rnahybrid/submission.html),结果显示第3个位点与miR-155形成的自由能最小,结构最稳定 (图6B),其可能是miR-155发挥作用的靶位点。为了验证预测结果,构建了TCF4的双荧光素酶报告基因载体 (图6C):psiCHECK-1-3' UTR (包含Site1与Site2) 和psiCHECK-2-3' UTR (包含Site 3),分别与miR-155过表达质粒共转染HEK 293T细胞,检测萤火虫荧光素酶和海参荧光素酶活性,并以萤火虫荧光素酶活性为内参。结果显示转染包含Site3载体的荧光素酶活性明显降低(P<0.05) (图6E),而包含Site1与Site2的转染组差异不显著 (图6D),表明miR-155通过靶向结合TCF4的Site3发挥作用。
2.7 过表达miR-155下调TCF4的mRNA水平
以上验证TCF4是miR-155的靶基因,C2C12细胞过表达miR-155能否影响内源TCF4的mRNA水平需进一步研究。腺病毒感染C2C12,分别在诱导分化0 d、4 d收集细胞提取RNA,利用qPCR检测TCF4的mRNA水平,结果显示过表达miR-155使得TCF4的mRNA水平显著下降 (图7),表明在成肌分化过程中,TCF4受到miR-155的调节。

图7 miR-155调节TCF4的mRNA水平Fig. 7 miR-155 regulates TCF4 at the mRNA level. Over-expressed miR-155 in C2C12 cells shows a significant decrease in the endogenous TCF4 mRNA level. ** P<0.01 compared with GFP group at the same time point.
3 讨论
骨骼肌是肌肉的主要组成部分,肌细胞的分化是其生长发育的前提,该生理过程非常复杂,涉及到大量基因的表达调控、信号通络的“对话”及非编码RNA的调节。研究表明,miRNAs 作为一种短链非编码RNA,广泛地参与了骨骼肌细胞的分化以及相关疾病的形成[2]。因此,以C2C12为细胞模型,寻找新的调控肌细胞分化的miRNA并揭示其作用的分子机理,是该研究领域的热点,并将为肌相关疾病的治疗及家畜的分子育种提供理论基础。
在本研究的预实验中采用pcDNA3.1过表达miR-155质粒转染C2C12细胞,其过表达效率仅为对照组的2倍,不能满足后期实验的要求,故使用miR-155的过表达腺病毒作为载体,其与逆转录病毒和慢病毒相比,具有安全性高、易扩繁、滴度高、靶细胞种类多、过表达效率高、不整合到宿主基因组中等优点,是基因治疗研究的首选载体[18-19]。在感染实验中,添加了10 μg/mL 的聚凝胺,其是一种多聚阳离子聚合物,可通过中和细胞表面唾液酸与病毒颗粒之间的静电排斥,促进病毒的吸附作用,从而提高感染效率[20]。此外,双荧光素酶报告分析中,将靶基因的3' UTR 连接到psiCHECK-2载体上,该质粒能同时表达萤火虫荧光素酶和海参荧光素酶,避免了两个质粒转染效率低,同一批次和不同批次间转染差异大的弊端,提高了实验的准确性。
MyoD是生肌调节因子 (Myogenic regulation factors,MRFs) 家族的重要成员,抑制肌细胞增殖,调节肌肉特异基因表达,在成肌细胞形成肌管早期起关键作用[21-22]。在本实验中,C2C12细胞过表达miR-155后,MyoD的mRNA和蛋白的表达略有下降,但是差异不显著。然而,成肌分化晚期标志基因MyoG和MyHC的mRNA和蛋白的表达差异极显著。表明 miR-155 在调控成肌细胞分化中发挥重要作用,并提示miR-155 可能通过抑制早期标志基因MyoD推迟成肌细胞的分化,并进一步通过抑制肌肉形成的晚期标志分子MyoG和MyHC阻遏肌肉的分化。
TCF4是经典Wnt信号通路在核内的目标,并作为该通路的分子开关,通过β-catenin在核内与其结合后激活下游靶基因的转录。Wnt信号在胚胎发生中对肌肉的形成发挥重要作用,是肌细胞终末分化和卫星细胞定向的关键调控因子[17]。研究显示C2C12细胞系阻断β-catenin活性或通过表达显性负向TCF4,抑制了成肌分化[14],表明TCF4是经典wnt通路调控成肌分化的关键因子。进一步的生物信息学分析TCF4的3'UTR 序列上存在3个miR-155的潜在靶点,经过双荧光素酶报告基因分析验证,Site3是与miR-155结合的有效位点。我们分析了miRNA与靶位点及附近序列形成的二级结构,其与Site3形成的二级结构自由能最小,结构最稳定,这可能是Site3成为有效位点的一个原因,另外,miRNA结合位点在3′UTR区的位置和相应位置的碱基分布,位点的可结合性等也与靶基因的结合存在密切相关性[16,23]。进一步的实验证明了miR-155能下调内源TCF4的mRNA水平,这似乎与传统观念相矛盾:动物细胞中miRNA仅调控靶mRNA的翻译。但是最新研究表明富含AU的miRNA能影响mRNA的稳定性,缩短半衰期[24-25]。经分析,miR-155的AU含量超过50%,另外,有研究者在HeLa细胞中证明了外源miR-1和miR-155能同时降低靶基因的mRNA和蛋白水平,对于miR-233,也观察到相似的结果[26]。所以,miR-155可能通过影响TCF4 mRNA的稳定性来发挥靶向作用。
总之,本实验成功制备了miR-155的过表达腺病毒,感染C2C12细胞,过表达效率提高了8.8倍,诱导分化后,形态学观察肌管明显减少,检测成肌分化相关基因MyoG和MyHC的表达显著下降,进一步验证了TCF4为miR-155的靶基因。以上结果明确了miR-155抑制C2C12成肌分化的作用,并暗示其可能通过靶向TCF4抑制肌管的形成。
REFERENCES
[1] Cai Y, Yu X, Hu S, et al. A brief review on the mechanisms of miRNA regulation. Genom Proteom Bioinform, 2009, 7(4): 147–154.
[2] Goljanek-Whysall K, Sweetman D, Munsterberg AE. microRNAs in skeletal muscle differentiation and disease. Clin Sci (Lond), 2012, 123(11): 611–625.
[3] Sweetman D, Goljanek K, Rathjen T, et al. Specific requirements of MRFs for the expression of muscle specific microRNAs, miR-1, miR-206 and miR-133. Dev Biol, 2008, 321(2): 491–499.
[4] Dey BK, Gagan J, Dutta A. miR-206 and -486 induce myoblast differentiation by downregulating Pax7. Mol Cell Biol, 2011, 31(1): 203–214.
[5] Luo X, Lin H, Pan Z, et al. Down-regulation of miR-1/miR-133 contributes to re-expression of pacemaker channel genes HCN2 and HCN4 inhypertrophic heart. J Biol Chem, 2008, 283(29): 20045–20052.
[6] Liu J, Luo XJ, Xiong AW, et al. MicroRNA-214 promotes myogenic differentiation by facilitating exit from mitosis via down-regulation of proto-oncogene N-ras. J Biol Chem, 2010, 285(34): 26599–26607.
[7] Zhang J, Ying ZZ, Tang ZL, et al. MicroRNA-148a promotes myogenic differentiation by targeting the ROCK1 gene. J Biol Chem, 2012, 287(25): 21093–21101.
[8] Gagan J, Dey BK, Layer R, et al. MicroRNA-378 targets the myogenic repressor MyoR during myoblast differentiation. J Biol Chem, 2011, 286(22): 19431–19438.
[9] Wang L, Chen X, Zheng Y, et al. miR-23a inhibits myogenic differentiation through down regulation of fast myosin heavy chain isoforms. Exp Cell Res, 2012, 318(18): 2324–2334.
[10] Kuang W, Tan J, Duan Y, et al. Cyclic stretch induced miR-146a upregulation delays C2C12 myogenic differentiation through inhibition of Numb. Biochem Biophys Res Commun, 2009, 378(2): 259–263.
[11] Faraoni I, Antonetti FR, Cardone J, et al. miR-155 gene: a typical multifunctional microRNA. Biochim Biophys Acta, 2009, 1792(6): 497–505.
[12] Zhao S, Zhang J, Hou X, et al. OLFML3 expression is decreased during prenatal muscle development and regulated by microRNA-155 in pigs. Int J Biol Sci, 2012, 8(4): 459–469.
[13] Schnorrer F, Dickson BJ. Muscle building; mechanisms of myotube guidance and attachment site selection. Dev Cell, 2004, 7(1): 9–20.
[14] Mathew SJ, Hansen JM, Merrell AJ, et al. Connective tissue fibroblasts and Tcf4 regulate myogenesis. Development, 2011, 138(2): 371–384.
[15] Cong F, Ku L. Computational analysis of miRNA and target mRNA interactions: combined effects of the quantity and quality of their binding site. Progr Biochem Biophys, 2009, 35(5): 608–615.
[16] Didiano D, Hobert O. Molecular architecture of a miRNA-regulated 3' UTR. RNA, 2008, 14(7): 1297–1317.
[17] von Maltzahn J, Chang NC, Bentzinger CF, et al. Wnt signaling in myogenesis. Trends Cell Biol, 2012, 22(11): 602–609.
[18] Danthinne X, Imperiale MJ. Production of first generation adenovirus vectors: a review. Gene Therapy, 2000, 7(20): 1707–1714.
[19] Ross PJ, Parks RJ. Construction and characterization of adenovirus vectors. Cold Spring Harb Protoc 2009, doi: 10.1101/pdb. prot5011.
[20] Jacobsen F, Hirsch T, Mittler D, et al. Polybrene improves transfection efficacy of recombinant replication-deficient adenovirus in cutaneous cells and burned skin. J Gene Med, 2006, 8(2): 138–146.
[21] Sabourin LA, Rudnicki MA. The molecular regulation of myogenesis. Clin Genet, 2000, 57(1): 16–25.
[22] Bentzinger CF, Wang YX, Rudnicki MA. Building muscle: molecular regulation of myogenesis. Cold Spring Harb Perspect Biol, 2012, 4(2): a008342.
[23] Bartel DP. MicroRNAs: target recognition and regulatory functions. Cell, 2009, 136(2): 215–233.
[24] Bagga S, Bracht J, Hunter S, et al. Regulation by let-7 and lin-4 miRNAs results in target mRNA degradation. Cell, 2005, 122(4): 553–563.
[25] Vohradsky J, Panek J, Vomastek T. Numerical modelling of microRNA-mediated mRNA decay identifies novel mechanism of microRNA controlled mRNA downregulation. Nucleic Acids Res, 2010, 38(14): 4579–4585.
[26] Hu W, Coller J. What comes first: translational repression or mRNA degradation? The deepening mystery of microRNA function. Cell Res, 2012, 22(9): 1322–1324.
(本文责编 郝丽芳)
Effect of over-expressed miR-155 on inhibiting C2C12 myogenic differentiation
Yan Xiong, Yu Wang, Ning Wei, Ruxiang Xu, Gongshe Yang, and Weijun Pang
Laboratory of Animal Fat Deposition and Muscle Development, Northwest A & F University, Yangling 712100, Shaanxi, China
To clarify the function and molecular mechanism of miR-155 in myogenic differentiation of C2C12, we constructed adenovirus over-expression vector of miR-155, then C2C12 cells were infected by adenovirus and induced myogenic differentiation. First, we observed the morphology of C2C12 after differentiation. Then the mRNA and protein expressions of myogenic markers (MyoD, MyoG and MyHC) were detected by qPCR and western blotting. Subsequently, the dual luciferase reporter gene assay was carried out to validate putative target gene (TCF4) of miR-155. Meanwhile, mRNA level of TCF4 was analyzed after over-expressing miR-155. The results show that over-expressed miR-155 reduced myotubes formation. Moreover, the mRNA and protein expression of MyoG and MyHC decreased significantly (P<0.01). Further research demonstrated miR-155 bound the one (4532-4538) of three putative sites (1487-1493,1516-1522,4532-4583) of TCF4 by luciferase reporter gene assay and the mRNA level of TCF4 decreased notably (P<0.05). The data suggest that miR-155 inhibited myogenic differentiation of C2C12 through targeted TCF4.
miR-155, C2C12, myogenic differentiation, TCF4, adenovirus
May 3, 2013; Accepted: October 9, 2013
Weijun Pang. Tel: +86-29-87091893; E-mail: pwj1226@nwsuaf.edu.cn
熊燕, 王禹, 卫宁, 等. 过表达miR-155抑制C2C12成肌分化. 生物工程学报, 2014, 30(2): 182-193.
Xiong Y, Wang Y, Wei N, et al. Effect of over-expressed miR-155 on inhibiting C2C12 myogenic differentiation. Chin J Biotech, 2014, 30(2): 182-193.
Supported by: National Natural Science Foundation of China (No. 30600437), NWAFU Basic Science Research Program (No. QN2009021), National Basic Research Program of China (973 Program) (No. 2012CB124705), the Reproduction Technolgy of National Pork Industry Technology Systems (No. CARS-36-04).
国家自然科学基金 (No. 30600437),西北农林科技大学基本科研业务项目 (No. QN2009021),国家重点基础研究发展计划 (973计划) (No. 2012CB124705),国家生猪产业技术体系 (No. CARS-36-04) 资助。
时间:2013-11-05 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20131105.1012.002.html
