鹅MYL1基因的克隆及胚胎期表达特征分析
2014-06-17顾志良石亦静吴小娟
顾志良,邵 芳,石亦静,吴小娟
(常熟理工学院 生物与食品工程学院,江苏 常熟 215500)
动物的产肉力与肌纤维细胞的数量和生长密切相关[1],肌纤维是构成骨骼肌的基本单位,肌球蛋白是肌纤维的主要成分之一,是一种多功能马达蛋白,为肌肉收缩提供动力.肌球蛋白是一个超家族,有2条肌球蛋白重链(Myosin heavy chain,MHC)和2条肌球蛋白轻链(Myosin light chian,MYL)组成.哺乳动物存在两对轻链,每对轻链由必需肌球蛋白轻链(Essential myosin light chain,ELC)和调节肌球蛋白轻链(Regula⁃tory myosin light chain,RLC)组成[2],不同的ELC和RLC的家族成员由多种基因编码,而且同型异构体可呈现不同的表达谱.肌球蛋白轻链、肌钙蛋白C与钙调蛋白同属于EF-hand超家族成员,EF-hand是一种由40个左右氨基酸组成的螺旋-环-螺旋基序(Motif),环区通常是该类蛋白的Ca2+结合区域.肌球蛋白轻链能稳定肌球蛋白的α-螺旋的颈部区域,并位于靠近肌球蛋白三磷酸腺苷结合和肌动蛋白结合结构域[3].
肌球蛋白轻链1基因(myosin light chian1,MYL1)属于ELC的一个成员,编码肌球蛋白必须轻链亚基,主要在哺乳动物的心肌、平滑肌和快肌表达.哺乳动物中,MYL1基因有MLC1f和MLC3f两种异构体,两者之间的不同仅在于N-端的41个氨基酸[4-6].MLC1f和MLC3f的转录调控受到一系列调控元件控制,包括MLC1f和MLC3f的启动子元件和MEF2、MEF3等肌肉组织特异增强子元件[5,7-8].
鹅作为重要水禽,鹅肉具有营养丰富、脂肪含量低、不饱和脂肪酸含量高等优点[9],其产肉量和肌肉品质都是重要的经济性状,关于鹅肌肉生长发育和肉质形成的研究也备受人们关注.MYL1基因在肌肉生长发育过程中发挥了至关重要的作用.然而鹅MYL1基因至今尚未被克隆和测序,鉴于该基因在肌肉发育过程中的重要意义,本研究将以太湖鹅为材料,采用3′-RACE和5′-RACE技术克隆鹅MYL1基因,对该基因序列作生物信息学分析,并运用实时荧光定量PCR检测MYL1基因在胚胎期的表达情况,旨在为该基因的功能和开展产肉性状分子遗传基础研究积累素材.
1 材料与方法
1.1 试验动物与样品采集
从常熟市江南畜禽食品公司孵化场采集E7、E10、E14、E15、E18、E21、E25和E28的太湖鹅胚各4枚,液氮速冻各组织后于-80℃保存.
1.2 总RNA的提取
用Trizol(Invitrogen,USA)分别提取E7,E10胚胎总RNA及E14、E15、E18、E21、E25和E28鹅胚腿肌总RNA,RNase-free dH2O充分溶解,甲醛变性琼脂糖凝胶电泳检验RNA质量,NanoDrop2000分光光度计测定其浓度,于-80℃保存备用.
1.3 引物设计及合成
根据GenBank已发表的鸡(登录号:NM_001044632)和鸭(登录号:HQ728349)MYL1基因序列设计鹅CDS区PCR引物.根据RT-PCR获得的序列设计5′-RACE和3′-RACE的特异性引物(包括Outer PCR引物和Inner PCR引物),同时根据克隆获得的MYL1基因cDNA序列设计荧光定量PCR引物,内参用GAPDH,两对引物均跨越内含子,引物均由上海生工生物工程有限公司合成.引物的相关信息见表1.

表1 PCR引物的信息
1.4 鹅MYL1基因5′和3′端的序列扩增及产物的克隆与测序
5′端序列扩增按 TaKaRa 5′-Full RACE Kit说明步骤,对鹅总 RNA(2 μg)进行去磷酸化处理、“去帽子”反应、5′RACE Adaptor连接得到ligated RNA,取6 μL ligated RNA进行反转录反应,最后再分别用MYL3-5′RACE Outer和Inner引物进行两轮PCR反应;用DNA回收试剂盒(QIAEXⅡ)回收目的片段,回收产物与pMD-19T载体(TaKaRa)连接,转化E.coli DH5α感受态细胞,蓝白斑筛选挑取阳性克隆,菌落PCR检测,结果为阳性的菌液送上海生工公司测序.
3′端序列扩增同样按TaKaRa 3′-Full RACE Kit说明步骤,将鹅总RNA稀释成500 ng/μL,取1 μL进行反转录反应,再分别用MYL1-3′RACE Outer和Inner引物进行两轮PCR反应,后续步骤同上.
1.5 不同胚胎发育时期MYL1 mRNA表达分析
将不同胚胎发育时期鹅总RNA稀释成同一浓度(100 ng/μL),每个时期3个个体,取5 μL RNA进行反转录反应,再运用荧光定量 PCR检测,反应体系总体积为 20 μL:SYBR Premix ExTaqTMII(2×)10 μL,PCR Forward Primer(10 μM)0.4 μL,PCR Reverse Primer(10 μM)0.4 μL,ROX Reference Dye II(50×)0.4 μL,cDNA 1 μL,RNase-free dH2O 7.8 μL;qRT-PCR扩增条件为:95 ℃30 s;95 ℃5 s,60 ℃34 s 40次. 在AB(应用生物系统)公司的7500型实时荧光定量PCR仪上进行.
1.6 鹅MYL1基因生物信息学分析
利用在线工具DNAMAN和ClustalX1.83软件做同源性比对,用MEGA 4.1软件中的Kimura 2-parameter法计算净遗传距离矩阵,并以距离矩阵邻接法(Neighbor-Joining,NJ)构建系统进化树.通过ExPASy蛋白质组服务器中的ProtParam工具预测鹅MYL1蛋白的理化性质.应用NCBI上的“BLASTP”程序分析MYL1蛋白的功能属性.
1.7 数据收集和分析
对不同鹅胚胎发育时期的样品内标基因GAPDH和目标基因MYL1分别进行实时荧光PCR检测,测定其Ct值,根据相对实时荧光定量PCR 2-ΔCt值法,算出每个样品中GAPDH基因与MYL1基因表达的相对值.在Excel中作出MYL1mRNA不同发育时期腿肌组织中表达量的柱状图.并用SPSS软件进行显著性检验.
2 结果分析
2.1 鹅MYL1基因全长cDNA克隆及序列分析
通过同源比对设计特异性引物,以鹅肌肉总RNA为模板,反转录后得到cDNA,用引物MYL1outer F/R进行PCR扩增,扩增后通过1%的琼脂糖凝胶电泳鉴定,获得长度为450 bp左右片段(图1).经过3′RACE和5′RACE各两轮PCR后,分别获得1000 bp和500 bp的特异性条带(图2).克隆测序后用DNAMAN5.0软件进行序列拼接,去除重叠序列,得到1 542 bp的鹅MYL1cDNA全序列.包含582 bp的开放性阅读框,其起始密码子为AUG,终止密码子为UGA,共翻译编码193个氨基酸,5′-UTR为108 bp,3′-UTR为852 bp(图2),GenBank登录号:KF986326.
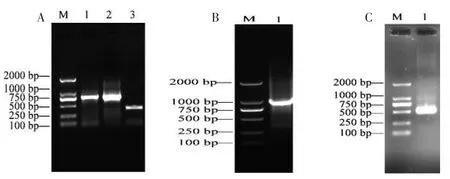
图1 鹅MYL1基因cDNA扩增(M:DL-2000 DNA marker)
2.2 鹅MYL1基因生物信息学分析
通过ExPASy蛋白质组服务器中的ProtParam工具分析鹅MYL1预测蛋白的生理生化特征,其等电点为5.12,分子量为21.75 KD,由3633个原子组成,分子式为C964H1528N252O297S11,负电荷氨基酸残基总数为36(Asp+Glu),正电荷氨基酸残基总数为 28(Arg+Lys),不稳定系数为43.18.通过ProtScale工具分析其亲疏水性,发现最小值为-3.000,位于第16个氨基酸残基,具有高亲水性,而最大值为1.144,位于第116个氨基酸残基,有较强的疏水性.进一步分析亲疏水性区域,在5~33,50,64,64,99~102,125~127,165,166等区域具有高亲水性(score<-1.5)(图 3). 利用NCBI上 Blasp预测鹅MYL1蛋白结构域,结果显示MYL1含有一个典型的EFh(EF-hand, calcium binding motif) 和 FRQ1(Ca2+-binding protein,EF-hand superfami⁃ly)保守结构域(图4),这两种结构都是钙结合蛋白位点,这与其他肌球蛋白轻链基因结构相似.

图2 鹅MYL1基因全长cDNA的核苷酸及氨基酸序列
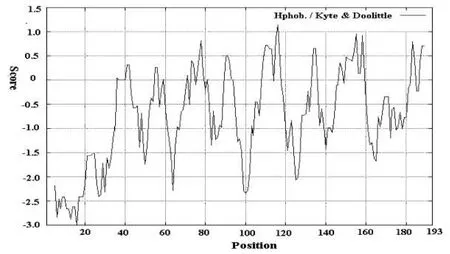
图3 鹅MYL1基因氨基酸亲疏水性图谱
2.3 鹅MYL1系统发育分析
通过DNAMAN软件进行序列比对发现,鹅MYL1基因CDS区序列与鸭同源性最高为98.28%,与哺乳类同源性在66%左右;进一步比对氨基酸序列,与鸭的氨基酸同源性高达100%,与哺乳类的MLC1f同源性在65%~69%,由于相差40个氨基酸残基,所以与哺乳类的MLC3f同源性较低,仅在55%左右(见表2).利用MEGA 4.1软件构建包括红原鸡、爪蟾、小鼠等9个物种的分子进化树.结果表明哺乳类聚成一支,鹅与鸭聚为一支,自展值为100(图5).不同物种MYL1系统发育与物种间的亲缘关系及形态分类基本一致.
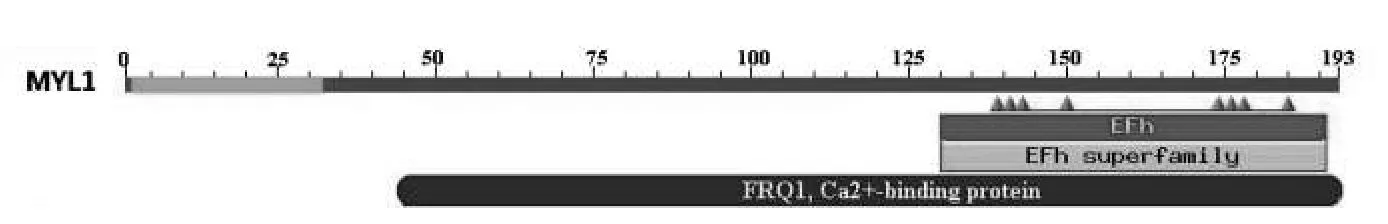
图4 鹅MYL1蛋白结构域的预测结果
2.4 鹅MYL1mRNA胚胎表达分析
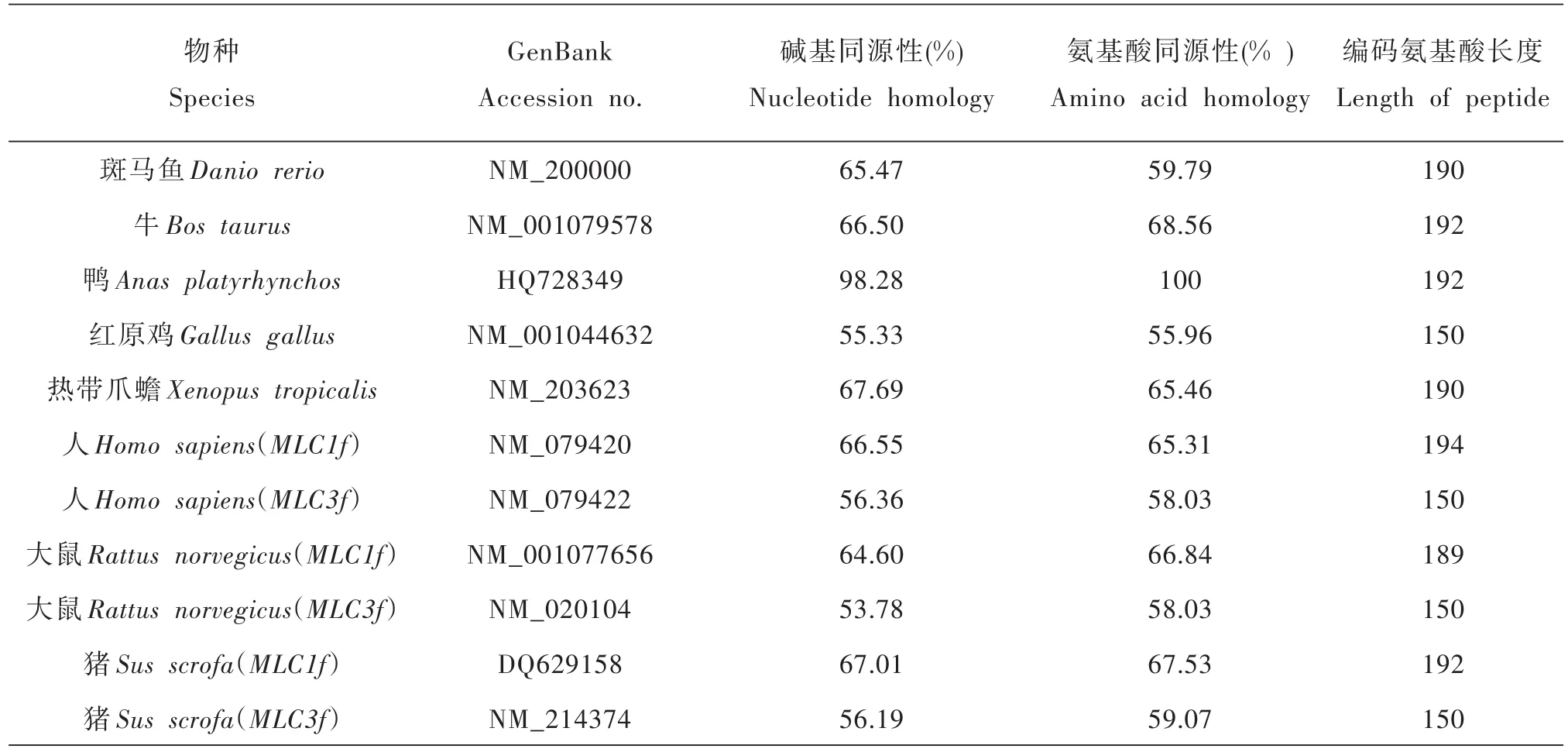
表2 鹅与其他物种MYL1基因编码区的同源性比较
实时荧光定量PCR分析表明,鹅胚胎期MYL1基因mRNA表达量总体呈现上升后下降的趋势,该基因在E7就有表达,E7以后表达量逐渐上升,在E18表达量达到高峰后下降(图6).通过SPSS软件进一步分析不同日龄的鹅胚腿肌MYL1基因mRNA的表达量,发现E18与E14、E28差异显著(P<0.05).
3 讨论
肌球蛋白轻链是肌球蛋白的一个亚基.肌球蛋白轻链拥有自己的肽链,这点与重链不同.它们不被包括在肌球蛋白家族中,但对形成肌球蛋白酶催化超分子复合体有重要作用.轻链基因有:MYL1、MYL2、MYL3、MYL4、MYL5、MYL6等基因,分ELC和RLC两种类型,不同的ELC和RLC的家族成员由多种基因编码,而且同型异构体可呈现出不同的表达谱.在哺乳动物ELC家族中,MYL1在快骨骼肌中表达;MYL3(ELCv)主要在心室和慢骨骼肌中表达;MYL4(ELCa)在胎儿和成体的心房以及骨骼肌中表达;MYL6在平滑肌中表达.在RLC家族中,MYL2(MLC2v or RLCv)在心室中表达,MYL7(MLC2a or RLCa)在心房中表达;MYL5在骨骼肌中表达;MYL9在平滑肌中表达.一般认为肌球蛋白轻链对肌肉的收缩有调节作用,但研究认为在横纹肌中这种调节作用很弱[10-11].
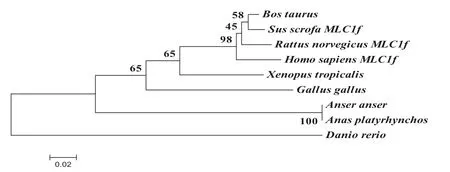
图5 不同物种推导的MYL1氨基酸序列构建的NJ树
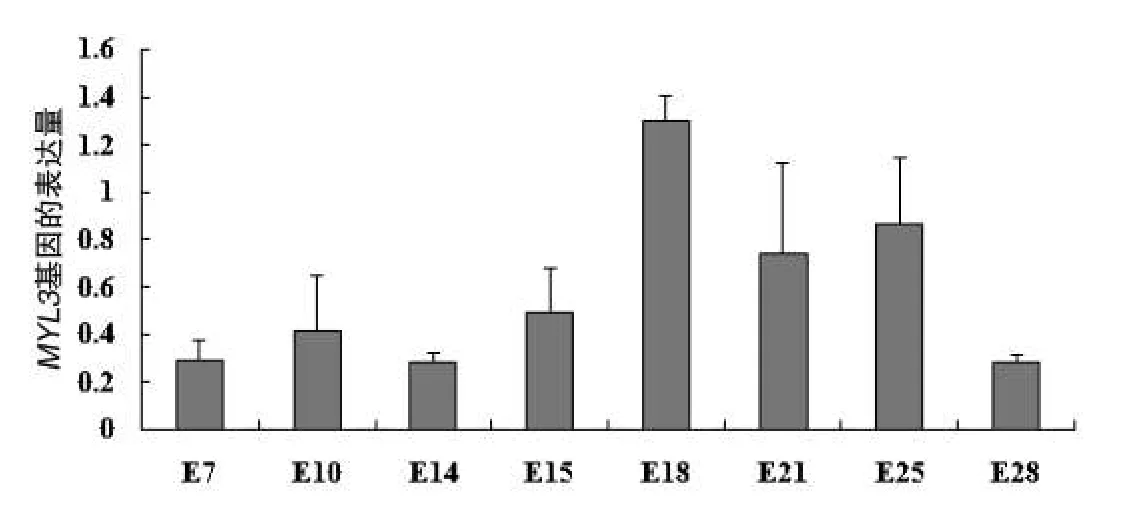
图6 鹅MYL1基因在不同胚胎发育时期腿肌中表达量
多个哺乳动物MYL1基因由不同的启动子调控,存在MLC1f和MLC3f两种异构体,并且这两种异构体出现在胚胎形成的不同时期中:在小鼠中,MLC1f转录体是从胚胎骨骼肌的分化时期(E9)开始积累,而MLC3f转录体从胚胎骨骼肌E13.5~E15时期开始大量积累[12].在小鼠的胚胎肌肉发育阶段,MLC1f、MLC3f表达方式是相互独立的,即在胚胎发育不同时期出现[13],并认为MYL1基因的表达是快肌纤维出现的特征[14].同样的发现MYL1基因在斑马鱼胚胎发育早期就有表达,早于其他已知快肌蛋白标志,并发现该基因的表达受到MyoD和Myf5基因的调控[15].Ling等鉴定了猪MYL1基因mRNA 5个选择性剪切体(MLC1f、MLC3f、MLC5f-A、MLC5f-B和MLC5f-C),并在猪背最长肌中首次鉴定出了MLC5f-A、MLC5f-B和MLC5f-C 3个新转录本,MLC1f、MLC3f在骨骼肌和心肌中高表达,而三个新转录本仅仅在骨骼肌中表达;发现除了剪切体MLC1f外,其余转录本的表达量均为随个体体重的增加而逐步增加,到成年时表达量迅速增至最高[7].
本研究通过RACE技术首次克隆获得鹅MYL1基因全长1542 bp的cDNA序列,包含582 bp的开放性阅读框,编码含193个氨基酸残基的蛋白质,碱基序列及蛋白质前体氨基酸序列与其他物种高度同源,并与MYL1f基因同源性更高,推测我们克隆的为MYL1f基因,至于鹅是否存在MYL3f基因有待于进一步研究.对鹅MYL1蛋白序列进行功能位点分析发现其编码氨基酸残基包含一个典型的EFh和FRQ1这两个结合钙蛋白保守结构域,推测MYL1基因与钙离子结合密切相关,是一种钙结合蛋白.通过荧光定量检测MYL1基因在不同发育时期腿肌中的表达量,发现该基因在胚胎早期就有表达,并在E18天表达量达到高峰.说明胚胎早期就有肌肉的形成和发育.
[1]Lagos-Quintana M,Rauhut R,Lendeckel W,et al.Identification of novel genes coding for small expressed RNAs[J].Science,2001,294(5543):853-858.
[2]Eisenberg E,Hill TL.Muscle contraction and free energy transduction in biological systems[J].Science,1985,227(4690):999-1006.
[3]Uyeda TQ,Abramson PD,Spudich JA.The neck region of the myosin motor domain acts as a lever arm to generate movement[J].Proc Natl Acad Sci U S A,1996,93(9):4459-4464.
[4]Nabeshima Y,Fujii-Kuriyama Y,Muramatsu M,et al.Alternative transcription and two modes of splicing results in two myosin light chains from one gen[J].Nature,1984,308(5957):333-338.
[5]Periasamy M,Strehler EE,Garfinkel LI,et al.Fast skeletal muscle myosin light chains 1 and 3 are produced from a single gene by a combined process of differential RNA transcription and splicing[J].J Biol Chem,1984,259(21):13595-13604.
[6]Robert B,Daubas P,Akimenko MA,et al.A single locus in the mouse encodes both myosin light chains 1 and 3,a second locus cor⁃responds to a related pseudogene[J].Cell,1984,39(1):129-140.
[7]Ling F,Fang W,Chen Y,et al.Identification of novel transcripts from the porcine MYL1 gene and initial characterization of its pro⁃moters[J].Mol Cell Biochem,2010,343(1-2):239-247.
[8]Hidaka K,Yamamoto I,Arai Y,et al.The MEF-3 motif is required for MEF-2-mediated skeletal muscle-specific induction of the rat aldolase A gene[J].Mol Cell Biol,1993,13(10):6469-6478.
[9]章双杰,郭军,汤青萍,等.太湖鹅种质特性[J].石河子大学学报:自然科学版,2009,27(2):7.
[10]Timson DJ.Fine tuning the myosin motor:the role of the essential light chain in striated muscle myosin[J].Biochimie,2003,85(7):639-645.
[11]Andruchov O,Andruchova O,Wang Y,et al.Dependence of cross-bridge kinetics on myosin light chain isoforms in rabbit and rat skeletal muscle fibres[J].J Physiol,2006,571:231-242.
[12]Lyons GE,Ontell M,Cox R,et al.The expression of myosin genes in developing skeletal muscle in the mouse embryo[J].J Cell Bi⁃ol,1990,111(4):1465-1476.
[13]Barton PJ,Buckingham ME.The myosin alkali light chain proteins and their genes[J].Biochem J,1985,231(2):249-261.
[14]Zammit PS,Cohen A,Buckingham ME,et al.Integration of embryonic and fetal skeletal myogenic programs at the myosin light chain 1f/3f locus[J].Dev Biol,2008,313(1):420-433.
[15]Burguiere AC,Nord H,von Hofsten J.Alkali-like myosin light chain-1(myl1)is an early marker for differentiating fast muscle cells in zebrafish[J].Dev Dyn,2011,240(7):1856-1863.
