肉鸡IGF-I基因mRNA的时空表达模式
2014-06-17顾海娟王星果王慧娟顾志良
顾海娟,王星果,王慧娟,邵 芳,顾志良
(常熟理工学院 生物与食品工程学院,江苏 常熟 215500)
动物的生长发育受体内外各种因素的作用,并由机体的神经内分泌系统的生长轴进行调控.生长轴是由“下丘脑—垂体—(生长激素)—靶器官”上有关激素及受体组成的神经内分泌轴.GH经血液循环运至靶组织或器官,通过两种方式发挥作用:一是直接作用,GH直接与细胞膜表面的生长激素受体(growth hor⁃mone receptor,GHR)结合,启动细胞内的信号转导机制,从而参与靶器官的代谢活动,调节生长发育;二是间接作用,GH先与靶细胞表面的GHR结合,作用于靶器官,产生类胰岛素生长因子(insulin-like growth fac⁃tors,IGFs),后者再通过内分泌、旁分泌或自分泌途径作用于肌肉和骨骼等靶器官,调节细胞的代谢,促进动物的生长发育[1].鸡的生长也不例外,同样依靠生长轴的作用来调节自身的生长.
类胰岛素生长因子,是生长激素产生生理作用过程中必须的一种活性蛋白多肽物质[2].IGF-I是一种含有70个氨基酸的碱性单链多肽,广泛存在于机体组织中,具有调节机体生长发育、生殖、免疫和机体代谢的功能[2].鸡IGF-I的一级结构首先由Rinderkneeht和Humkel(1978)阐明,与胰岛素49%同源[3].1996年,Klein等通过原位杂交和遗传连锁分析,将鸡的IGF-I基因定位在1号染色体的短臂近着丝粒处.Yoshitaka Kaji⁃moto等(1991)通过对鸡的IGF-I基因进行克隆和序列分析,发现其组成是4个外显子和3个内含子,长度为50 kb,且成熟的IGF-I多肽由外显子2、3编码,而外显子1、4分别编码N末端和C末端及一些非编码序列.因为选择性剪接和选择性加尾,鸡的IGF-I基因会产生两条不同的mRNA[4].
动物肌肉的生长发育与IGFs系统基因的时空特异性表达密切相关[5-7],但目前关于其发育表达模式的资料较少,肉鸡不同组织和肌肉、脂肪和肝脏IGFs基因表达的发育性变化模式还有待进一步探讨.对于IGFs发育表达模式的研究,将有助于了解动物生长过程中激素调控的本质.本实验选取不同发育时期的白羽AA肉鸡(八个不同发育阶段,各阶段3个样品,总共24个样品),通过实时荧光定量PCR技术来研究肉鸡IGF-I基因mRNA的时空表达特征.实验结果将为研究IGF-I基因在肉鸡发育过程中的调控机制提供资料,为揭示IGF-I基因在肉鸡早期生长发育中的功能奠定一定的基础.
1 材料与方法
1.1 实验样品
本研究采集出生后1日龄及1周龄、2周龄、3周龄、4周龄、5周龄、6周龄、7周龄的AA白羽肉鸡(每周龄分别选取三只样品鸡,总共24只样品鸡)胸肌、腿肌、脂肪、心脏、肝脏、脾、肺、肾、肠、腺胃、肌胃和脑12个组织样品,迅速置于液氮中速冻,并于-80℃冰箱中保存.用TRIzol试剂提取不同组织和不同发育时期肌肉、脂肪、肝脏的总RNA.
1.2 引物设计与合成
根据已经报导的鸡IGF-I和β-actin基因序列设计引物chiIGF1F1:5′-TTAACCAGTTCTGCTGCTGC-3′chiIGR1:5′-TGGTGTAAGCGTCTACTGCT-3′;dubactinqF:5′-CACGGTATTGTCACCAACTG-3′,dubactinqR:5′-ACAGCCTGGATGGCTACATA-3′.引物由上海生工生物工程有限公司合成.
1.3 IGF-I基因表达的实时荧光定量PCR检测
采用两步PCR法进行荧光定量PCR.对RNA样品首先进行逆转录反应,然后进行实时荧光定量PCR,反应体系:Power SYBR Green PCR Master Mix 10μl,正反向引物(10 μmol/L)各 1 μl,去离子无菌水6.67 μl,RT产物1.33 μl.反应条件为95 ℃ 10 min,95 ℃ 15 sec,60 ℃ 1 min,PCR扩增后进行熔解曲线分析,温度以0.5℃/30 S的速率从55℃缓慢递增到95℃.
1.4 数据收集和分析
本实验选择相对定量荧光PCR法,通过在不同组织中内标β-actin和目标基因IGF-1分别进行实时荧光PCR检测,测定其Ct值,根据相对实时荧光定量PCR 2-ΔCt值法,算出每个样品中IGF-1基因与β-actin基因表达的相对值.在Excel中作出IGF-1mRNA相对于β-actin表达量的柱状图.并用SPSS12.0进行显著性检验.实时荧光定量PCR结果用均值±标准差表示.
2 结果与分析
2.1 肉鸡IGF-I和β-actin基因的RT-PCR产物检测
随机选取总RNA样品,首先进行反转录反应,以获得肉鸡的cDNA,然后进行实时荧光定量PCR的预实验.即选用IGF-I、β-actin这两对引物,以反转录产物cDNA为模板,进行RT-PCR扩增,通过琼脂糖凝胶电泳来检测产物是否进行了特异性的扩增.经电泳发现扩增条带均位于DNA Marker 100~250 bp之间,且扩增条带大小与设计相符,说明目的基因得到了PCR扩增,而且产物特异性非常好,故可以用于荧光定量PCR检测.
2.2 肉鸡不同组织中IGF-I基因mRNA表达
IGF-I基因mRNA在4周龄肉鸡的12个组织中的表达呈现组织差异性.在肝脏中IGF-I基因mRNA表达量最高,显著高于其余11个组织的表达量;表达量次之的是肺,但其量相对于肝脏中的表达还是较少的;其次在胸肌、腿肌、心肌中的表达量均稍低于肺;在脂肪、脾、腺胃、肌胃、肠、脑中的表达量都很少,脂肪、脑中的表达量相对于脾、腺胃、肌胃、肠略高,在脾这些组织中表达极微量;而在肾脏中未检测到有IGF-I基因mRNA的任何表达.肝脏中IGF-I mRNA的表达与其余各组织的表达量均存在显著差异,说明其表达量显著高于其他组织.可知4周龄肉鸡的肝脏中大量表达IGF-I基因,这些高表达的IGF-I可以以内分泌、自分泌和旁分泌作用来调控肝脏的生长发育(见图2).
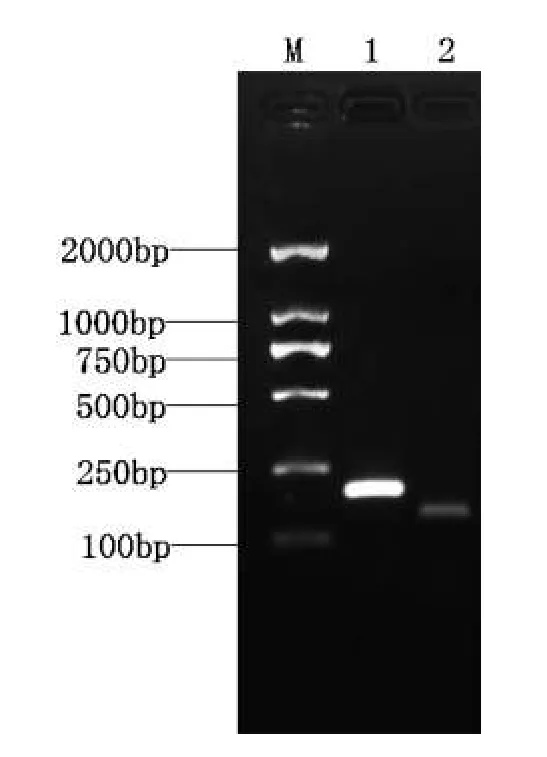
图1 IGF-I和β-actin的PCR扩增片段(M:DL-2000 DNA marker)
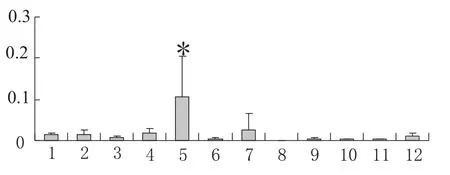
图2 鸡IGF-I基因的mRNA在12种不同组织的表达
2.3 肉鸡不同发育时期的IGF-I基因mRNA表达
各发育时期的腿肌中表达量最高的是6周龄;其次是4周龄,其表达量比6周龄时的表达略低;在1、3、5周龄时的表达量相近;在2周龄时的表达比在1、3、5周龄中的表达量少些;然后是7周龄时的表达,其又少于2周时期;出生后1日龄的个体表达量最少,呈微量.经显著性检验发现1日龄的表达量与3、4、6周龄时的表达量存在显著差异,7周与4、6周龄的表达量呈显著性差异.说明这些时期的表达量相差较大,IGF-I在不同时期腿肌的发育中均有着重要作用,见图3.
脂肪中3周龄个体的IGF-I基因mRNA表达量最高,明显高于其他各时期;4、5周龄的表达量相似,但5周时表达比4周时略高;其次是6周个体的表达,约是4周的1/2;而在7周时呈极微量表达.就整体趋势而言是随着年龄的增长其表达量而随之减少.3周与7周间的表达呈显著差异,3周的表达量显著高于7周.提示IGF-I对肉鸡脂肪组织的作用主要体现在发育早期,见图4.
图5显示肝脏中表达量最高的是3周龄的个体;其次是2周个体,其表达量比3周的略少;5周龄个体的表达量比2周龄少,表达量较中;4、6、7周龄个体的表达量相似,但是7周时比其他两个时期少;在1周龄时呈微量表达;而出生后1日龄时表达量呈极微量.在肝脏中IGF-I表达的整体趋势相近于刚出生时IGF-I mRNA的表达量,随年龄增大其表达量逐渐增加,但到一定时期其表达量又趋近平稳.与腿肌、脂肪的同一发育时期相比,其IGF-I基因mRNA的表达显著高于二者.肝脏中IGF-I基因mRNA发育性表达不表现显著差异.
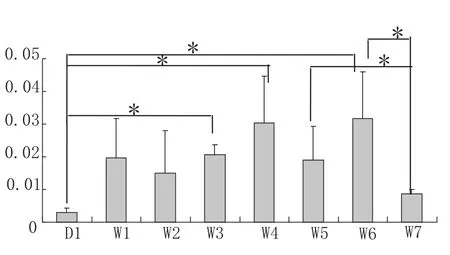
图3 腿肌不同发育时期IGF-I基因mRNA的表达量

图4 脂肪不同发育时期IGF-I基因mRNA的表达量
3 讨论
GH的重要调节作用,其除了与靶组织、器官的GHR结合而直接发挥其促生长作用外,还可以促进靶器官产生IGF-I.IGF-I以内分泌、旁分泌、自分泌的形式促进各组织器官的生长发育.同样,鸡的GH也需要与受体有效结合,并最终依赖IGFs的表达来实现其促生长作用.
从实验结果可知,4周龄肉鸡的12个不同组织中,肝脏的IGF-I表达量最高,与其余11个组织中的表达量均存在显著差异,说明肝脏是产生IGF-I的主要场所,是IGF-I发挥内分泌、自分泌、旁分泌的主要靶器官.除肝脏外,在胸肌、腿肌、脂肪、心肌、肺、脑中均有少量表达,而在腺胃、肌胃、肠中仅有微量表达,但在肾脏中没有表达.说明鸡个体的许多组织器官均可产生IGF-I,从而发挥其自分泌、旁分泌作用.
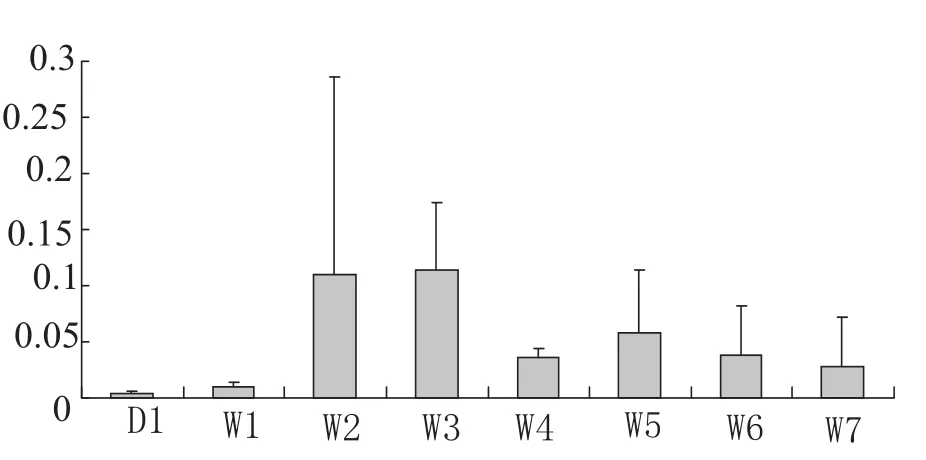
图5 肝脏不同发育时期IGF-I基因mRNA的表达量
IGF-I在肌肉中的过量表达可显著促进肌肉的生长发育,这已在转基因鼠和鸡上得到证实[8].本实验结果也显示IGF-I基因mRNA在腿肌中出生后表达量呈不同程度的增加,在六周龄时达到最大值,七周龄时开始下降.从出生后1周到6周,其IGF-I基因mRNA的表达量均较高,3、4、6周时表达量与刚出生1天的个体表达量出现显著差异,说明这些时期的肌肉生长需要大量的IGF-I作用.而该段时间也是鸡腿肌逐渐发育的时期,由此表明,在鸡腿肌发育较快时期,腿肌中IGF-I表达量也相应较高,说明IGF-I对腿肌的生长发育具有重要作用.这一结果与王勇生等在北京鸭胸肌中IGF-I的发育性表达变化研究结论相似[8].说明IGF-I对禽类的肌肉生长具有重要作用.Duclos(2005)发现鸡肌肉组织IGF-1的自分泌对其生长起主要作用.有研究发现,使用促进剂使IGF-I基因的表达仅限制在骨骼肌时,会出现显著的肌肉营养过剩现象,但体重与血清IGF-I浓度并未增加,表明局部产生的IGF-I可在动物生长调节中发挥重要作用[8].因此,推测鸡腿肌组织产生的IGF-1对鸡腿肌的发育也具有局部效应,其可以明显促进鸡腿肌的生长发育.
肝脏是IGF-I的主要分泌器官.IGF-I的表达量在出生早期较少,随年龄增大其表达量也逐渐增加,但到一定时期其表达量又趋近平衡,各时期的表达无显著差异,说明IGF-I在肝脏早期生长发育的各阶段均具有一定的作用.刘国庆等[9]在羔羊肝脏中对IGF-I和IGF-IR基因表达的发育性变化研究中得出的结论也是IGF-I的表达量先是随年龄的增大其量也增加,然后再逐渐下降,与本实验的研究结果相似.
体内和体外的实验均表明,IGF-I可能是脂肪细胞增殖和分化所必需的关键因子之一,IGF-I可能通过内分泌或(和)旁(自)分泌促进脂肪组织的发育[10].在鸡脂肪的不同发育时期IGF-I基因mRNA的表达量是随着周龄的上升而呈渐渐下降的趋势,7周的表达量与3周的量存在显著性差异,说明脂肪细胞的增值主要发生于生长早期.提示IGF-I主要在鸡生长发育的早期促进脂肪细胞的增殖和分化.这与周杰等[11]在二花脸和大白猪的脂肪组织中GHR、IGF-I和IGF-IR基因表达的发育性变化研究中的结果相同.
[1]姜树林,徐金先,胥清富.动物生长激素受体基因组织特异性表达及其调控[J].饲料研究,2006(5):21-23.
[2]聂庆华,张细权,杨关福.鸡生长轴相关基因的研究进展[J].农业生物技术学报,2003,11(3):305-312.
[3]魏笑笑,王宝维,王雷,等.鸡胰岛素样生长因子-1的研究进展[J].家禽科学,2007,11:43-45.
[4]丁艳,吴克安,禄文生,等.畜禽胰岛素样生长因子-1基因的研究进展[J].云南畜牧兽医,2009(增刊):107-109.
[5]Peng M,Pelletier G'Palin M F,Veronnean S,et al.Abribat Ontogeny ofIGFs and IGFBPs mRNA levels and tissue concentrations in liver,kidney and skeletal muscle of pig[J].Growth DevAging,1996,60(3-4):171-187.
[6]Tilley RE,McNeil CJ,Ashworth CJ,et al.Altered muscle development and expression of the insulin-like growth factor system in growth retarded fetal pigs[J].DomestAnim Endocrinol,2007,32(3):167-177.
[7]唐中林,李勇,邓宏,等.荧光定量PCR方法建立及其在中外猪胚胎骨骼肌中的表达[J].农业生物技术学报,2008,l6(2):202-207.
[8]王勇生,黄苇,侯水生,等.北京鸭IGF-l cDNA部分序列的克隆及其在胸肌组织表达的发育性变化[J].西北农林科技大学学报:自然科学版,2006,34(5):13-17.
[9]刘国庆,黄治国,刘振山,等.羔羊肝脏IGF-I和IGF-IR基因表达的发育性变化研究[J].中国农业科学,2006,39(12):2577-2581.
[10]Chen N X,Hausman G J,Wright J T.Influence of age and fetal by pophysectomy on porcine preadipocytes:insulin—like growth factor-I(IGF-I)response,receptor binding and IGF binding protein secretion[J].Growth Dev Age,1995,59:193-206.
[11]周杰,赵茹茜,韦习会,等.二花脸和大白猪的脂肪组织中GHR、IGF-I和IGF-IR基因表达的发育性变化[J].遗传学报,2003,30(7):657-662.
