鳡肌肉生长抑制素基因内含子和部分启动子序列的克隆与分析
2014-06-17郁建锋顾志良冯晓夏
郁建锋,顾志良,邵 芳,冯晓夏
(常熟理工学院 生物与食品工程学院,江苏 常熟 215500)
肌肉生长抑制素(Myostatin,MSTN)属于TGF-β(transforming growth factor β,转化生长因子β)超家族中的一个成员,最早在小鼠骨骼肌cDNA文库中被克隆的基因.利用基因敲除技术研究它的功能发现,MSTN基因敲除的鼠是正常野生型小鼠大小的2~3倍,其肌肉细胞增生、肥大,整个身体的骨骼肌量明显增加,表明MSTN在调控骨骼肌肉的生长发育中起着十分重要的作用[1-2].
鱼类MSTN的研究也越来越多,斑马鱼、虹鳟、大西洋鲑、金头鲷、罗非鱼[3]、鲤和鳡等鱼类中均克隆到MSTN基因.鱼类MSTN除在骨骼肌表达以外,还可在鱼类的其他多个组织如肝、心、胃、鳃、卵巢、精巢、肾、肌肉、眼和脑等中表达,与哺乳类的表达存在差异性.在抑制MSTN的功能抑制实验中发现斑马鱼胚胎发育过程中的肌肉发育和生长得到了提高,甚至引起肌肉增生或肥大[4].说明MSTN在鱼肌肉细胞的生长、发育也有着重要的作用,因此研究MSTN基因的结构和表达调控对渔业生产有重要意义.
鳡属鲤形目,鲤科,雅罗鱼亚科,鳡属,为江河、湖泊中大型经济鱼类之一.我们曾对鳡MSTN基因的研究发现,其在肌肉和脑中表达量最高,在心肌中也有较高表达,在肝脏、肠、鳃和肾等组织的表达不明显,表明鳡MSTN基因除对肌肉生长发育有调控作用以外,可能还存在其他生理功能[5],因此需对该基因的结构和调控作进一步的深入探讨,解析鳡MSTN的作用模式,克隆了该基因的两个内含子和启动子区,为其结构和表达特点的研究打下基础.
1 材料与方法
1.1 实验动物及总DNA提取
鳡由江苏省苏州市长江特色水产工程中心提供,取其肌肉,采用酚、氯仿法提取基因组DNA,保存于-80℃冰箱.
1.2 鳡MSTN内含子的扩增
通过鳡MSTN的cDNA序列和鲤鱼(Cyprinus carpio)MSTN的基因序列(GU014395.1)的比对,分别在鳡MSTN 两个内含子上 下游的外显子上 设计引 物 gynhza5:5′-AACATGCCACCACAGAGACC-3′,gynhza3:5′-GGTTCGCTTGGATTTTCGGAC-3′;gynhb5:5′-CGTCTTGGCAGAGTATAGAC-3′,gynhzb3:5′-GGCCCTCT⁃GAGATTTTCACC-3′.用此两对引物进行PCR扩增鳡MSTN基因的内含子1和2,反应体系:10×PCR buffer 2.5 μL,10 mmol/L dNTP Mixture 2 μL (2.5 mmol/L each),10 μmol/L 引 物 gynhza5/3 和 gynhzb5/3 各1μL,rTaq(5 U/μL)0.2 μL,1 μL基因组DNA,ddH2O 17.3 μL;PCR程序:94 ℃预变性5 min;94 ℃×35 sec,58℃×35 sec,72℃×1.5 min,共35个循环;72℃延伸10 min.扩增产物在0.8%的琼脂糖凝胶中电泳检测,胶回收目的片段,并克隆入pMD19-T后测序(上海桑尼生物公司测序).
1.3 染色体步移法扩增鳡MSTN基因的启动子
根据已获得的鳡MSTN基因序列设计三个特异性引物gympy1:5′-GAGCCTGTTTGAGTCG⁃GAGTTTG-3′,gympy2:5′-TGGTCATGATGGTCTCTGTGGTG-3′,gympy3:5′-GTGCGCCGTTATATCTCCAT⁃TACC-3′.然后与Genome Walking Kit(TaKaRa)提供的4条兼并引物对鳡基因组进行染色体步移扩增MSTN 5′末端未知片段,按照试剂盒程序进行,分别以3条特异性引物与4条兼并引物对鳡基因组进行4个平行的3次巢式PCR,将第三次获得的特异性条带克隆入pMD19-T后测序鉴定(上海桑尼生物公司测序).
1.4 序列分析
应用BLAST工具将获得的鳡MSTN基因的内含子在线进行同源性比对分析,结合DNAMAN5.0软件进行物种间的同源性比对.同时采用在线启动子转录调控元件分析软件TRANSFAC AliBata2.1(http://www.gene-regulation.com/pub/programs.html#alibaba2)[6]对所获得的鳡MSTN启动子序列的结构进行分析预测,获得鳡MSTN启动子区潜在的转录因子结合位点.
2 结果
2.1 鳡MSTN内含子序列的扩增结果
以两对引物gynhza5/3和gynhzb5/3对鳡基因组进行PCR扩增,经0.8%的琼脂糖凝胶电泳分析,分别在900 bp和1200 bp位置扩增到两条特异性条带(见图1),与预期所要扩增的片段长度基本一致,对片段回收克隆测序,经序列比对确认为这两个片段内包含了鳡MSTN的两个内含子序列.
2.2 鳡MSTN内含子序列分析

图1 鳡MSTN基因内含子序列的PCR扩增结果(M:DL-2000 DNA marker)
与鳡MSTN cDNA的序列比对分析发现,内含子1全长为789 bp,A/T和G/C的碱基组成分别为66.7%与33.3%;内含子2全长为987 bp,A/T和G/C的碱基组成分别为65.0%与35.0%.将鳡MSTN基因内含子1、2以DNAMAN5.0软件分别与其他参照物种的MSTN基因内含子1、2进行比对分析(结果见表1).鳡MSTN内含子与鲤科鱼类的同源性都相对较高,且鳡MSTN基因内含子1与鲤鱼MSTN1a的同源性最高(67.21%);内含子2与鲤鱼MSTN的同源性最高(51.21%).鳡与其他鱼类、鸟类以及哺乳类的同源性都较低;且在比对时发现各种内含子的两端没有广泛的序列同源性(数据未列出).对这25个物种的MSTN内含子剪切位点保守性分析的结果显示,两个内含子的两侧边缘分别起始于二核苷酸GT,终止于二核苷酸AG(遵循内含子剪接的GT-AG规则),且第4个核苷酸位点上的碱基都为A.统计得到内含子1剪切位点边缘序列为:G100T100A72A100G92T80……Py100NC72A100G100;内含子2剪切位点的边缘序列为:G100T100G76A100G100C52……Py96NC88A100G100.
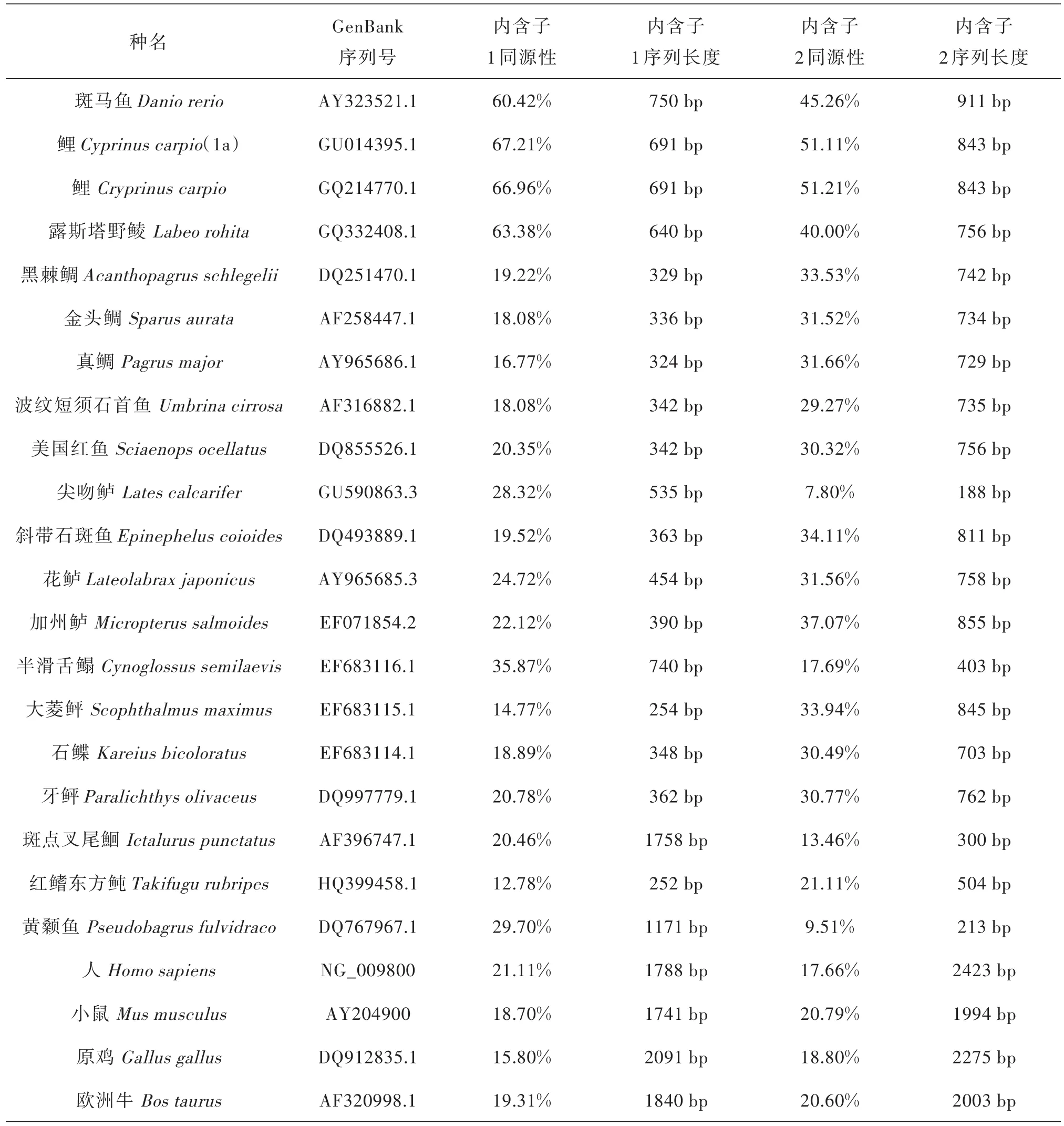
表1 鳡MSTN基因内含子的同源性比较
2.3 鳡MSTN启动子序列分析
利用染色体步移技术从鳡基因组中克隆了一段约662 bp 的序列,应用Blast在线比对确认该片段为MSTN启动子的部分序列,通过与蓝黑鲮(Labeo calbasu)(HQ850574.1)、卡特拉魮(Catla catla)(HQ850575.1)、缨野鲮(Labeo fimbriatus)(HQ850576.1)的MSTN基因比对确定了鳡MSTN基因的转录起始位点(TSS),并结合TRANSFAC对此序列进行启动子结构特征分析预测.结果显示,鳡MSTN基因转录起始点上游的-31~-26、-230~-225有两个潜在TATA框(即TBP结合位点),在-75~-70和-437~-428存在2个可能CTF结合位点,在-192~ -182、-283~ -274、-313~ -303、-322~-313、-373~ -364、-418~ -410、-556~ -547和 - 573~-564存在8个潜在CCAAT框/增强子结合蛋白α(CCAAT/%enhangcer bingding protein,C/EBPα)作用位点,在-126~-117有一个潜在的C/EBPβ结合位点,-25~-17有一个潜在C/EBPγ结 合 位 点 ,在 -173~-159、-564~-555和-600~ -591有3个激活蛋白1(stimulato⁃ry protein 1,SP1)结 合位点 ,-150~ -141和-287~-278存在2个激活蛋白(activator protein 1,AP1) 结 合 位 点 ,在-202~-197、-280~-275和-451~-446存在3个E-box元件.在克隆得到的这个片段中还预测到了其他转录因子结合位点:4个 Oct1、2个 GATA、2个 HNF1、1个HNF-3、1个NF-κB和1个CREB(见图2).
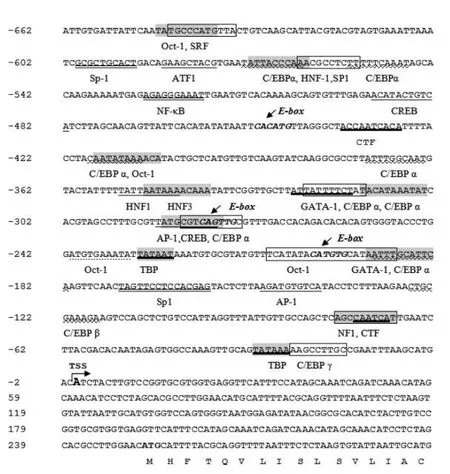
图2 部分鳡MSTN基因启动子序列分析结果
3 讨论
通过在鳡MSTN基因的外显子1、2和外显子2、3设计的两对特异性引物,成功克隆出了该基因的内含子1、内含子2的序列.鳡MSTN基因内含子1、2分别与其他物种MSTN基因相应内含子序列进行同源性比对分析,结果发现不同物种的内含子长短不一,差异显著.核苷酸的同源性与鲤科鱼类MSTN基因内含子1、2的同源性都较高(分别为60.42%~67.21%、40.00%~51.21%),与其他物种的同源性较低,这与传统分类法将鳡分为属鲤科类的结果是相一致的.同时还发现鳡、斑马鱼、鲤和露斯塔野鲮四种鲤科鱼类的MSTN基因内含子1、内含子2序列在不同位点存在缺失差异性,其中斑马鱼MSTN基因内含子2在912~1000 bp处存在大片段的缺失,露斯塔野鲮MSTN基因的内含子1、2都存在多处片段不同程度的缺失,它们虽然同属鲤科,但MSTN内含子序列的差异还是比较明显的,这应该与内含子在物种进化过程中突变后所受到的选择压力相对较小有关.这些结果表明,MSTN基因的内含子的同源性分析在鱼类的分类中可能具有一定的辅助参考意义.尽管MSTN基因内含子在不同物种间的差异非常明显,但是其被加工剪接的信号却相对比较保守.在所分析的这25个物种中,MSTN基因内含子1、2的剪切都起始于GT,终止于AG.统计得到MSTN基因内含子 1、2的边界序列为 G100T100A72A100G92T80……Py100NC72A100G100、G100T100G76A100G100C52……Py96NC88A100G100.这为MSTN的mRNA精确加工成熟提供了重要保证.同时分析还发现在鳡MSTN基因的2个内含子中存在多个潜在TATA启动子框,这些序列可能在鳡MSTN基因的转录调控中有一定的存在意义,同样有助于基因的转录起始[7-9].
利用染色体步移技术在从鳡基因组中克隆获得了662 bp的MSTN基因转录上游序列,通过在线比对分析确认此序列为鳡MSTN基因启动子的部分序列.利用在线Blast和TRANSFAC AliBata2.1软件对该片段进行启动子结构特征预测分析,确定了转录起始位点.鳡MSTN基因的转录起始点的上游-31~-26、-230~-225各存在1个潜在TATA框(即TBP结合位点),具有典型的TATA框,与-75~-70存在的CTF作用位点保证了该基因能被有效、正确地转录起始.这一启动子片段还存在了10个CCAAT box(8个C/EBPα作用位点、1个C/EBPβ和1个C/EBPγ),C/EBP作用涉及细胞的生长、分化、新陈代谢和机体免疫,其中C/EBPβ可以与CREB和NF-κB或其他转录因子相互作用对基因的转录产生反式激活作用[9].在所克隆的鳡MSTN基因的启动子的部分序列也预测到了CREB和NF-κB的作用位点,推测这几个预测的潜在转录因子结合位点在鳡MSTN基因的转录调控中可能有着重要作用.Oct1是PUO家族的一员,其作用于“ATTTG⁃CAT”序列位点,能与Sp1和TBP相互作用,调控基因的转录起始[10-11].所以此研究中鳡MSTN启动子部分序列中所预测到的4个Oct1作用位点可能含有对其转录起始调控起重要作用的1个或几个Oct1位点.在所克隆的鳡MSTN基因的上游调控序列中还发现了3个E框元件,其是Myogenic regulatory factor(MFR)的结合基序,是肌肉特异性基因较为普遍存在的元件,这3个E框与所预测的如AP1、C/EBP、NF-κB、Oct1和Sp1等在鳡的肌肉生长应答中可能发挥着重要作用[12].
综上所述,本实验研究克隆了鳡MSTN基因的内含子1、2和启动子的部分序列,这为进一步分析鳡MSTN基因的转录机制、分子调控机理、鳡生长发育机理等奠定基础,并对鳡的繁殖和育种工作有着重要的指导意义.
[1]Westhusin M.From mighty mice to mighty cows[J].Nat Genet,1997,17(1):4-5.
[2]Lee SJ,McPherron AC.Myostatin and the control of skeletal muscle mass[J].Curr Opin Genet Dev,1999,9(5):604-607.
[3]Gregory D J,Waldbieser G C,Bosworth B G.Cloning and characterization of myogenic regulatory genes in three Ictalurid species[J].Animal Genetics,2004,35:425-430.
[4]Acosta J,Carpio Y,Borroto I,et a1.Myostatin gene silenced by RNAi show a zebrafish siant phenotype[J].J Biotechnol,2005,119(4):324-331.
[5]郁建锋,张营,顾志良,等.鳡肌肉生长抑制素(MSTN)基因的克隆及其组织特异性表达分析[J].水产学报,2010,34(10):1486-1493.
[6]候琳,朱云平,邓明华,等.转录因子结合位点生物信息学研究进展[J].遗传,2009,31(4):365-373.
[7]Salgueiro S,Piguocchi C,Parry M A J.Intron-mediated gusA expression in tritordeum and wheat resulting from particle bombard⁃ment[J].PLANT Molecular Biology,2000,42:615-622.
[8]Scieglinska D,Wildak W,Konopka W,et al.Structure of the 5'region of the HST70 gene transcription unit:presence of an intron and multiple transcription initiation sites[J].Biochemical Journal,2001,359:129-137.
[9]Dipak P,RAMJI,Pelagia FOKA.CCAAT/enhancer-bingding proteins:structure,function and regulation[J].Biochem J,2002,365:561-575.
[10]Anne-Christine Ström,Maud Forsberg,Gunnar Westin,et al.The POU domains of the Oct1 and Oct2 transcription factors mediate specific interaction with TBP[J].Nucleic Acids Res,1994,22(9):1655-1662.
[11]Gunther M,Laithier M,Brison O.A set of proteins interacting with transcription factor Sp1 identified in a two-hybrid screening[J].Mol Cell Biochem,2000,210(1-2):131-142.
[12]顾志良,卢祥云,李辉,等.鹅肌肉生长抑制素基因5′-调控区序列特征和组织表达分析[J].畜牧兽医学报,2008,39(11):1606-1611.
