四鳃鲈内脏组织细胞原代培养
2014-06-17殷苏绿杨燕男徐宏博徐献民张志勇徐建荣
殷苏绿,杨燕男,徐宏博,徐献民,张志勇,常 娥,何 丹,徐建荣
(1.常熟理工学院 生物与食品工程学院,江苏 常熟 215500;2.江苏省海洋水产研究所,江苏 南通 226007;3.南通大学医学院,江苏 南通 226001)
鱼类细胞体外离体培养始于20世纪60年代[1],Wolf等1962年首次建立广温性鱼类细胞系[2],我国在上世纪80年代始先后建立了淡水鱼如南方鲶[3]、草鱼[4]、淡水白鲳[5]、鲤[6]和鲫[7]等的细胞系,鱼类细胞系的建立为鱼类病毒生物学、免疫学、遗传学和细胞生物学等研究提供了理想的体外研究体系.
四鳃鲈(Trachidermus fasciatus),别名松江鲈、媳妇鱼、花鼓鱼等,是东亚暖温带沿海的降河性洄游鱼类,在我国渤海、黄海及东海沿岸均有分布,性成熟亲鱼在海水中繁殖、幼鱼洄游至淡水水域生长育肥,当年繁殖的幼鱼年底可达到性成熟,亲鱼繁殖后大部分死亡.四鳃鲈个体虽小,但肉质鲜美,营养丰富,被誉为中国“四大淡水名鱼”之一,曾作为我国国宴上的美味佳肴招待外国政要.
四鳃鲈对生长环境条件要求较高,尤其对溶解氧及水质要求高,近年来,由于环境污染及水利工程建设等因素,严重影响了四鳃鲈的洄游,导致四鳃鲈在中国的分布区急剧缩小,且现有种群的数量亦有逐年下降的趋势.目前我国国内只有辽宁、河北、山东等地少数区域有野生四鳃鲈分布,其中只有辽宁省丹东市境内的四鳃鲈尚有一定数量的种群分布,其他水域数量较少,长江流域几乎绝迹[8-10].四鳃鲈的天然资源已经进入了濒危状态,1988年四鳃鲈已被列为国家二级保护对象,同年被列为“鱼类优先保护种名录”一级十个物种之一[11],因此有必要对四鳃鲈进行更深入的研究,确实保护四鳃鲈种质资源.鱼类细胞培养是进行鱼类研究和种质资源保护的有效途径,目前对四鳃鲈细胞培养研究较少,王丹生对四鳃鲈鳍细胞进行了体外培养的试验[12],对四鳃鲈鳍条体外培养条件进行了初步探索,但对四鳃鲈内脏组织体外培养未见报道.本研究以四鳃鲈内脏组织为材料进行原代细胞培养,探索保护四鳃鲈种质资源和进行四鳃鲈研究的有效方法.
1 材料与方法
1.1 实验材料
1.1.1 材料来源
实验材料为人工养殖的四鳃鲈幼鱼,幼鱼体长为5~7 cm,体重2~3 g,由常熟理工学院长江特色水生生物实验室提供.
1.1.2 材料处理
实验前用含青链霉素抗生素(0.28%)的无菌水暂养实验用鱼24 h,备用.
1.2 试剂
青链霉素抗生素(hyclone)、鼠尾胶原(sigma)、碱性成纤维生长因子(GIBCO)、澳洲胎牛血清(GIBCO)、培养基DMEM(GIBCO)、M199(GIBCO)、0.25%胰酶(GIBCO)、PBS(pH=7.4)由苏州辉博生物公司提供.
1.3 培养基
1.3.1 组织取材
先将鱼置于0.1%KMnO4中浸泡30 min,用无菌棉签擦净实验用鱼表面的粘液,解剖鱼体,取鱼体的肾脏、肝脏、心脏、脾脏,用添加青链霉素抗生素(0.28%)的PBS冲洗3次,然后转入基础培养基中漂洗3次,备用.
1.3.2 原代培养
采用组织块培养法:将已处理的四鳃鲈内脏组织转入到添加培养基(10%FBS)的培养皿中,剪成1 mm3小块,培养前将1 mm3的组织块取出并均匀地接种于25 cm2培养瓶底壁,接种培养瓶分别置于5%的CO2培养箱和无CO2培养箱.27℃恒温培养6 h后,添加5 mL培养基(10%FBS),轻轻翻瓶,使组织块浸没于培养基中,继续培养,3 d更换培养基一次.
1.3.3 不同培养条件实验(见表1)
实验材料为四鳃鲈内脏组织,每组实验设3个平行,每3 d更换培养基,实验周期为9 d.
1.4 培养细胞的活体观察
在倒置显微镜下对原代细胞进行活体观察、摄影记录其生长状况及形态特征.

表1 不同培养基条件
2 结果
2.1 原代培养
在27℃培养条件下,四鳃鲈内脏组织(以肝细胞为例)接种后3~5 h均有细胞迁出,并向外周迁移和伸展,外缘细胞贴壁(图1).迁出的细胞大都呈圆形,胞浆透明,培养初期(10~18 h)生长晕内侧极其透明,细胞之间的界限难以观察清楚.而在生长晕外侧,由于细胞迁移迅速,彼此间距增大,细胞界限渐变为清晰,生长晕边缘不甚整齐,2~3 d后随着细胞的增殖,生长晕边缘逐渐圆滑(图2).4~5 d后内脏细胞迁移形成的生长晕扩展迅速.6 d后,生长细胞汇合,镶嵌状排列,并有接触抑制现象,此时细胞生长集落占瓶底2/3(见图3).在原代培养中,观察到生长晕均由圆形细胞组成.
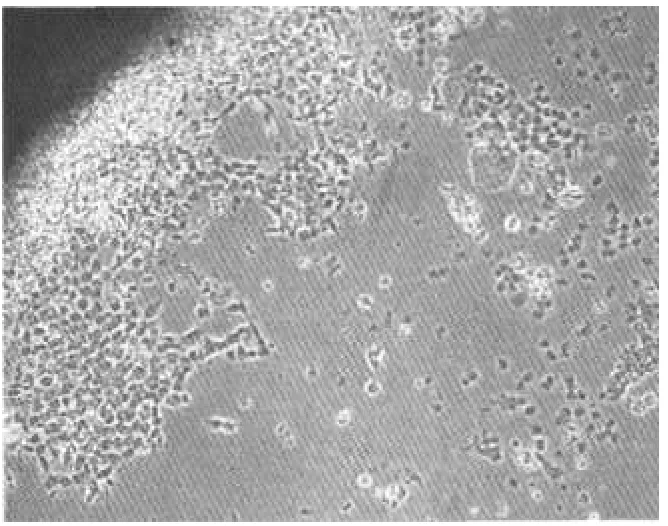
图1 3~5 h细胞贴壁生长
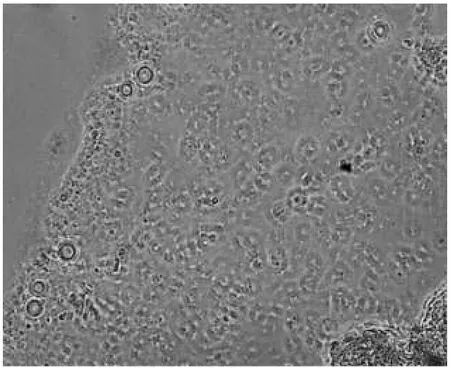
图2 2~3 d细胞生长晕
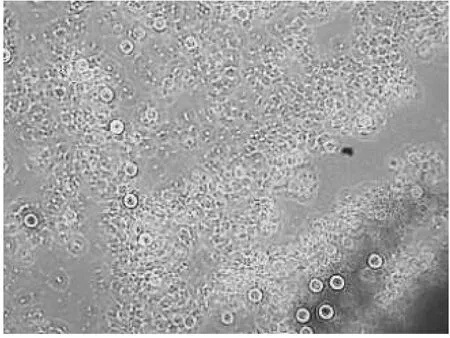
图3 6 d细胞生长集落汇合
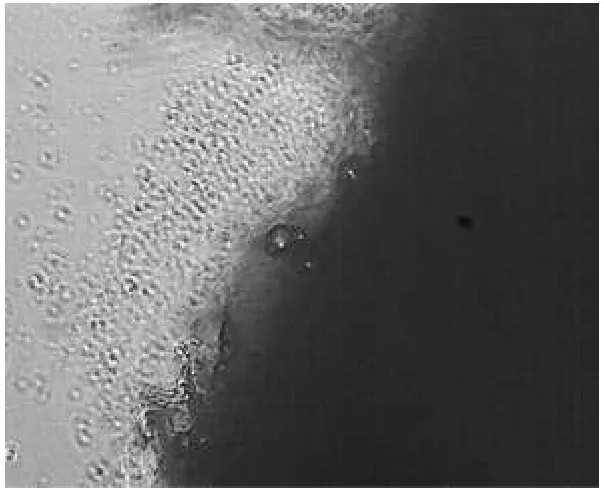
图4 DMEM下a培养基条件
2.2 不同培养条件实验
以肝细胞为例,在DMEM下a培养基条件下的细胞生长良好(图4),b培养基条件下的细胞生长较弱(图5),c培养基条件下的细胞生长中等(图6、表2).
在M199下a培养基条件下的细胞生长良好(图7),b培养基条件下的细胞生长较弱(图8),c培养基条件下的细胞生长中等(图9、表3).
比较可得,采用M199,添加青链霉素抗生素(0.28%)及10%小牛血清和1%碱性成纤维生长因子,pH值调整为7.2~7.4的培养基,在CO2培养箱中进行培养的内脏组织细胞繁殖最快.
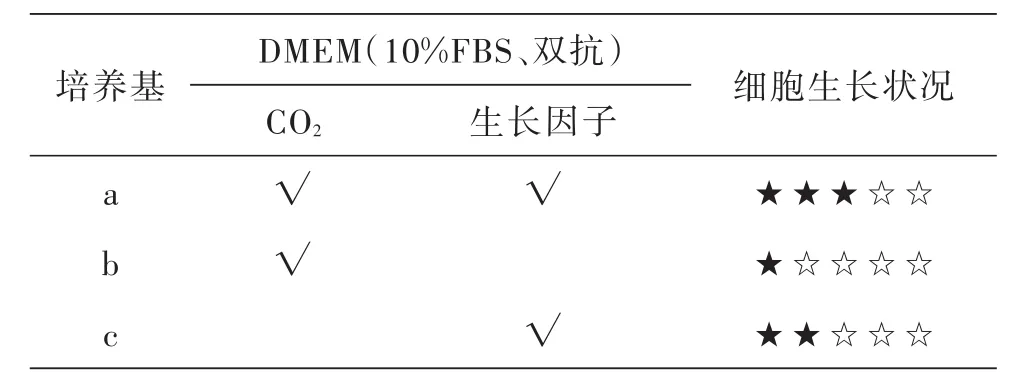
表2 在DMEM培养基不同培养条件下肝细胞生长情况比较
2.3 不同内脏组织细胞生长情况比较
将四鳃鲈的肝脏、肾脏、脾脏、心脏分别取出来,置于相同的培养条件 下 [M199(10%FBS、双抗、生长因子)]进行培养,一个周期后,肝脏组织迁出的细胞生长旺盛,呈圆形排列紧密(图10),心脏组织迁出的细胞生长较旺盛,呈纤维状向外围扩散(图11),肾脏组织迁出的细胞生长良好,呈不规则状,绕组织块周围零散分布(图12),脾脏组织迁出的细胞生长较弱,有细胞迁出,但生长晕较小(图13、表4).

图5 DMEM下b培养基条件
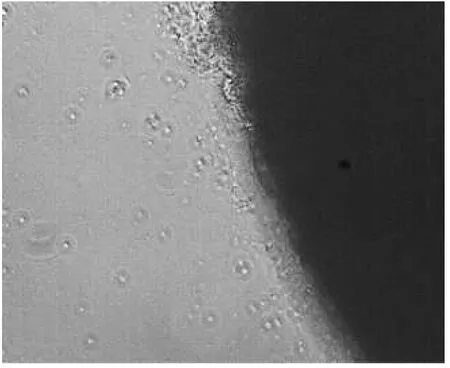
图6 DMEM下c培养基条件
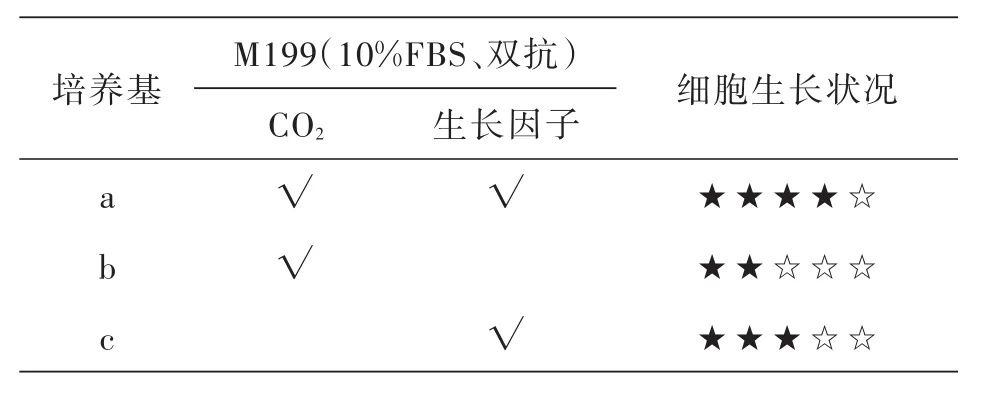
表3 在M199培养基不同培养条件下肝细胞生长情况比较

表4 相同条件下不同组织细胞生长情况比较
3 讨论
3.1 实验材料选择与处理
实验用鱼不宜过大(老),应选处于生长期的幼鱼,幼鱼机体生长代谢旺盛、细胞分裂速度快,细胞培养容易获得成功.实验用鱼解剖之前先用双抗水静养一天后抽血,并放净内脏组织中的血液,以减少血细胞对组织培养的影响.
无菌处理是动物组织细胞培养的关键,采用青链霉素抗生素对实验鱼进行预处理既能达到杀菌的目的,又可以减少后续步骤的染菌机会.青霉素是能破坏细菌的细胞壁并在细菌细胞的繁殖期起杀菌作用的一类抗生素,而链霉素与结核杆菌菌体核糖核酸蛋白体蛋白质结合,起到干扰结核杆菌蛋白质合成的作用,从而杀灭或抑制结核杆菌生长.同时在实验前用0.1%KMnO4浸泡30 min也是为了在不影响实验鱼活力的情况下对鱼进行活体消毒杀菌,防止培养用材料被细菌感染.本试验表明:用5~7 cm长幼鱼,经消毒杀菌处理和无菌操作,在M199培养基中添加青链霉素抗生素(0.28%)及10%小牛血清和1%碱性成纤维生长因子,控制培养温度为27℃、pH值为7.2~7.4,CO2浓度为 5%的 CO2培养箱中进行培养的内脏组织细胞繁殖最快.
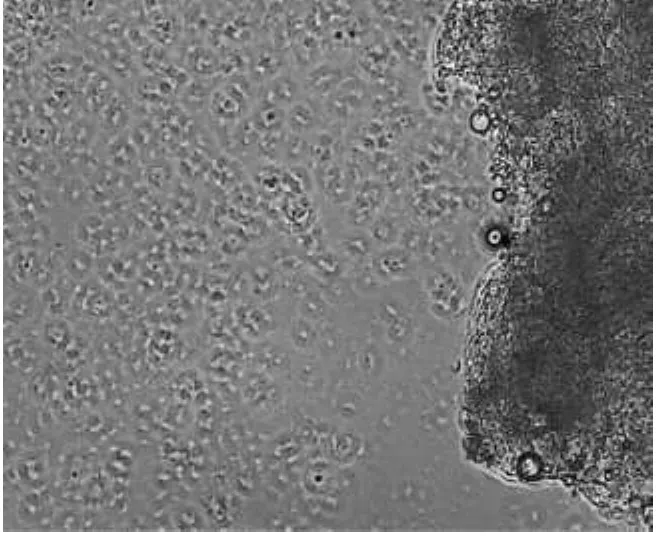
图7 M199下a培养基条件

图8 M199下b培养基条件
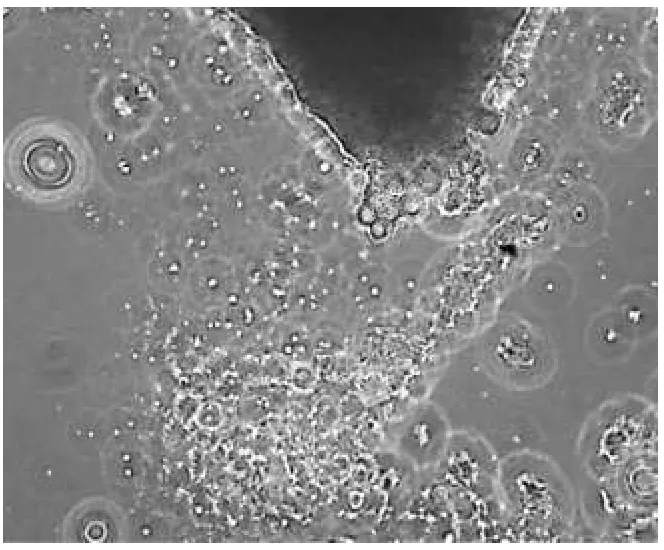
图9 M199下c培养基条件

图10 肝脏组织迁出的细胞
3.2 离体细胞原代生长特征
进行鱼类组织培养时,大多采用哺乳动物的方法[2,13].经本实验证实,采用组织块法能成功培养四鳃鲈的内脏组织细胞,表明此法对四鳃鲈这四种内脏细胞培养是适用的.在此培养条件下,组织块法更易获得原代培养细胞,由于组织块的存在,使培养环境与整体动物的生理环境更相近,从而有利于离体细胞的生存和增殖[14].
四鳃鲈心脏、肝脏、脾脏、肾脏4种组织在27℃、M199(10%FBS)条件下均表现出了不同程度的生长.肝脏、心脏细胞迁出时间分别为3~5 h、10~12 h,形成生长晕的时间分别为5 d和6 d,生长晕直径都可达5 mm左右.生长因子在实验中起到了重要的作用,避免了心脏和肾脏细胞迁出需要经过的潜伏期[15].
3.3 离体细胞形态特征
心脏组织在培养周期内,细胞呈纤维样,立体感强、透明.肝脏组织在培养周期内,细胞形态极为相似,种类单一,均为圆形样,细胞排列紧密、整齐.脾脏组织在培养周期内,细胞多圆球形,少数呈分叉的多枝形和针形.
肾脏细胞与上述三种细胞的组成不同,心、肝、脾这三种组织的细胞在培养周期中几乎只有一种细胞类型,而肾脏组织迁出的细胞出现了两种细胞类型:一种是呈紧密排列状的小型透明细胞,另一种略大,排列疏松.从同一块组织上长出不同的细胞生长晕的现象意味着这些细胞可能是来自同一组织的不同组成部分[16].
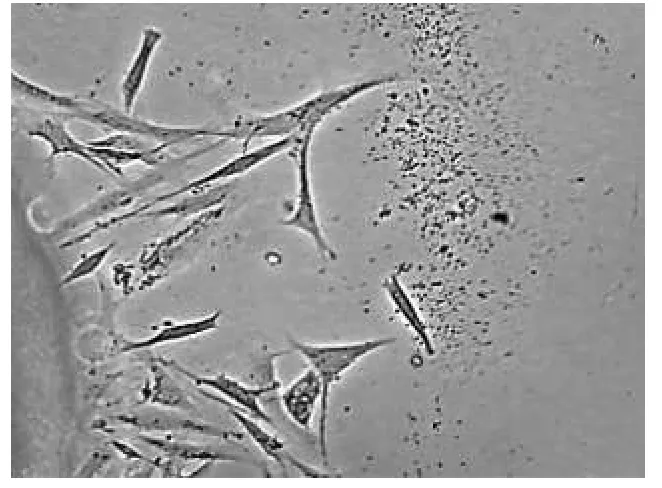
图11 心脏组织迁出的细胞

图12 肾脏组织迁出的细胞
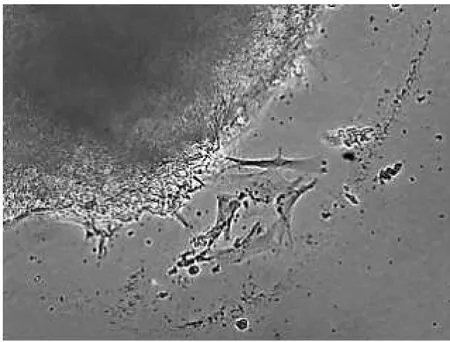
图13 脾脏组织迁出的细胞
[1]钱华鑫,张四明.鱼类细胞培养在渔业科学上的应用[J].淡水渔业,1991(5):40-42.
[2]Wolf K,Quimby M C.Established eury eurythermic of fish cells in vitro[J].Science,1962,135:1065-1066.
[3]洪锡钧,王明权.南方鲶SME2I细胞系的建立及其生物学特性的研究[J].西南农业大学学报,1995,17(5):419-422.
[4]张奇亚,李正秋,袁秀平.草鱼椎骨间质细胞的培养[J].水生生物学报,2000,24(5):567-569.
[5]张铭,陈荪红,赵小立.淡水白鲳细胞建系及其生长温度特性的研究[J].生物工程学报,2001,17(1):105-108.
[6]耿波,梁利群,孙效文.鲤鱼血淋巴细胞培养及染色体制备条件探索[J].水产学杂志,2003,16(2):32-34.
[7]陈敏容,陈宏溪,易詠兰.鲫鱼异倍体细胞系的建立及生物学特性[J].水产学报,1985,9(2):121-130.
[8]王金秋,成功,唐作鹏.鸭绿江流域中国境内四鳃鲈的分布[J].复旦学报:自然科学版,2001,40(5):471-476.
[9]王武,刘利平,毕永红.四鳃鲈鱼(Trachidermus fasciatus)的研究进展[J].水产科技情报,2001,28(3):124-129.
[10]王金秋.四鳃鲈鱼的生态学和繁殖生物学的研究进展[J].水生生物学报,1999,23(6):729-734.
[11]乐佩琦.中国濒危动物红皮书·鱼类[M].北京:科学出版社,1999.
[12]王丹生,李娟,王旭.松江鲈鳍细胞体外培养的实验研究[J].辽东学院学报:自然科学版,2011,18(3):194-197.
[13]孔祥婷.黄颡鱼细胞培养研究[D].苏州:苏州大学,2009.
[14]Clem LW,Moewus L,Sigel MM.Studies with cells from marine fish in tissue culture[J].Proc Soc Exp Biol Med,1961,108:762-766.
[15]张念慈,杨广智.草鱼吻端组织细胞株ZC-7901及其亚株ZC-7901S1的建立[J].实验生物学报,1981,14(1):101,109.
[16]吴政安.两栖类的组织培养[J].动物学报,1978,24(2):107-116.
