sTn在子宫内膜癌组织中的表达及临床意义*
2014-06-15陈秀芹郭尚云付建红翟旭华杨晓辉
郭 琦 陈秀芹 郭尚云 付建红 翟旭华 杨晓辉 孟 芳
sTn在子宫内膜癌组织中的表达及临床意义*
郭 琦 陈秀芹△郭尚云 付建红 翟旭华 杨晓辉 孟 芳
目的 研究肿瘤相关糖抗原sTn在子宫内膜癌、子宫内膜非典型增生、良性子宫病变患者子宫内膜组织中的表达情况,分析其与子宫内膜癌患者手术病理分期、病理分级等的关系及临床意义。方法采用免疫组化方法检测sTn在子宫内膜癌组(93例,包括子宫内膜样癌80例,浆液性乳头状癌10例,透明细胞癌3例)、子宫内膜非典型增生组(50例)、子宫良性病变组(50例)子宫内膜组织中的表达。结果sTn在子宫内膜癌组的阳性率为73.1%,与子宫内膜非典型增生组(32%)和良性子宫病变组(14%)差异均有统计学意义(P<0.017);sTn在子宫内膜样癌组织中表达率为78.8%,明显高于在其他组子宫内膜组织中的表达(P<0.008);sTn在低分化的子宫内膜癌中的表达率显著高于高分化的子宫内膜癌(P<0.017);在肿瘤浸润深度>1/2肌层组的子宫内膜癌组织中的阳性表达率高于≤1/2肌层组(P<0.05);在有、无淋巴结转移组的子宫内膜癌组织中的阳性表达率差异无统计学意义(P>0.05)。结论sTn的表达可能在子宫内膜癌的发生、发展中起一定的作用。
子宫内膜肿瘤;免疫组织化学;抗原,肿瘤;sTn
Tn抗原是最简单的黏蛋白型O-聚糖,Sialyl-Tn(sTn)抗原是唾液酸化的Tn抗原,是O-连接黏蛋白糖基化过程中糖链合成不完全出现的二糖结构,也是肿瘤相关糖抗原的一种。它在正常组织中分布相当局限,而在上皮来源恶性肿瘤,尤其是腺癌组织中分布广泛[1]。子宫内膜癌是妇科肿瘤中常见的肿瘤之一,发病率呈逐年上升趋势。但是关于sTn在子宫内膜癌中的研究却很少。本研究通过应用抗sTn单克隆抗体3P9[2-3]检测子宫内膜癌患者子宫内膜组织中sTn的表达,旨在探讨sTn与子宫内膜癌患者的肿瘤临床分期及病理分级等的关系,分析其临床意义。
1 资料与方法
1.1 一般资料 所有标本均为2007年1月—2012年12月在郑州大学第五附属医院经手术切除或诊刮送检标本,其中子宫内膜癌93例(包括子宫内膜样癌80例,浆液性乳头状癌10例,透明细胞癌3例),子宫内膜非典型增生50例,子宫良性病变50例(25例子宫肌瘤和25例子宫内膜息肉)。子宫内膜癌组患者平均年龄(56.57±7.91)岁,初潮年龄(13.98±3.13)岁,平均孕(3.61±2.01)次,平均分娩(2.08±1.02)次,平均体质量(67.35±10.67)kg;子宫内膜非典型增生及子宫良性病变组患者平均年龄(49.57±9.62)岁,初潮年龄(14.56±2.97)岁,平均孕(3.28±2.52)次,平均分娩(2.47±0.98)次,平均体质量(60.35±9.73)kg。两组患者在年龄、初潮年龄、孕次、产次、体质量差别均无统计学意义(t分别为1.251、1.024、0.653、0.594、1.086,均P>0.05)。入组子宫内膜癌患者,术前均经诊刮送病理明确诊断,且术前均未进行过化疗、放疗及生物治疗。对Ⅰ期患者,行筋膜外全子宫切除+双侧附件切除+盆腔淋巴结清扫术。对Ⅱ期患者,行子宫广泛切除+双附件切除+盆腔淋巴结清扫+腹主动脉旁淋巴结清扫术。部分Ⅲ期或Ⅳ期患者行肿瘤细胞减灭术。子宫内膜非典型增生标本及子宫良性病变标本则来自于门诊诊刮或因上述病变手术切除子宫患者。
1.2 方法 利用抗sTn单克隆抗体3P9(试剂盒由中国科学院生物物理研究所提供)检测sTn在子宫内膜组织中的表达。所有标本均经4%甲醛液固定、石蜡包埋,用Leica石蜡切片机将石蜡包埋组织切成5 μm切片,在载玻片上42℃展片,自然干燥后50℃烤片6 h。取出片子,入二甲苯溶液脱蜡3次,每次5 min。再依次入无水乙醇、95%乙醇、80%乙醇、70%乙醇和蒸馏水中水化。0.3%过氧化氢处理30 min,消除内源性过氧化物酶的活性,PBS洗3次。0.01 mmol/L pH 6.0柠檬酸缓冲液100℃水浴30 min抗原修复。体积分数5%的正常血清封闭1 h。加入PBS稀释的抗sTn单克隆抗体3P9于4℃过夜。HRP标记的二抗37℃孵育1 h,PBS洗3次。DAB显色2~7 min,苏木素复染。各级乙醇(70%、80%、90%、无水乙醇Ⅰ、无水乙醇Ⅱ)脱水,每级3 min,取出切片置入二甲苯5 min,3次。晾干,中性树脂封片;显微成像系统拍片。对照:采用陕西超英生物科技有限公司提供的已知阳性切片作阳性对照,结果阳性。用PBS代替一抗作阴性对照,结果阴性。子宫内膜组织中sTn表达的判定标准:每张切片均取5个高倍视野,每个视野计数100个细胞,阳性细胞百分率<5%为(-);5%~9%为(+);10%~24%为(++);25%~49%为(+++);50%~100%为(++++)。
1.3 统计学方法 采用SPSS 16.0统计软件包对资料进行分析,计量资料采用均数±标准差(±s)表示,组间比较采用t检验;计数资料采用例或率表示,组间比较采用χ2检验。检验水准α=0.05。
2 结果
2.1 sTn在子宫内膜组织中的染色分布情况 在少数表达的正常组织和非典型增生组织中,染色主要集中在细胞膜上;而在子宫内膜癌组织中sTn的阳性着色广泛分布在细胞膜和细胞浆,并且在sTn强表达(3+/4+)的组织中,sTn有向管腔弥散表达的现象,见图1。
2.2 sTn阳性表达与子宫内膜病理类型的关系 sTn在子宫内膜癌、子宫内膜非典型增生、良性子宫病变患者子宫内膜组织中的阳性率分别为73.1%、32%、14%,且差异有统计学意义(χ2=51.823,P<0.05);sTn在子宫内膜癌患者子宫内膜组织中的阳性表达率高于其他2组患者(均P<0.017),见表1。

Table 1 Relationship between sTn expression and pathological type of the endometrium表1 sTn阳性表达与子宫内膜病理类型的关系 (例)
2.3 sTn阳性表达与子宫内膜癌病理类型的关系 将浆液性乳头状癌组与透明细胞癌组合并为Ⅱ型子宫内膜癌组,将子宫内膜样癌列为Ⅰ型子宫内膜癌组。各组患者子宫内膜组织中sTn阳性率差异有统计学意义(χ2=59.107,P<0.05);sTn在Ⅰ型子宫内膜癌组子宫内膜组织中的阳性表达率均高于在其他各组中的表达率(均P<0.008),见表2。
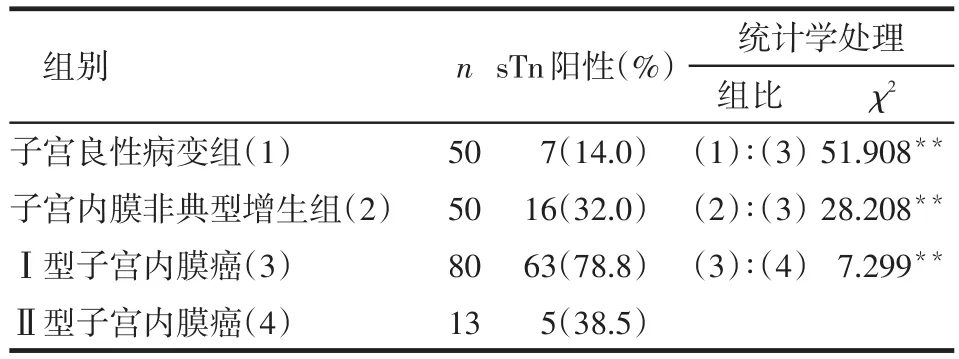
Table 2 Relationship between sTn expression and pathological type of the endometrial carcinoma表2 sTn阳性表达与子宫内膜癌病理类型的关系例
2.4 sTn阳性表达与子宫内膜癌患者病理特征的关系 93例子宫内膜癌患者中,sTn阳性率在手术病理分期较早组与手术病理分期较晚组的差异无统计学意义。sTn在低、中、高分化子宫内膜癌组织中的阳性表达率差异有统计学意义,sTn在低分化组织中的阳性表达率高于高分化组织(χ2=7.299,P<0.017),低分化与中分化比较,中分化与高分化组织比较差异无统计学意义(χ2分别为2.590、1.487,均P>0.017)。sTn在肿瘤浸润深度>1/2肌层组的子宫内膜癌组织中的阳性表达率高于≤1/2肌层组。sTn在有淋巴结转移及无淋巴结转移组的子宫内膜癌组织中的阳性表达率差异无统计学意义;见表3。
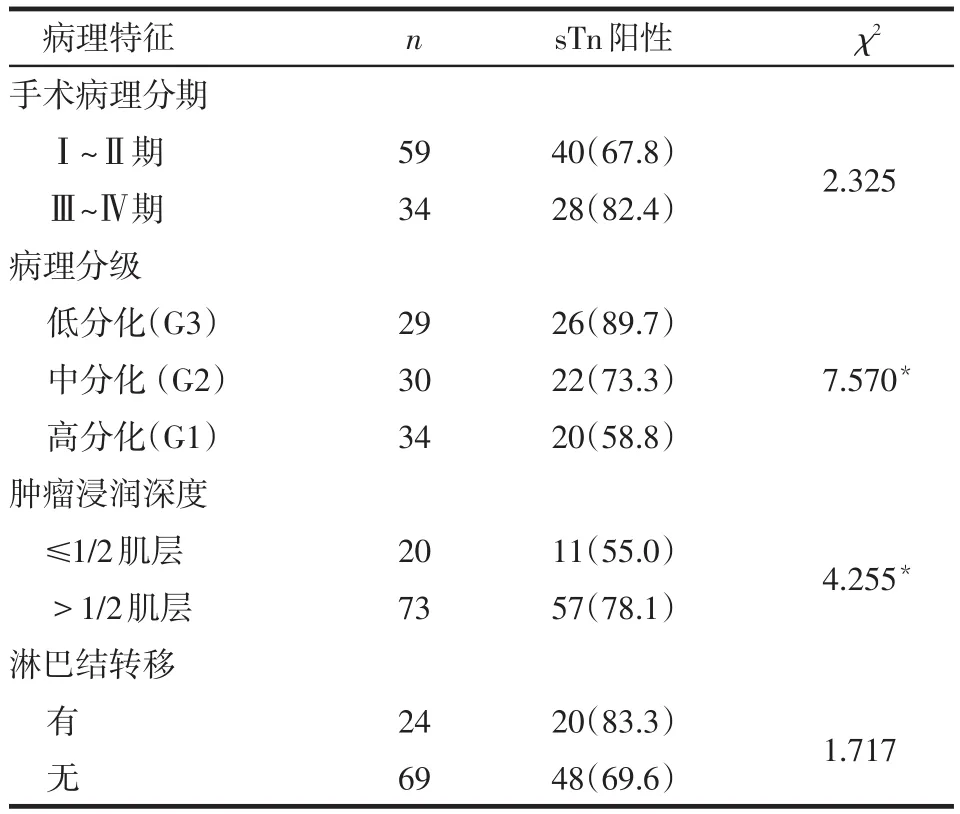
Table 3 Relationship between sTn expression and pathologic staged of the endometrial carcinoma表3 sTn阳性表达与子宫内膜癌患者病理特征的关系例(%)
3 讨论
3.1 sTn的研究现状及其与子宫内膜组织的关系 sTn是近年来倍受瞩目的一种肿瘤相关糖抗原,在多种上皮性腺癌中高表达,如结直肠癌[4]、乳腺癌[5]、卵巢癌[6]、膀胱癌[7]等,但在各自相对应的正常组织中不表达。另外,其表达情况与肿瘤的侵袭性和不良预后高度相关;sTn在某些腺癌患者血清和组织中的高表达,甚至被认为是肿瘤不良预后的独立预测因子,如结直肠癌[4]、胃癌[8]、乳腺癌[9]。
子宫内膜癌目前尚无特异的早期筛查方法及肿瘤标志物。虽然sTn与各种肿瘤的研究起始已久,但其在子宫内膜癌中的研究却很少,仅有的几篇报道结果也不尽相同。Numa等[10]报道称sTn在子宫内膜癌组织中不表达。而Semczuk等[11]报道sTn在大多数子宫内膜癌组织中广泛表达,在正常和增生的子宫内膜中表达有限。Ohno等[12]应用单克隆抗体MLS132对子宫内膜癌组织中的sTn进行检测,发现sTn在44.3%的患者中表现为广泛阳性,在17.1%的患者中为局灶阳性,而38.6%为阴性。本研究结果显示sTn在子宫内膜癌组织中的阳性表达率显著高于子宫内膜非典型增生、良性子宫病变,与以上研究结果相似,进一步证实了sTn的肿瘤相关性,且sTn在子宫内膜癌组织中呈高表达,提示sTn可能成为子宫内膜癌组织学诊断的一个新的辅助分子。
3.2 sTn与子宫内膜癌病理类型的关系 Ⅰ型子宫内膜癌为雌激素依赖型,病理学类型表现为子宫内膜样癌。Ⅱ型子宫内膜癌为非雌激素依赖型,病理学类型多为浆液性癌、透明细胞癌或分化较差的未分化癌等类型。国内安云鹤等[3]研究指出sTn特异性与Ⅰ型子宫内膜癌相关。本研究也显示sTn在Ⅰ型子宫内膜癌组的阳性表达率显著高于子宫良性病变组、非典型增生内膜组及Ⅱ型子宫内膜癌组,与安云鹤等的研究结果相似。另外,本研究显示sTn在Ⅱ型子宫内膜癌组中的阳性表达率与其在子宫良性病变组、非典型增生内膜组中的表达差异无统计学意义,从而说明sTn在Ⅰ型及Ⅱ型子宫内膜癌中的表达模式不同,提示sTn在Ⅰ型子宫内膜癌组的发生、发展中起着更重要的作用。由于标本的限制,对于一些其他类型的子宫内膜癌,如黏液性腺癌、鳞状细胞癌等未列入研究范围,尚有待于进一步的研究。
3.3 sTn与子宫内膜癌预后的关系 sTn在高、中分化的肿瘤组织中表达率明显高于低分化的肿瘤组织,并认为这预示着sTn可能与子宫内膜癌的良好预后相关[3]。但是Ohno等[12]在对70例子宫内膜癌患者进行随访及分析后,认为sTn的强阳性表达是影响子宫内膜癌患者无复发生存率的危险因素,预示着子宫内膜癌患者的较差预后。Ohno等[12]还指出sTn在子宫内膜癌组织的过表达与环氧酶-2(COX-2)的过表达呈正相关,与CD8+T淋巴细胞的数量呈负相关,从而认为sTn可能与COX-2协同作用,抑制宿主的免疫监督,最终导致子宫内膜癌患者无复发生存率的降低。
本研究显示,不同手术病理分期及不同淋巴结转移子宫内膜癌患者sTn阳性表达率差异无统计学意义,但sTn在低分化的子宫内膜癌中的表达率显著高于高分化的子宫内膜癌,sTn在肿瘤浸润深度>1/2肌层组的阳性表达率显著高于≤1/2肌层组,因此认为sTn高表达者可能预后更差。
另一方面,本研究同时显示sTn在Ⅱ型内膜癌中的表达低于Ⅰ型;而临床上Ⅱ型内膜癌预后更差,似乎与前述结果矛盾。分析其原因,可能与研究对象的构成有关,即入组的Ⅰ型子宫内膜癌患者中手术病理分期较晚、低分化、肿瘤浸润深度较深及有淋巴结转移者所占比例较Ⅱ型高。本研究中sTn在低、高分化的子宫内膜癌中的表达率与中分化者差异均无统计学意义,可能也与此有关。
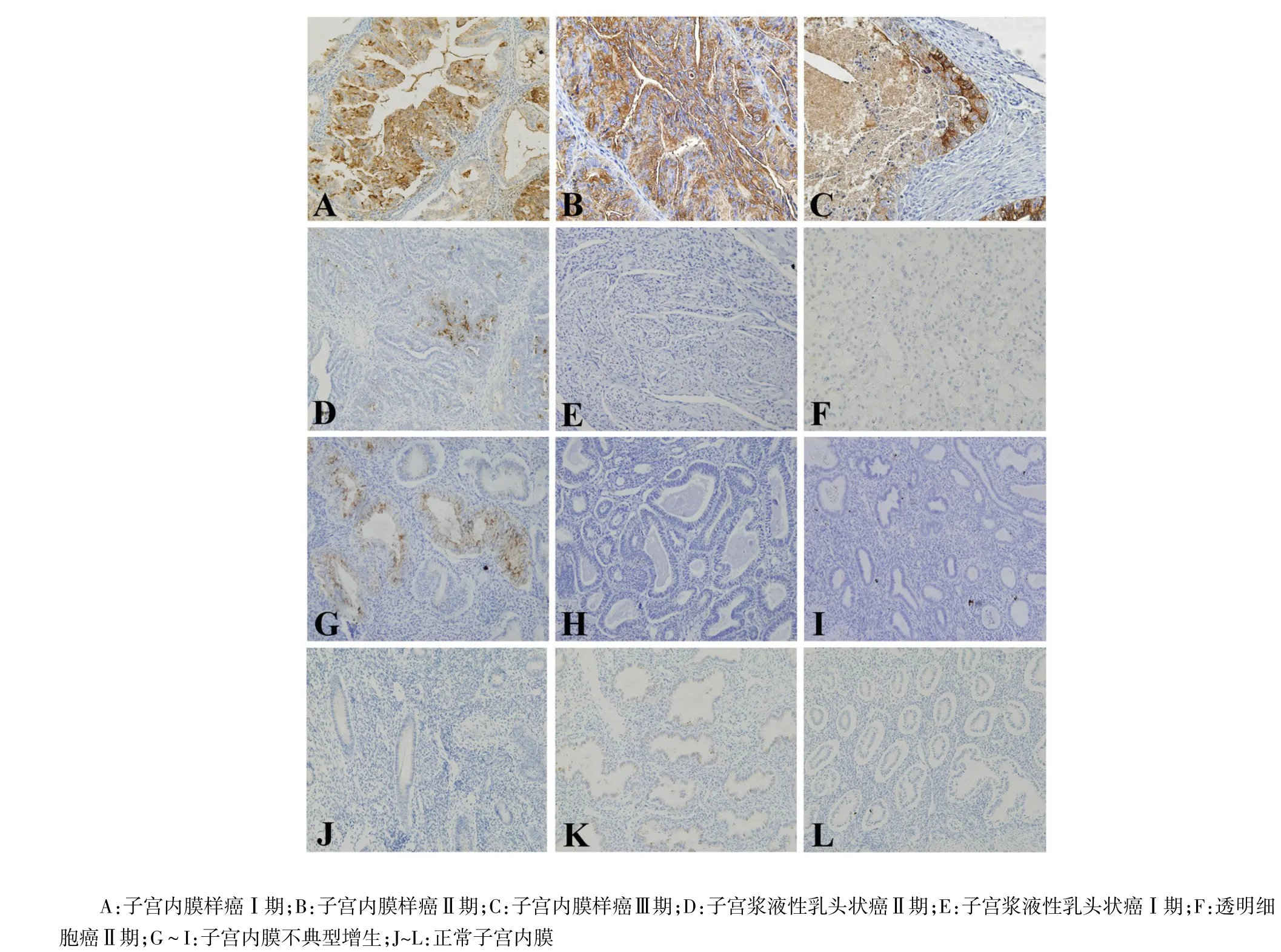
Figure 1 Staining of sTn in endometrial tissues(immunohistochemistry,×100)图1 sTn在子宫内膜组织中的分布(免疫组化,×100)
[1]Heimburg-Molinaro J,Lum M,Vijay G,et al.Cancer vaccines and carbohydrate epitopes[J].Vaccine,2011,29(48):8802-8826.doi: 10.1016/j.vaccine.2011.09.009.
[2]An Y,Han W,Chen X,et al.A novel anti-sTn monoclonal antibody 3P9 Inhibits human xenografted colorectal carcinomas[J].J Immunother,2013,36(1):20-28.doi:10.1097/CJI.0b013e31827810d1.
[3]安云鹤,张豪锋,孙敏,等.糖抗原sTn是Ⅰ型子宫内膜癌的新型标记物[J].生物化学与生物物理进展,2012,39(6):548-555.
[4]Barrow H,Tam B,Duckworth CA,et al.Suppression of core 1 Galtransferase is associated with reduction of TF and reciprocal increase of Tn,sialyl-Tn and Core 3 glycans in human colon cancer cells[J].PLoS One,2013,8(3):e59792.doi:10.1371/journal. pone.0059792.
[5]Miles D,Roché H,Martin M,et al.Phase III multicenter clinical trial of the sialyl-TN(STn)-keyhole limpet hemocyanin(KLH)vaccine for metastatic breast cancer[J].Oncologist,2011,16(8):1092-1100.doi:10.1634/theoncologist.2010-0307.
[6]Akita K,Yoshida S,Ikehara Y,et al.Different levels of sialyl-Tn antigen expressed on MUC16 in patients with endometriosis and ovarian cancer[J].Int J Gynecol Cancer,2012,22(4):531-538.doi: 10.1097/IGC.0b013e3182473292.
[7]Ferreira JA,Videira PA,Lima L,et al.Overexpression of tumourassociated carbohydrate antigen sialyl-Tn in advanced bladder tumours[J].Mol Oncol,2013,7(3):719-731.doi:10.1016/j.molonc. 2013.03.001.
[8]Marcos NT,Bennett EP,Gomes J,et al.ST6GalNAc-I controls expression of sialyl-Tn antigen in gastrointestinal tissues[J].Front Biosci(Elite Ed),2011,3:1443-1455.
[9]Cazet A,Julien S,Bobowski M,et al.Consequences of the expression of sialylated antigens in breast cancer[J].Carbohydr Res,2010,345 (10):1377-1383.doi:10.1016/j.carres.2010.01.024.
[10]Numa F,Tsunaga N,Michioka T,et al.Tissue expression of Sialyl Tn antigen in gynecologic tumors[J].J Obste Gynaecol(Tokyo 1995) [J].1995,21(4):385-389.
[11]Semczuk A,Paszkowska A,Miturski R,et al.Sialosyl-Tn expression in normal and pathological conditions of human endometrium.An immunohistochemical study[J].Pathol Res Pract,2002,198(9):589-595.doi:10.1078/0344-0338-00307.
[12]Ohno S,Ohno Y,Nakada H,et al.Expression of Tn and sialyl-Tn antigens in endometrial cancer:its relationship with tumor-producedcyclooxygenase-2,tumor-infiltrated lymphocytes and patient prognosis[J].Anticancer Res,2006,26(6A):4047-4053.
(2013-09-09收稿 2014-02-10修回)
(本文编辑 李鹏)
The Expression and Clinical Significance of sTn in Endometrial Carcinoma
GUO Qi,CHEN Xiuqin,GUO Shangyun,FU Jianhong,ZHAI Xuhua,YANG Xiaohui,MENG Fang
The Fifth Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China
ObjectiveTo investigate the expression and clinical significance of tumor-associated carbohydrate antigen sTn in endometrium from patients with atypical hyperplasia of endometrium,endometrial carcinoma and benign the uterine lesion.And to analyze the association between sTn and the pathologic stage and grade of endometrial carcinoma.Meth⁃ods sTn was detected by immunohistochemistry in 193 patient samples,including 93 subjects with endometrial carcinoma, 50 subjects with atypical hyperplasia of endometrium and 50 subjects with benign uterine lesions.ResultsThe positive sTn rate in endometrial carcinoma group was 73.1%,which was significantly different from that in atypical hyperplasia endometrium group(32%)and that in benign uterine lesion group(14%),(P<0.017).sTn positive rate in patients with endometrial carcinoma was 78.8%which is higher than that in patients with other diseases(P<0.008).The positive rate of sTn in patients with poorly differentiated endometrial carcinoma was significantly higher than that in patients with highly differentiated endometrial carcinoma(P<0.017).The positive rate of sTn in tissues of tumor infiltration with depth of more than half of myometrial was significantly higher than in tissues of tumor infiltration with depth of equal or less than half of myometrial (P<0.05).But there was no significant difference in sTn positive rate between the endometrial carcinoma groups with and without lymph node metastasis(P>0.05).ConclusionsTn may play a role in the tumorigenesis and development of endometrial carcinoma.
endometrial neoplasms;immunohistochemistry;antigens,neoplasm;sTn
R737.33
A
10.3969/j.issn.0253-9896.2014.06.020
*河南省卫生厅医学科技攻关计划项目(项目编号:2011020069)
郑州大学第五附属医院(邮编450052)
△通讯作者 E-mail:zdwfy@sohu.com
