hnRNP A1的增强型绿色荧光标记及细胞应激定位分析*
2014-06-15高星杰孙晓明纬何津岩
高星杰 宋 娟 葛 林 付 雪 孙晓明 张 纬何津岩 姚 智 杨 洁,△
hnRNP A1的增强型绿色荧光标记及细胞应激定位分析*
高星杰1宋 娟2葛 林2付 雪1孙晓明2张 纬2何津岩3姚 智4杨 洁1,2△
目的 构建包含有核不均一核糖核蛋白(hnRNP)A1蛋白编码区序列的真核表达质粒pEGFP-C1-hnRNP A1,并对增强型绿色荧光蛋白(EGFP)标记的hnRNP A1蛋白进行细胞应激共定位分析。方法提取HeLa细胞总RNA,以针对hnRNPA1-3′非翻译区的特异性片段为反转录引物,反转录出包含hnRNP A1编码区序列的cDNA,并以其为模板,降落PCR法扩增出带EcoRⅠ和BamHⅠ双酶切位点的目的基因,利用双酶切法分别酶切目的基因片段和线性pEGFP-C1,在T4-DNA连接酶的催化下将两者连接构建成pEGFP-C1-hnRNP A1重组质粒,然后将重组质粒转染入HeLa细胞内,以激光共聚焦荧光显微镜观察EGFP-hnRNP A1的荧光表达情况,Western印迹法检测EGFP与hnRNP A1的融合表达情况,最后进行细胞原位杂交及细胞免疫荧光检测在氧化应激状态下EGFP-hnRNP A1蛋白与poly(A)+mRNA(应激颗粒的标记成分)及DPC1a(加工体的标记蛋白)的应激共定位。结果以单/双酶切及基因测序法鉴定构建的重组质粒无误,激光共聚焦荧光显微镜观察和Western印迹结果检测到绿色荧光融合蛋白的表达;EGFP-hnRNP A1蛋白与poly(A)+mRNA呈现共定位,但与DPC1a无共定位关系。结论重组pEGFP-C1-hnRNP A1质粒成功构建并表达,应激状态下EGFP标记的hnRNP A1参与应激颗粒的构成。
核糖核蛋白类,核不均一;绿色荧光蛋白质类;膜融合蛋白质类;hnRNP A1蛋白;pEGFP-C1;融合蛋白;应激颗粒
核不均一核糖核蛋白(heterogeneous nuclear ribonucleoprotein,hnRNP)A1是hnRNP蛋白家族中的重要一员。学者们已从不同角度探讨hnRNP A1蛋白在选择性剪接、mRNA代谢、端粒酶激活、凋亡调控等过程中的重要作用,然而从细胞水平探讨hnRNP A1细胞应激功能的相关研究尚少见[1-3]。本研究采用pEGFP-C1质粒载体,旨在构建pEGFPC1-hnRNP A1重组质粒,在真核细胞内表达携带有增强型绿色荧光蛋白(EGFP)标签的hnRNP A1蛋白,并进行细胞应激时的荧光定位分析,为深入研究多功能hnRNP A1蛋白的生物学功能提供便利工具。
1 材料与方法
1.1 材料
1.1.1 质粒、菌株及细胞 pEGFP-C1载体购自美国Clontech公司;Trans1-T1感受态细胞购自北京全式金生物技术有限公司;HeLa细胞为本实验室保存。
1.1.2 试剂与仪器 限制性内切酶EcoRⅠ、BamHⅠ及T4 DNA连接酶均购自Fermentas公司;Taq酶购自北京鼎国昌盛生物技术公司;T/A载体(pEASY-T1)购自北京全式金生物技术有限公司;DNA快速凝胶回收试剂盒购自北京博大泰克生物基因技术有限公司;质粒快速小提试剂盒购自北京索来宝科技有限公司;去内毒素质粒提取试剂盒购自Promega公司;Lipofectamine 2000购自Invitrogen公司。BCA蛋白测定试剂盒购自Pierce公司;单克隆鼠源抗EGFP抗体购自MBL公司;多克隆兔源抗DCP1a抗体购自Abcam公司;辣根过氧化物酶标记的抗鼠源IgG二抗购自Fermentas公司;Alexa Fluor 546标记的抗兔源IgG荧光二抗购自Invitrogen公司;LumiGLo化学发光底物购于KPL公司;DAPI染料购自Santa公司;TAMRA-oligo(dT)30购自生工生物工程公司;激光共聚焦皿购自NEST公司。激光共聚焦荧光显微镜(日本Olympus公司),引物合成及基因测序工作由北京天一辉远公司完成。
1.2 方法
1.2.1 获取目的基因片段 培养HeLa细胞,提取RNA,以“GTGAACTCAGCCAAG CACAGTGGT”为引物进行hnRNP A1 cDNA的反转录,然后根据hnRNP A1的蛋白编码区序列(NM_002136.2)设计含有EcoRⅠ和BamHⅠ限制性内切酶位点的引物序列,上游:5′-CCGGAATTCCATGTCTAAGTCAGAGTCTCCTA-3′;下游:5′-CGCGGATCCTTAAAAT CTTCTGCCACTGCC-3′。再以含hnRNP A1序列的cDNA为模板,降落PCR扩增目的片段,条件为95℃预变性5 min,95℃30 s,65℃45 s,72℃3 min,每循环降低1℃,共15个循环,再以50℃进行20个循环,72℃延伸10 min。将PCR产物进行琼脂糖凝胶电泳鉴定,紫外灯下切割含有目的条带的凝胶块,利用凝胶回收试剂盒进行目的片段回收,在T4 DNA连接酶作用下,与pEASY-T1(T/A载体)25℃连接15 min。连接产物转化Trans1-T1感受态细胞,在含有氨苄/卡那霉素的LB平板上筛选克隆。挑取阳性克隆,摇菌扩增并提取质粒。以EcoRⅠ和BamHⅠ进行双酶切,凝胶回收试剂盒回收并纯化各目的片段。
1.2.2 线性pEGFP-C1的获取 以质粒快速小提试剂盒提取pEGFP-C1质粒DNA,进行EcoRⅠ和BamHⅠ双酶切后,完整切下线性pEGFP-C1质粒载体,1%琼脂糖电泳分离。凝胶回收试剂盒回收得到约4 700 bp线性pEGFP-C1。
1.2.3 重组真核表达质粒pEGFP-C1-hnRNP A1的构建 在T4 DNA连接酶作用下,将线性pEGFP-C1质粒载体与具有相同黏性末端的hnRNP A1功能片段进行22℃连接过夜。连接产物转化Trans1-T1感受态细胞,在含有卡那霉素的LB平板上筛选克隆。挑取阳性克隆,摇菌扩增并提取重组质粒。
1.2.4 单、双酶切及基因测序鉴定 用EcoRⅠ和BamHⅠ对重组质粒pEGFP-C1-hnRNP A1进行单、双酶切,并以1%琼脂糖凝胶电泳验证片段的大小。同时,对重组质粒进行基因测序鉴定。
1.2.5 HeLa细胞的转染及荧光观察 以去内毒素质粒提取试剂盒提取无内毒素pEGFP-C1-hnRNP A1重组质粒。HeLa细胞接种至激光共聚焦皿中,置于含10%胎牛血清的DMEM高糖培养基,37℃、5%的CO2培养箱中培养,至细胞80%汇合时,依据产品说明书进行脂质体瞬时转染重组质粒。转染后48 h,加500 μL 1 g/L DAPI室温避光孵育3 min,PBS洗涤3次,以激光共聚焦荧光显微镜观察细胞内的荧光信号。
1.2.6 Western印迹检测融合蛋白表达 分别转染pEGFPC1-hnRNP A1重组质粒及pEGFP-C1对照质粒后48 h,先以预冷的1×PBS溶液洗涤转染后HeLa细胞3次,加入预冷的1×NP-40裂解液裂解细胞,晃动培养板数次以确保裂解液完全覆盖细胞,用无菌的细胞刮刮取细胞并转移至1个1.5 mL Eppendorf管中,冰浴20 min。超声破碎细胞后4℃、12 000 r/min离心10 min,取上清获得全细胞裂解液,以BCA蛋白测定试剂盒测定总蛋白浓度。裂解液中加入SDS上样缓冲液(50 mmol/L Tris-Cl pH6.8,2%SDS,0.1%溴酚蓝,10%甘油,2.5% β-巯基乙醇),99℃热变性5 min,进行8%SDS-PAGE电泳。电泳结束后,以半干转法将凝胶上蛋白转移至PVDF膜,用含5%脱脂奶粉的TBST溶液室温封闭2 h,鼠源抗人EGFP单克隆一抗4℃孵育过夜。TBST溶液洗膜4次,每次15 min,加入辣根过氧化物酶标记的抗鼠源IgG二抗室温孵育2 h,TBST溶液再次洗膜4次,每次15 min。加入LumiGLo化学发光底物后暗室曝光。
1.2.7 原位杂交实验 将转染后细胞分为处理组与未处理组,处理组为0.5 mmol/L亚砷酸盐处理1 h。以温PBC洗涤3次,显微镜下观察无死细胞及杂质;4%多聚甲醛固定15 min,PBS洗涤3次,5 min/次;加500 μL 1 g/L DAPI室温避光孵育3 min,PBS洗涤3次,5 min/次;加入1 mL含0.5%TritonX-100的PBS溶液,室温静置10 min;加入0.5 μmol/L TAMRA-oligo(dT)30,46℃湿盒杂交过夜。以含25%甲酰胺的0.5×SSC室温洗涤3次,5 min/次;以4×SSC洗涤2次,5 min/次;以2× SSC洗涤1次,5 min;以1×SSC洗涤1次,5 min;加1 mL DEPC高压水,最后以激光共聚焦荧光显微镜观察细胞内的荧光信号。每组实验重复3次。
1.2.8 细胞免疫荧光实验 转染pEGFP-C1-hnRNP A1重组质粒后48 h,分为处理组(0.5 mmol/L亚砷酸盐,1 h)与非处理组。4%多聚甲醛室温固定10 min,加500 μL 1 g/L DAPI室温避光孵育3 min,PBS洗涤3次,5 min/次;0.2%通透液(含0.2%Triton X-100的PBS)室温静置通透10 min;再加入1% BSA封闭1 h。加入多克隆兔源抗DCP1a(1∶100)的一抗4℃孵育过夜。PBS洗涤3次,10 min/次。再加入Alexa Fluor 546标记的抗兔源IgG荧光二抗(1∶800)4℃孵育过夜。PBS洗涤3次,10 min/次。最后以激光共聚焦荧光显微镜观察细胞内的荧光信号。每组实验检测50~100个细胞分别重复3次。
2 结果
2.1 PCR扩增目的片段 培养HeLa细胞,提取RNA后针对hnRNP A1反转录出cDNA,并以其为模板进行PCR扩增,以1%琼脂糖凝胶电泳鉴定PCR产物,结果在963 bp左右观察到与目的片段长度相符的荧光条带,见图1。

Figure 1 Obtain of targeting hnRNP A1 fragment图1 目的片段hnRNP A1的获取
2.2 线性pEGFP-C1质粒载体的获取 EcoRⅠ和BamHⅠ双酶切pEGFP-C1质粒,切下完整的线性pEGFP-C1质粒载体,见图2。经1%琼脂糖凝胶电泳,在4 700 bp左右出现条带,见图3。纯化回收后用于后续的连接反应。

Figure 2 The map of pEGFP-C1 vector图2 pEGFP-C1载体图谱

Figure 3 Obtain of linear pEGFP-C1 vector图3 线性pEGFP-C1质粒载体的获取
2.2.1 重组真核表达质粒pEGFP-C1-hnRNP A1的鉴定 将构建的重组质粒分别进行EcoRⅠ和BamHⅠ的单、双酶切,产生的条带大小与预期相符,见图4,重组质粒基因测序结果也正确。
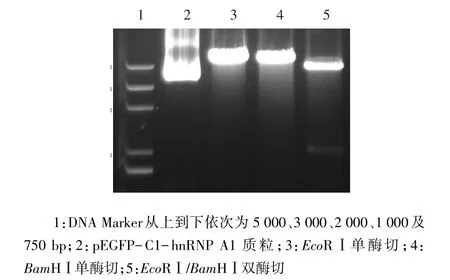
Figure 4 Single/double enzyme digestion of pEGFP-C1-hnRNP A1图4 pEGFP-C1-hnRNP A1的单、双酶切鉴定图
2.2.2 重组真核表达质粒pEGFP-C1-hnRNP A1的荧光表达 激光共聚焦荧光显微镜下可见转染的pEGFP-C1-hnRNP A1重组质粒能够表达EGFP-hnRNP A1,且主要在胞核中分布,见图5。
2.2.3 Western印迹法检测融合蛋白表达 收集转染有pEGFP-C1-hnRNP A1和pEGFP-C1的HeLa细胞,以针对EGFP的单克隆抗体分别检测EGFP-hnRNP A1融合蛋白和EGFP的表达。hnRNP A1蛋白分子质量为34.2 ku,EGFP为26.7 ku,两者融合后为60.9 ku。Western印迹法检测出与目的融合蛋白分子质量相符的蛋白条带,见图6。

Figure 6 The data of Western blotting图6 Western印迹结果
2.3 荧光共定位分析 将pEGFP-C1-hnRNP A1重组质粒转染入HeLa细胞,激光共聚焦荧光显微镜下可见未处理组中EGFP-hnRNP A1主要分布于细胞核内;当给予0.5 mmol/L亚砷酸盐氧化应激处理时,EGFP-hnRNP A1与由TAMRA-oligo(dT)30探针标记的poly(A)+mRNA可在胞浆中形成共同的应激颗粒,见图7,但与内源性的DCP1a加工体颗粒无共定位关系,见图8。
3 讨论
生物体细胞所处环境复杂多变,经常会受到氧化应激、热休克、紫外线照射、渗透压休克和病毒感染等各种刺激。为适应这些外界刺激,细胞也已进化出多种应激调节机制,其中最重要的是转录后基因调控机制。应激颗粒与加工体便是真核细胞内胞浆中存在的2种与细胞应激mRNA代谢密切相关的颗粒结构[4]。其中,应激颗粒是真核细胞受到环境刺激时产生的颗粒状结构,由G3BP蛋白、翻译起始因子eIF4E、RNA结合蛋白TIA-R以及poly(A)+mRNA等组成[4-5]。加工体则是细胞应激时由脱帽行为(decapping)引发的降解mRNA的部位,包括5′→3′核酸外切酶、脱帽酶DCP1a、miRNAs、Argonaute1/2等[4,6]。
研究发现,hnRNP A1蛋白是一种重要RNA结合蛋白,主要存在于细胞核内,可参与选择性剪接等过程;当细胞受到应激时,在p38信号通路介导下hnRNP A1蛋白会发生高度磷酸化,并穿梭至细胞浆中参与细胞应激颗粒的构成,增强细胞的生存能力[2]。另外,hnRNP A1可与HuR蛋白形成复合物,热休克刺激会促进该复合物出核并定位于细胞应激颗粒[7]。当细胞受到高渗应激时,eIF2α蛋白发生磷酸化,也会导致hnRNP A1的胞浆分布以及应激颗粒的形成,进而可通过降低Bcl-xL mRNA的转录水平来促进凋亡发生[3]。鉴于hnRNP A1蛋白在细胞应激中的重要性,对于该蛋白的有效荧光标记极为重要。EGFP是绿色荧光蛋白(GFP)的一个突变体,其荧光强度及光漂白抗性明显增强,是迄今为止应用最为广泛的活体分子标记物之一。本实验即通过构建pEGFP-C1-hnRNP A1重组质粒的方法对hnRNP A1蛋白进行EGFP荧光标记。EGFP标记的hnRNP A1蛋白在正常生理状态时主要在胞核中分布,而当细胞受到亚砷酸盐氧化应激时可与poly(A)+mRNA形成相同的应激颗粒,但与内源性DCP1a加工体颗粒并不存在共定位关系,表明以增强型绿色荧光蛋白标记的hnRNPA1可有效应用于细胞应激方面的研究。
hnRNP A1还与病毒感染、肿瘤、神经性疾病等有关。例如,当细胞感染水疱性口炎病毒时,hnRNP A1蛋白在Rae1蛋白的辅助下会出核并定位于应激颗粒中[8]。hnRNP A1还可能通过细胞应激环节参与肌萎缩侧索硬化症的发生、发展[9-10]。增强型绿色荧光标记的hnRNP A1可用于细胞免疫荧光、活细胞工作站、光漂白恢复、免疫共沉淀等相关实验,将有助于深入探究hnRNP A1蛋白在细胞应激及相关疾病领域的生物学功能。

Figure 5 The expression of EGFP-hnRNPA1 via confocal fluorescence microscopy(bar=20 μm)图5 激光共聚焦荧光显微镜下观察重组质粒的表达(标尺=20 μm)

Figure 7 Cellular co-localization analysis of EGFP-hnRNP A1 and poly(A)+mRNA(bar=10 μm)图7 EGFP-hnRNP A1与poly(A)+mRNA的细胞内应激共定位分析(标尺=20 μm)

Figure 8 Cellular co-localization analysis of EGFP-hnRNP A1 and DCP1a(bar=20 μm)图8 EGFP-hnRNP A1与DCP1a的细胞内应激共定位分析(标尺=20 μm)
[1]Choi YH,Lim JK,Jeong MW,et al.HnRNP A1 phosphorylated by VRK1 stimulates telomerase and its binding to telomeric DNA sequence[J].Nucleic Acids Res,2012,40(17):8499-8518.doi: 10.1093/nar/gks634.
[2]Guil S,Long JC,Cáceres JF.hnRNP A1 relocalization to the stress granules reflects a role in the stress response[J].Mol Cell Biol, 2006,26(15):5744-5758.doi:10.1128/MCB.00224-06.
[3]Bevilacqua E,Wang X,Majumder M,et al.eIF2alpha phosphorylation tips the balance to apoptosis during osmotic stress[J].J Biol Chem, 2010, 285(22):17098- 17111. doi: 10.1074/jbc. M110.109439.
[4]Decker CJ,Parker R.P-bodies and stress granules:possible roles in the control of translation and mRNA degradation[J].Cold Spring Harb Perspect Biol,2012,4(9):a012286.doi:10.1101/cshperspect. a012286.
[5]Anderson P,Kedersha N.Stress granules:the Tao of RNA triage[J]. TrendsBiochem Sci,2008,33(3):141-150.doi:10.1016/j. tibs.2007.12.003.
[6]Parker R,Sheth U.P bodies and the control of mRNA translation and degradation[J].Mol Cell,2007,25(5):635-646.doi:10.1016/j. molcel.2007.02.011.
[7]Papadopoulou C,Ganou V,Patrinou-Georgoula M,et al.HuR-hnRNP interactions and the effect of cellular stress[J].Mol Cell Biochem,2013,372(1-2):137-147.doi:10.1007/s11010-012-1454-0.
[8]Pettit Kneller EL,Connor JH,Lyles DS.hnRNPs Relocalize to the cytoplasm following infection with vesicular stomatitis virus[J].J Virol,2009,83(2):770-780.doi:10.1128/JVI.01279-08.
[9]Kim HJ,Kim NC,Wang YD,et al.Mutations in prion-like domains in hnRNPA2B1 and hnRNPA1 cause multisystem proteinopathy and ALS[J].Nature,2013,495(7442):467-473.doi:10.1038/nature11922.
[10]Li YR,King OD,Shorter J,et al.Stress granules as crucibles of ALS pathogenesis[J].J Cell Biol,2013,201(3):361-372.doi: 10.1083/jcb.201302044.
(2013-11-14收稿 2014-02-10修回)
(本文编辑 魏杰)
Cellular Localization Analysis of Enhanced Green Fluorescent Protein Tagged hnRNP A1 Under Stress
GAO Xingjie1,SONG Juan2,GE Lin2,FU Xue1,SUN Xiaoming2,ZHANG Wei2,HE Jinyan3,YAO Zhi4,YANG Jie1,2
1 Basic Medical College and Research Center;2 Department of Biochemistry;3 Department of physiology;4 Department of Immunology;Tianjin Medical University,Tianjin,300070,China
ObjectiveTo construct eukaryotic enhanced green fluorescent protein(EGFP)expressing recombinant plasmid,pEGFP-C1-hnRNP A1,which contains coding sequence of human hnRNP A1(heterogeneous nuclear ribonucleoprotein A1),and to perform cellular localization analysis of EGFP tagged hnRNP A1 under stress.MethodsTotal RNA was isolated from HeLa cell used for synthesis of first-strand cDNAs using reverse primers that are specific for the3′-untranslated region of hnRNP A1.hnRNP A1 gene fragments were then amplified by touch-down PCR from those cDNAs and inserted into pEGFP-C1 fluorescent bearing vector through EcoRⅠ/BamHⅡdouble enzyme digestion and T4 DNA Ligase connection.The recombinant pEGFP-C1-hnRNP A1 plasmid was transfected into HeLa cells and green fluorescent tagged fusion proteins was examined by Western blot and confocal fluorescence microscopy.Co-localization of EGFP-hnRNP A1 with poly(A)+mRNA(the marker of the stress granules),or DCP1a(the marker of processome)were detected by RNA fluorescence in situ hybridization and immunofluorescence.ResultsThe pEGFP-C1-hnRNP A1 was sequenced and digested correctly by restriction single/double enzyme.The green fluorescent fusion protein was also detected in transfected HeLa cell by Western blot and confocal fluorescence microscopy.EGFP-hnRNP A1 co-localizes with poly(A)+mRNA,but not DCP1a.ConclusionRecombinant eukaryotic plasmid of pEGFP-C1-hnRNP A1 was constructed successfully and expressed effectively.EGFP tagged hnRNP A1 takes part in forming stress granules.
heterogeneous-nuclear ribonucleoproteins;green fluorescent proteins;membrane fusion proteins; human hnRNP A1 protein;pEGFP-C1;fusion protein;stress granules
Q591.2,Q784
A
10.3969/j.issn.0253-9896.2014.06.003
*国家自然科学基金资助项目(项目编号:31100967,31170830,31370749);国家杰出青年基金项目(项目编号:31125012)
1天津医科大学基础医学研究中心(邮编300070),2生化教研室,3生理教研室,4免疫教研室
△通讯作者 E-mail:yangj@tijmu.edu.cn
