国产奥美拉唑肠溶胶囊与原研制剂的体外释放度比较
2014-06-15邹梅娟
程 盟,邹梅娟,程 刚
(沈阳药科大学 药学院,辽宁 沈阳 110016)
国产奥美拉唑肠溶胶囊与原研制剂的体外释放度比较
程 盟,邹梅娟,程 刚*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
目的考察国内4个厂家生产的奥美拉唑肠溶胶囊(A、B、C、D)与原研制剂(商品名:Losec)的体外释放度,比较其体外释放行为,为临床用药选择提供参考。方法 采用高效液相色谱法分别在pH 1.2的氯化钠盐酸溶液、纯化水、pH 6.0和pH 6.8的磷酸盐缓冲液4种介质中,以及不同转速条件下测定样品的释放度,并评价释放曲线的相似性。结果 5种奥美拉唑肠溶胶囊在pH 1.2的介质中耐酸性均较好;Losec、A、C在纯化水中2 h 的释放度小于10%,B和D大于10%;4个国产厂家生产的胶囊与Losec在pH 6.0和pH 6.8介质中的释放曲线均不相似。结论 国产的奥美拉唑肠溶胶囊与原研制剂(Losec)释放行为有一定的差异,临床用药时应加以注意。
药剂学;奥美拉唑肠溶胶囊;高效液相色谱法;释放曲线;相似性
奥美拉唑肠溶胶囊是由阿斯利康制药公司研发的首个苯丙咪唑类质子泵抑制剂。临床用于胃溃疡、十二指肠溃疡应激性溃疡返流性食管炎和卓-艾氏综合征(胃泌素瘤)的治疗。目前,国内有多个厂家生产奥美拉唑肠溶胶囊,临床应用时发现,不同厂家的产品,其临床效果具有一定的差异。体外溶出度是影响药物生物利用度的主要因素之一,因此在多种pH溶出介质中测定药物的溶出度是药物审评机构评价口服固体制剂内在质量的一种重要手段,该试验可用于评估不同来源的同一制剂内在质量的差异[1]。本文参考《日本参比制剂目录》《中华人民共和国药典》以及美国药典释放度检查方法,对国产4个生产厂家的奥美拉唑肠溶胶囊和原研制剂Losec在4种介质中、不同转速条件下的体外释放行为进行测定和比较,以期为奥美拉唑肠溶胶囊的临床应用提供参考。
1 仪器与试药
1.1 仪器
BS110S电子天平(北京赛多利斯有限公司);ZRS-8L智能溶出试验仪(天津天大天发科技有限公司);PU-1580高效液相色谱仪(日本Jasco公司)。
1.2 试药
奥美拉唑标准品(中国药品生物制品检定所,批号:100367-201003);奥美拉唑肠溶胶囊(Losec,阿斯利康公司),批号B20243,20 mg;国产4个生产厂家的奥美拉唑肠溶胶囊产品A(批号:268121201)、B(批号:20130215)、C(批号:20120304)、D(批号:20130203)规格均为20 g。
2 方法与结果
2.1 试验溶液的配制
pH为1.2的氯化钠盐酸溶液的配制:取氯化钠l.0 g 置于容量瓶中,加盐酸3.5 mL,加水至500 mL,即得[2];pH为6.0的磷酸盐缓冲液的配制:称取磷酸二氢钾40.83 g和氢氧化钠1.344 g置于容量瓶中,加水至6 L,即得;pH值为6.8的磷酸盐缓冲液的配制:称取氯化钠l.0 g 置于容量瓶中,加入盐酸3.5 mL,加水至500 mL,再加入0.235 mol·L-1磷酸氢二钠溶液400 mL,即得[2]。
2.2 含量测定方法学验证
2.2.1 色谱条件
色谱柱:Phenomeneх®C18(150 mm×4.6 mm,5 μm);流动相:0.01 mol·L-1磷酸氢二钠溶液(用磷酸调节pH至7.6)-乙腈(体积比 65∶35);检测波长:302 nm;柱温:40 ℃;流速:1.0 mL·min-1。
2.2.2 标准曲线
分别精密量取0.05、0.2、0.5、0.8、1、1.2 mL含量测定项下的奥美拉唑对照品贮备液,置于10 mL量瓶中,加磷酸盐缓冲液(pH=11.0)至刻度,稀释成系列浓度的奥美拉唑对照品溶液,精密量取20 µL注入高效液相色谱仪,记录色谱图,以峰面积A值对质量浓度C进行线性回归,得回归方程:A = 6.408х103C + 6.851х102, r = 0.999 5。结果表明,奥美拉唑在1~24 µg·mL-1质量浓度范围内线性关系良好。
2.2.3 精密度
精密量取含量测定项下对照品溶液20 µL注入高效液相色谱仪,重复进样6针,记录色谱图,求得平均峰面积为136 840,RSD为0.4%。结果表明,本实验方法精密度符合要求。
2.2.4 加样回收率
取胶囊A的内容物,研细,精密称取适量(约相当于奥美拉唑10 mg),置于100 mL量瓶中,精密加入奥美拉唑对照品约6、10、14 mg各三份,加入乙醇20 mL、磷酸盐缓冲液(pH=11.0)约60 mL,超声处理使奥美拉唑溶解,用pH=11.0的磷酸盐缓冲液稀释至刻度,摇匀,滤过,精密量取续滤液1 mL置于10 mL量瓶中,用pH=11.0的磷酸盐缓冲液稀释至刻度,摇匀。精密量取上述配制的奥美拉唑对照品溶液20 µL注入高效液相色谱仪,记录色谱图,求得平均回收率为100.7%,RSD为1.1%。结果表明,本实验方法准确性良好。
2.2.5 溶液稳定性
精密称取奥美拉唑约20 mg,分别用水、pH值为1.2的氯化钠盐酸溶液、pH值为6.0、6.8、7.8、8.7、11.0 的磷酸盐缓冲液配制成质量浓度为20 µg·mL-1的供试品溶液,置于37 ℃ 水浴中,分别于0、1、2、4、6、8 h精密进样20 µL,测定奥美拉唑的峰面积,计算各时间点奥美拉唑的百分含量,结果见图 1 (pH为 8.7和7.8分别对应释放度测定项下pH 6.8和6.0供试品溶液的pH值)。结果表明,奥美拉唑在碱性条件下稳定,酸性条件下迅速降解,且酸性越强降解越快。
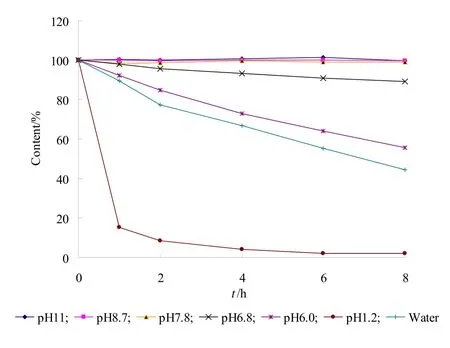
图1 奥美拉唑在不同pH值溶液中的稳定性试验结果Fig.1 Stability of omeprazole in different pH solution
2.2.6 含量测定
参照《中华人民共和国药典》奥美拉唑肠溶胶囊的含量测定法[2],取奥美拉唑肠溶胶囊20粒,精密称定,计算平均装质量。取内容物,混合均匀,研细,精密称取适量(约相当于奥美拉唑20 mg)置于100 mL量瓶中,加入乙醇20 mL、磷酸盐缓冲液(pH=11.0)约60 mL,超声处理使奥美拉唑溶解,用pH=11.0的磷酸盐缓冲液稀释至刻度,摇匀,滤过,精密量取续滤液1 mL,置于10 mL量瓶中,用pH=11.0的磷酸盐缓冲液稀释至刻度,摇匀,精密量取20 µL注入高效液相色谱仪,记录色谱图,每个样品重复操作3次;另精密称取奥美拉唑对照品约20 mg,置于100 mL量瓶中,加乙醇10 mL溶解后,用pH=11.0的磷酸盐缓冲液稀释至刻度,摇匀,得奥美拉唑贮备液,精密量取5 mL,置于50 mL量瓶中,用pH=11.0的磷酸盐缓冲液稀释至刻度,摇匀,同法测定。按外标法以峰面积计算5种奥美拉唑肠溶胶囊(Losec、A、B、C、D)的标示百分含量分别为(99.7±0.8) %、(99.4±0.6)%、(99.5±0.4) %、(102.5±1.3) %、(101.5±0.9) %。
2.3 不同pH介质中释放度的测定
2.3.1 在pH为1.2的氯化钠盐酸溶液中
取5个厂家的奥美拉唑肠溶胶囊(Losec、A、B、C、D),采用《中华人民共和国药典》溶出度测定法(附录XD第二法,桨法) 装置[2],以pH为1.2的氯化钠盐酸溶液500 mL为释放介质,转速为100 r·min-1,依法操作,待释放120 min时,弃去释放介质,用少量磷酸盐缓冲液(pH=11.0)将颗粒移至100 mL棕色量瓶中,按照含量测定项下的方法,自“加乙醇20 mL”起依法测定,每个样品重复操作6次。按外标法以峰面积计算5种试样品在pH为1.2的释放介质中释放120 min后剩余奥美拉唑的百分含量,测得5种胶囊剩余百分含量分别为:(97.6±1.0)%、(97.9±0.9)%、(96.6±1.5)%、(97.0±0.8)%、(97.4±1.2)%。结果表明,5 个生产厂家的奥美拉唑肠溶胶囊均具有较好的耐酸性。
2.3.2 在纯化水中
按照“2.3.1”中释放度测定项下的方法,将释放介质更换为900 mL纯化水,依法测定,测得5种测试样品(Losec、A、B、C、D) 在纯水中释放120 min后剩余奥美拉唑百分含量分别为:(91.3±1.6)%、(93.8±1.2)%、(82.6±1.9)%、(94.6±1.6)%、(77.5±0.9)%。结果表明,Losec、A、C在纯化水中释放度小于10%,释放度较小,B和D在纯化水中的释放度较大。
2.3.3 在pH为6.0的磷酸盐缓冲液中
取各厂家奥美拉唑肠溶胶囊6粒,采用《中华人民共和国药典》溶出度测定法(附录XD第二法,桨法)装置[2],以pH为6.0的磷酸盐缓冲液900 mL为释放介质,转速分别为100、50 r·min-1,依法操作,分别于5、10、20、30、45、60 min取溶液10 mL,滤过,精密量取续滤液5 mL,加入0.25 mol·L-1氢氧化钠溶液 l mL,摇匀,作为供试品溶液;另精密称取奥美拉唑对照品约10 mg,置于100 mL量瓶中,加乙醇10 mL溶解后,用释放介质稀释至刻度,摇匀,精密量取5 mL,置于50 mL量瓶中,用释放介质稀释至刻度,摇匀,再精密量取5 mL,精密加入0.25 mol·L-1氢氧化钠溶液 l mL,摇匀,作为对照品溶液。取供试品溶液与对照品溶液,按照含量测定项下的测定方法,计算各时间点累积释放度,绘制释放曲线。 在100 r·min-1和50 r·min-1两种转速条件下,5 种样品的释放曲线见图2、图3。
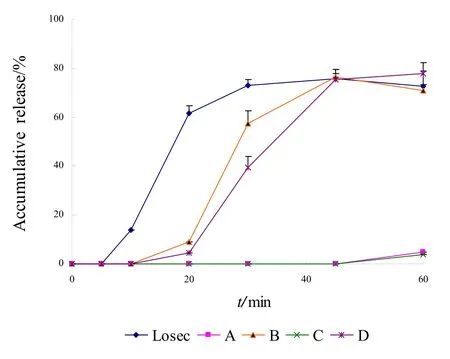
图2 五厂家制剂在pH为6.0的磷酸盐缓冲液中的释放曲线(100 r·min-1)Fig.2 Release curves of preparations from 5 manufacturers in pH 6.0 PBS(100 r·min-1)
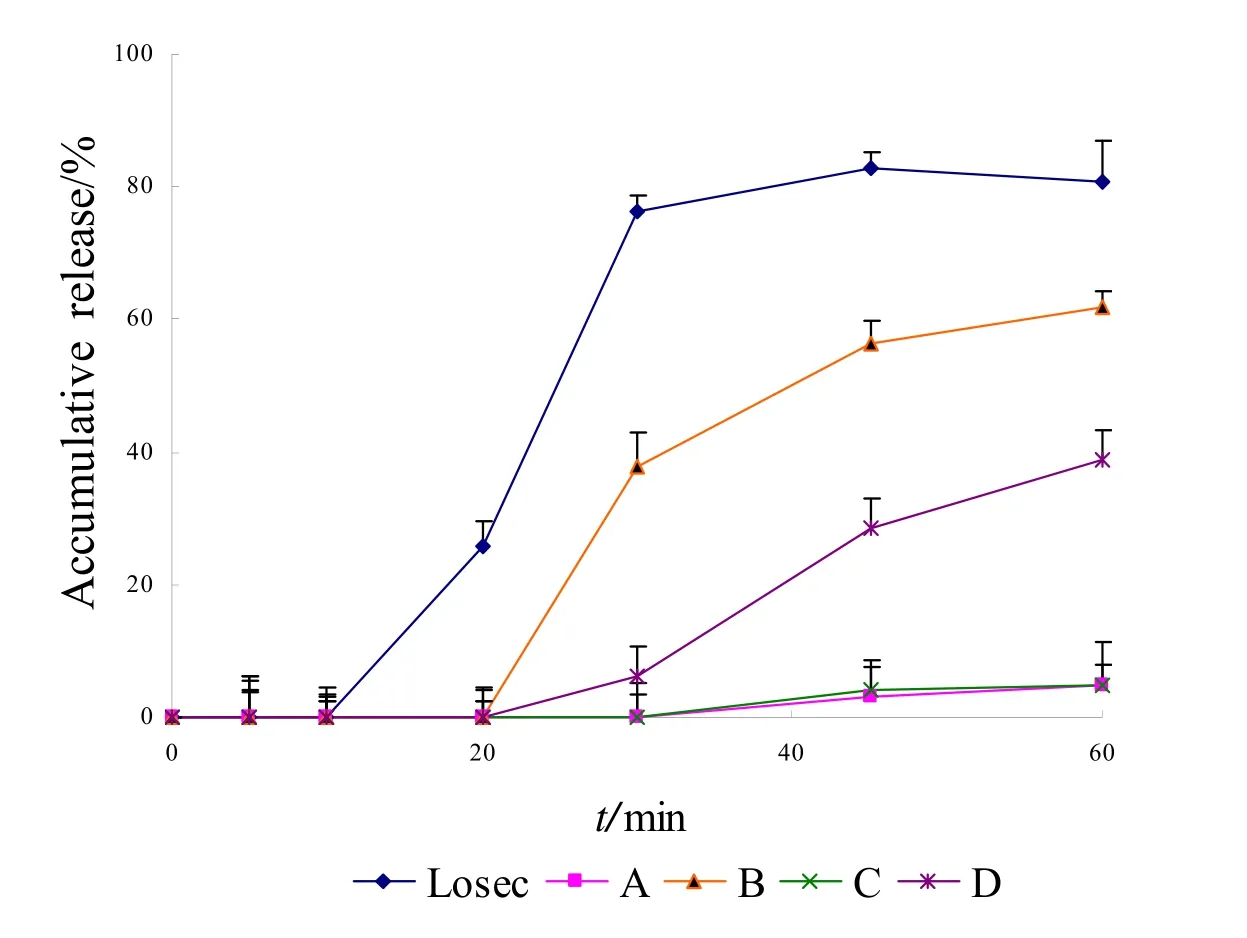
图3 五厂家制剂在pH为6.0的磷酸盐缓冲液中的释放曲线(50 r·min-1)Fig.3 Release curves of preparations from 5 manufacturers in pH 6.0 PBS(50 r·min-1)
结果表明,在pH为6.0的磷酸盐缓冲液中,在两种转速条件下,Losec 的释放速度最快,释放曲线最早达到平台期;其中样品A和C在60 min时的累积释放度低于5%;在100 r·min-1条件下样品B、D 在45 min时的累积释放度与Losec相近,但在50 r·min-1条件下国产制剂的累积释放度均低于Losec。
2.3.4 在pH为6.8的磷酸盐缓冲液中
按照“2.3.3”中释放度测定项下的方法,将释放介质更换为pH为6.8的磷酸盐缓冲液,依法测定,计算各时间点累积释放度,绘制5种样品的释放曲线。在100 r·min-1和50 r·min-1两种转速条件下,5 种样品的释放曲线见图4、图5。
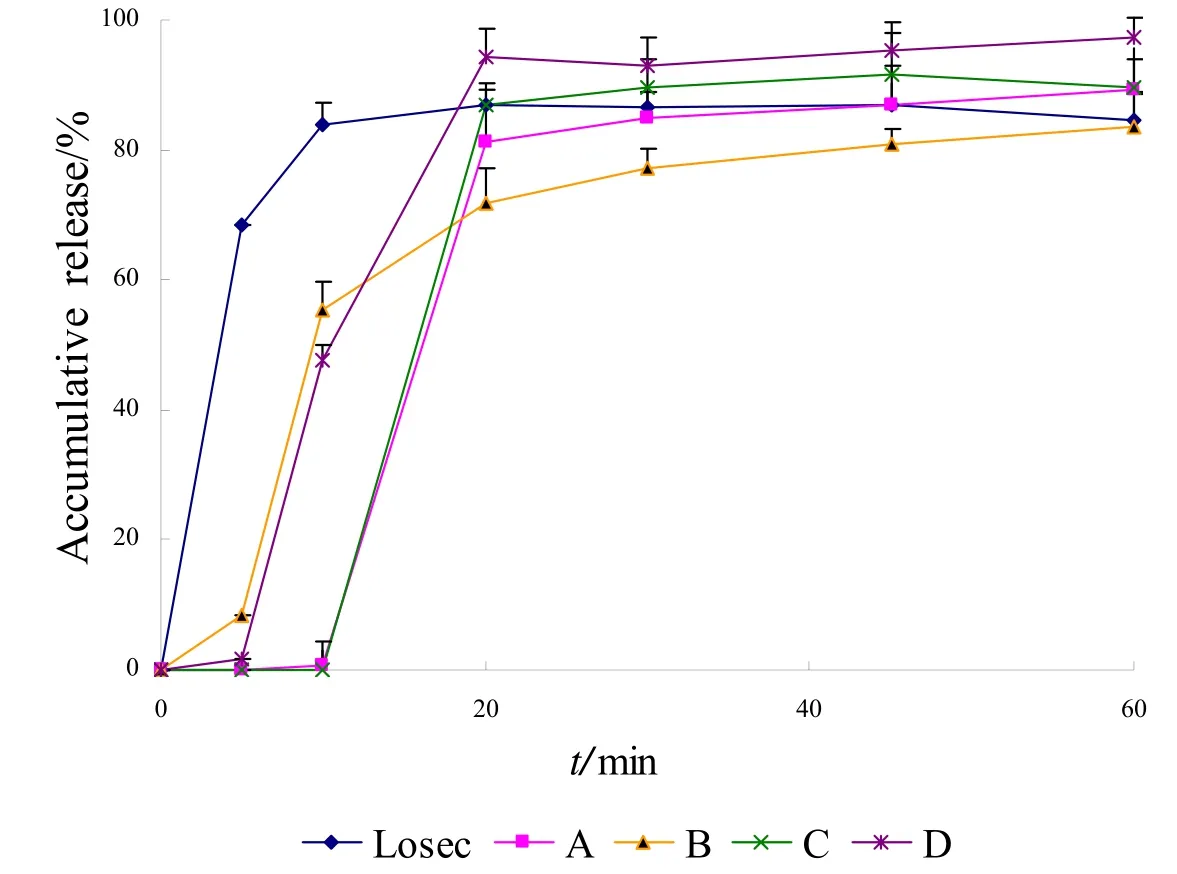
图4 五厂家制剂在pH为6.8的磷酸盐缓冲液中的释放曲线(100 r·min-1)Fig.4 Release curves of preparations from 5 manufacturers in pH 6.8 PBS(100 r·min-1)
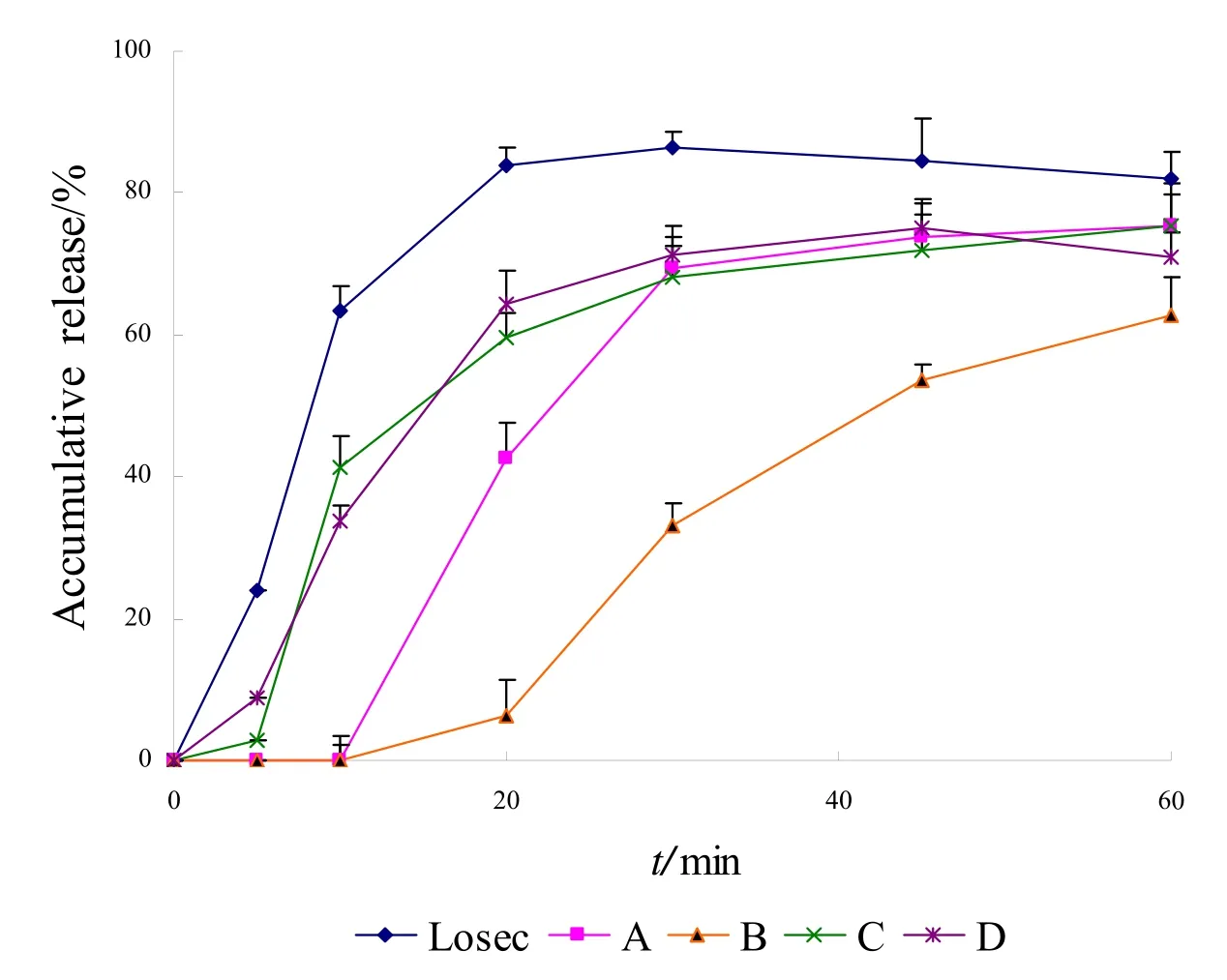
图5 五厂家制剂在pH为6.8的磷酸盐缓冲液中的释放曲线(50 r·min-1)Fig.5 Release curves of preparations from 5 manufacturers in pH 6.8 PBS(50 r·min-1)
结果表明,在pH为6.8的磷酸盐缓冲液中,在两种转速条件下,Losec 的释放速度最快,释放曲线最早达到平台期;在100 r·min-1条件下,样品A、C、D 在45 min时的累积释放度高于Losec,而在50 r·min-1条件下国产制剂的累积释放度均低于Losec。
2.4 释放曲线相似性分析
参照文献[3]的方法,以Losec作为参比制剂,其他厂家的制剂为受试制剂,计算释放曲线的相似因子f2,以定量评价释放曲线之间的差别。本实验选择所有时间点计算f2值,结果见表1。若参比制剂与受试制剂释放曲线相似,则 f2值在50~100,f2值越大,两条曲线的相似性越高。
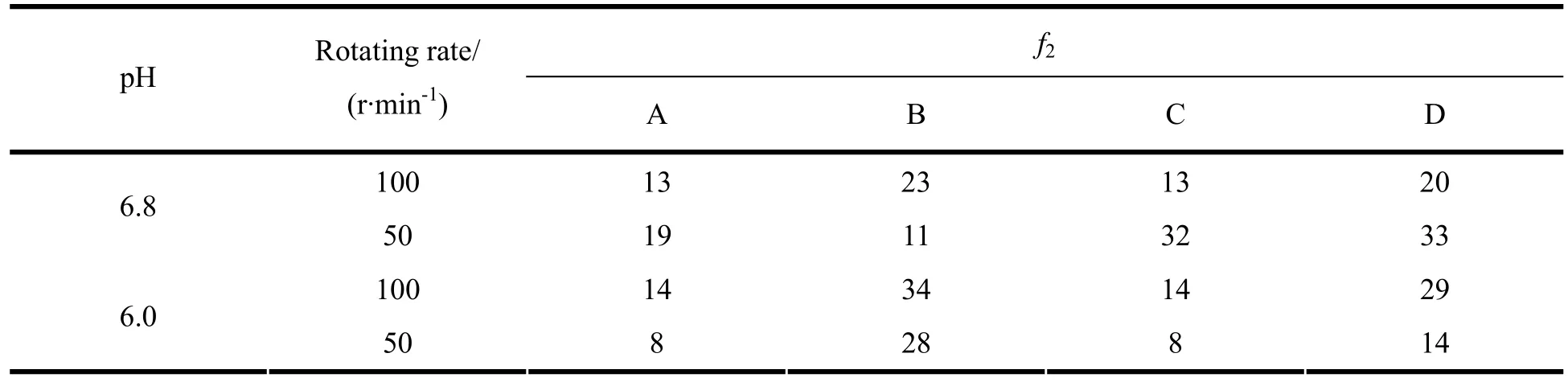
表1 释放曲线相似性分析结果Table 1 Similarity analysis results of release curves
3 讨论
奥美拉唑肠溶胶囊的设计思路是使制剂在pH 值为 1.2 的介质和纯化水(pH=5.5)中不释放药物,而是在pH值为6.8的介质中能迅速释放药物,考虑到溃疡患者肠道 pH 值降低以及奥美拉唑在酸性条件下的不稳定性,故制备的肠溶胶囊制剂应该是在pH值为6.0的介质中能缓慢释放药物。肠溶制剂的释药行为与其处方、工艺密切相关,因此,考察不同释放介质和条件下的药物释放行为对研究肠溶制剂的质量尤为重要[4]。
实验结果表明,5个厂家的奥美拉唑肠溶胶囊在pH 值为1.2 的释放介质中的耐酸性均较好,在pH 值为 6.8 的介质中、100 r·min-1条件下,45 min的累积释放度均大于80%,符合《中华人民共和国药典》要求,但国产制剂与Losec 释放曲线存在一定的差异;样品B和D在纯化水中释放度较大,对于肠道pH降低的溃疡患者,存在药物在体内降解的可能性;4个国产厂家的制剂在pH 值为 6.0 的介质中的释放速度和药物释放量均低于Losec,样品 A和C的药物释放量甚至低于5%,这对于部分肠道pH值降低的溃疡患者,存在药物在体内难以释放的可能性。从释放曲线也可以看出,4种国产制剂在50 r·min-1条件下的释放速度和药物释放量均明显低于Losec,但当转速升至为100 r·min-1时,制剂 A、C、D 的释放量则高于Losec。考虑到某些患者身体机能虚弱、胃肠蠕动功能较差等因素,考察制剂在低转速条件下的释放行为更具有临床实际价值。
综上所述,部分国产奥美拉唑肠溶胶囊的体外释放行为与原研制剂相比存在一定的差异,这可能会导致制剂在体内生物利用度的差异,临床用药时应加强监控。
[1] 张启明, 谢沐风, 宁保明, 等. 采用多条溶出曲线评价口服固体制剂的内在质量[J].中国医药工业杂志, 2009, 40(12)∶946–950,955.
[2] 国家药典委员会. 中华人民共和国药典:二部[S].北京:化学工业出版社, 2010∶1040–1041.
[3] 谢沐风. 溶出曲线相似性的评价方法[J]. 中国医药工业杂志, 2009,40(4)∶308–310.
[4] 简晓娜, 蒋学华, 王凌. 奥美拉唑在不同pH介质中的释放曲线及其在肠溶制剂质量评价中的应用[J]. 华西药学杂志, 2011,26(5)∶476–478.
Comparison of in vitrorelease of profiles be tween do mestic omeprazole enteric-coated capsules and the innovator product
CHENG Meng, ZOU Mei-juan,CHENG Gang*
(School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China)
ObjectiveTo investigate the in vitro release of domestic omeprazole enteric-coated capsules from 4 manufacturers and the innovator product(Losec), so as to compare their in vitro release behaviors and provide suggestions for clinical use. Methods HPLC method was adopted for the determination of accumulative release rate of samples in pH 1.2 hydrochloric acid solution of sodium chloride, purified water, pH 6.0 and pH 6.8 phosphate buffer at different rotating rates. The similarity of release curves was determined. Results The acid resistance of omeprazole capsules from 5 manufacturers in pH 1.2 medium was preferable. The release rate of Losec, A and C in purified water was below 10% within 2 h, while the others was above 10%. The release curves of omeprazole capsules from domestic manufacturers were notsimilar with Losec in both pH 6.0 and pH 6.8 phosphate buffer. Conclusions There are differences in release behaviors between omeprazole capsules from 4 domestic manufacturers and the innovator product (Losec), indicating that attention should be paid to their difference in clinical use.
pharmaceutics; omeprazole enteric-coated capsule; HPLC; release curves; similarity
R 94
A
(2014)06–0193–08
(本篇责任编辑:秦 昕)
2014-04-02
程盟(1988–),女(汉族),辽宁开原人,硕士研究生,Tel.15204063352,E-mail 249250009@qq.com;
*通讯作者:程刚(1963–),男(汉族),辽宁康平人,教授,博士,博士生导师,主要从事药剂学研究,Tel. 024–23986326,E-mail chenggang63@hotmail.com。
