1398中性蛋白酶的色谱柱纯化与分子鉴定
2014-06-13赵忠润黄娇芳史吉平孙俊松
赵忠润, 陈 超, 黄娇芳, 俞 峰, 史吉平, 孙俊松*
1.白银赛诺生物科技有限公司,甘肃白银730914;
2.中国科学院上海高等研究院,生物炼制实验室,上海201210
1398食品级中性蛋白酶是一种利用枯草芽胞杆菌1398发酵产生的用于食品加工处理的中性蛋白酶[1]。国内生产厂家在采用枯草芽胞杆菌1398发酵生产中性蛋白酶时,发酵液粘稠,在后提取过程中无法用传统的板框压滤使固液分离,通常将发酵液连同菌体一起进行喷雾干燥得到产品[2],这样的产品不仅酶活较低,而且有很大的臭味,因此限制了其在食品工业中的应用。目前高效的液体制剂只有外资企业能生产。1398中性蛋白酶的发酵原料主要由豆粕、麸皮、玉米粉等廉价原料组成,改变这些原料配方或发酵方式常用于提高产品单位酶活[3,4],但是鲜有能够改善发酵液粘性及产品提取工艺的功效。因此,有必要系统地对1398中性蛋白酶的发酵液进行有效的菌液分离技术及蛋白质纯化工艺的研究,从而实现液体蛋白酶产品的工业化生产。
开发中性蛋白酶液体制剂的另一途径是通过对生产菌种进行物理化学方法的传统诱变[5,6],以降低发酵液粘度或提高发酵液的单位酶活;或者利用基因工程手段,将1398中性蛋白酶基因构建到表达载体中,再重组到枯草芽胞杆菌的基因组内进行稳定的外源分泌表达[7,8]。其中,以分子生物学手段研究并对工业酶进行工程改造是工业酶的发展方向,它建立在对枯草芽胞杆菌转录组学、代谢网络调控等系统生物学及分泌表达系统、DNA重组系统等表达平台的研究基础上[9,10]。现代工业酶的研究也要求对宿主细胞遗传操作系统、目的蛋白的理化性质等有全方位的了解。本文针对1398中性蛋白酶液体制剂的研发困境,从酶的分离纯化工艺着手,改进了蛋白酶纯化工艺,进而对纯化的蛋白酶进行了质谱分析和基因克隆,确认了1398中性蛋白酶的基因序列及可能的成熟肽段序列,并与模式菌株枯草芽胞杆菌168进行了比较,为开发新一代的重组中性蛋白酶液体制剂奠定了研究基础。
1 材料与方法
1.1 菌株、质粒
枯草芽胞杆菌(Bacillus subtilis)1398为白银赛诺生物科技有限公司菌种室保藏。DH5α感受态细胞为本实验室自制;克隆载体pGEM-T vector购自生工生物工程(上海)股份有限公司。
1.2 试剂
质粒小量提取试剂盒、PCR清洁回收试剂盒与DNA凝胶回收试剂盒均购自Axygen公司;T4 DNA连接酶及DNA限制性内切酶购自Takara公司;Taq DNA聚合酶为MBI Fermentas公司产品;KOD聚合酶为TOYOBO公司产品;其他生化试剂均为国产或进口分析纯。
1.3 仪器与耗材
Maldi-Tof质谱仪(美国英杰生命科技有限公司);Akta Purifier UPC10(美国通用公司,GE);HiprepTMSP FF16/10(20mL)阳离子交换柱(GE);大孔吸附树脂HPD-400(河北宝恩吸附材料科技有限公司)。
1.4 培养基
大肠杆菌培养基(LB培养基):NaCl 10 g/L,胰蛋白胨10 g/L,酵母浸取物5 g/L,121℃高压蒸汽灭菌20min。
枯草芽胞杆菌1398种子培养基(肉汤培养基):牛肉膏 10 g/L,胰蛋白胨 10 g/L,NaCl 5 g/L,pH 7.0,121℃高压蒸汽灭菌 20min。
发酵培养基:麸皮55 g/L,玉米粉35 g/L,豆粕 15 g/L,Na2HPO43 g/L,KH2PO40.3 g/L,121℃高压蒸汽灭菌20min。
1.5 枯草芽胞杆菌的发酵培养
从保藏的斜面挑取一环菌体,接入20mL肉汤培养基中,250 r/min、32℃培养16 h后,取种子培养液4mL接入40mL发酵培养基中,250 r/min、32℃发酵培养48 h后测定酶活。
1.6 1398中性蛋白酶纯化
1.6.1 离子交换型树脂纯化 采用GE预装阳离子交换柱HiprepTMSP FF16/10在色谱仪Akta Purifier上进行蛋白纯化。取 200mL发酵液16 000 g离心10min,收集上清100mL加入100mL buffer A(20mmol/L磷酸钠缓冲液,pH 7.5)稀释后上样,上样比例为 1∶4,上样量为40mL;上样结束后,用2倍柱体积的buffer A清洗柱子,再以buffer B(20mmol/L磷酸钠缓冲液-1 mol/L CaCl2,pH 7.5)进行梯度洗脱,收集洗脱液,测定酶活,同时收集发酵上清进行变性聚丙烯酰胺凝胶电泳(SDS-PAGE)。
1.6.2 工业级吸附型大孔树脂纯化 用大孔吸附树脂制备柱床体积为20mL的纯化柱。取200mL发酵液15 000 r/min离心10min,收集上清100mL加入100mL buffer A(20mmol/L磷酸钠缓冲液,pH 7.5)稀释后,以1∶4 进行上样,上样量为40mL,流速为10mL/min;然后用水和buffer A各洗2个柱体积,最后分别用含10%、20%、30%、40%和50%乙醇的buffer A各洗脱2个柱体积,收集洗脱液。
1.7 1398中性蛋白酶酶活测定
按照QB/T1803-1993标准进行。1398中性蛋白酶1个单位酶活(U)的定义为1min内,水解酪素产生1 μg酪氨酸所需的酶量[11]。酪氨酸测定采用紫外分光光度法,具体如下:取稀释好的粗酶液2mL,在30℃水浴中温浴3min,加入2mL用pH 7.5磷酸缓冲液配制的1%酪素(对照组加入4mL三氯乙酸),混匀,30℃反应10min,加入三氯乙酸4mL(对照组加入2mL酪素),摇匀。取出静置10min后过滤,取滤液于275 nm下测定吸光度,根据吸光度计算酶活力。计算蛋白质浓度(mg/mL),纯化后的比酶活与初始比酶活的比值定义为纯化度。
1.8 1398中性蛋白酶蛋白鉴定与基因克隆
1.8.1 中性蛋白酶的SDS-PAGE分析 取发酵液10 μL 加入 5×上样缓冲液3 μL,混匀,沸水煮10min,离心后进行12%聚丙烯酞胺凝胶电泳。考马斯亮蓝R250染色2 h,再脱色4~8 h,期间更换脱色液数次。
1.8.2 Maldi-Tof质谱鉴定 分离后纯化后的1398蛋白酶经SDS-PAGE分离,以刀片切出单一条带,先切碎为1 mm见方的小粒,胶内胰蛋白酶水解,提取、标记及质谱鉴定方法参见Wang等[12]方法,Moldi-Tof的测定及分析由中国科学院北京基因组研究所公共技术服务中心完成。获得样品的肽段指纹数据后,利用MASCOT软件与已知基因组数据库进行比对分析。
1.8.3 基因克隆及测序 1398枯草芽胞杆菌基因组DNA的提取参照Axygen公司试剂盒说明书进行。根据枯草芽胞杆菌模式菌株168 nprE基因序列(NCBI登录号 NC_000964.3)设计引物nprEF(5'-GTGGGTTTAGGTAAGAAATTGTC-3')和nprER(5'-TTACAATCCAACAGCATTCCAGGCTG-3'),扩增1398中性蛋白酶基因序列。所获得的DNA片段由Axygen公司胶回收试剂盒纯化,经TA克隆,插入到pGEM-T载体中,阳性质粒DNA由上海生工生物工程公司测序。对测得的基因序列进行比对分析,分析工具采用里昂蛋白质生化研究所网上工具(http://npsa-pbil.ibcp.fr)。

图1 离子交换树脂层析分离纯化中性蛋白酶1398Fig.1 Purification of 1398 neutral protease by ionic exchange column chromatography.
2 结果与分析
2.1 发酵液酶活检测
在工业生产蛋白酶的过程中,发酵液粘度较大,无法进行后续提取纯化工作,所以有必要采取离心法将固液分离,取上清进行后续纯化。在本实验中,摇瓶发酵结束后,取发酵液4 500 r/min离心10min可以有效达到分离目的。取发酵液上清稀释后测定酶活,酶活可以达到6 000 U左右;下层固体中酶活存留约1 000 U。虽然酶活有一定损失,但是离心方法用于这种粘度较高的发酵液后处理过程非常有效。
2.2 离子交换树脂层析分离纯化中性蛋白酶
采用GE预装离子交换型树脂HiprepTMSP FF16/10对发酵液中的中性蛋白酶1398进行纯化,结果见图1。通过离子交换树脂吸附发酵液中的中性蛋白酶1398,buffer B梯度洗脱过程中出现一个较大的吸收峰和一个较小的吸收峰,测定各收集管中洗脱液的酶活,其中较高吸收峰所对应的收集管A10酶活最高,对各收集管中的样品进行SDS-PAGE分析,A10管中的蛋白质条带最明显,且目标条带大小(38 kDa)和原发酵液中的目的条带大小一致(图2),说明分离纯化得到的是目标中性蛋白酶,而且纯化后的样品酶活损失较小,A10收集峰中的总酶活占上样酶活的40%以上(表1)。离子交换树脂柱层析可以有效地对发酵液进行进一步纯化,脱色、除臭效果明显(图3)。虽然蛋白电泳中蛋白质条带并没有明显减少,但纯化度显示,纯化后比酶活增加,而且经过柱分离后的1398中性蛋白酶制剂澄清透明,没有臭味,完全可以应用于食品加工过程。

图2 离子交换树脂纯化后中性蛋白酶1398的SDS-PAGE电泳Fig.2 SDS-PAGE of purified 1398 neutral protease by ionic exchange column chromatography.

表1 离子交换树脂纯化发酵液中中性蛋白酶1398的酶活测定Table 1 Analysis of enzyme activity of neutral proteinase 1398 purified by ionic exchange column chromatography.
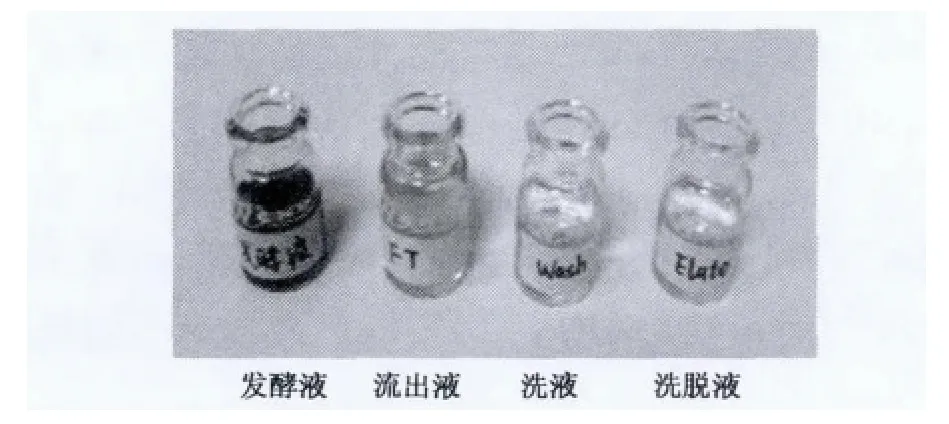
图3 发酵液纯化后的脱色效果Fig.3 Decolorization of the purified fermentation broth.
2.3 工业级大孔树脂分离纯化中性蛋白酶1398

图4 大孔树脂分离纯化中性蛋白酶1398Fig.4 Purification of 1398 neutral protease by using macroporous sorbent resin.
为适应工业化生产要求,采用工业级大孔吸附树脂对发酵液中中性蛋白酶1398进行分离纯化研究,结果见图4。大孔树脂吸附也是利用离子交换的原理,只是蛋白质的解离洗脱成分不同,生产及回收利用的成本均比较低。比较不同浓度乙醇对吸附蛋白的洗脱效果,结果显示,30%乙醇洗脱时吸收峰最高。对不同浓度乙醇洗脱下的收集液进行的酶活测定也发现,30%乙醇洗脱液中酶活最高,但是与原发酵液中的酶活比较,损失较大,说明乙醇对酶活有抑制作用。SDS-PAGE结果显示,蛋白酶含量与酶活结果也保持一致,30%乙醇洗脱峰中的蛋白酶浓度最高(图5,表2)。此外,研究中还发现,将贮有收集液的瓶敞口放置于4℃冰箱20 d左右,待乙醇挥发一部分后再次测定酶活,收集液中的酶活均有所回升(数据未显示),说明降低洗脱液中的乙醇浓度可以提升总酶活。使用乙醇洗脱的方法既简单又快捷,使用的洗脱液成分可以重复使用,因此工业生产所带来的化学污染较小,得到的液体中性蛋白酶产品无色无味,并且可以根据需要,通过进一步的卷式膜浓缩制取得到高浓度的市售产品。
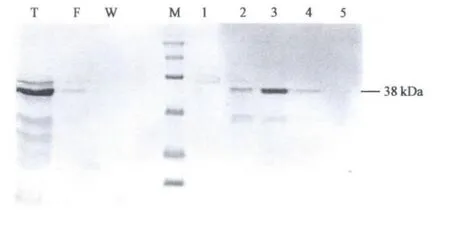
图5 大孔树脂纯化后中性蛋白酶1398的SDS-PAGE电泳Fig.5 SDS-PAGE of purified 1398 neutral protease by using macroporous sorbent resin.

表2 大孔树脂纯化发酵液中中性蛋白酶1398的酶活测定Table 2 Analysis of enzyme activity of neutral proteinase 1398 purified by using macroporous sorbent resin.
2.4 1398中性蛋白酶的分子鉴定
纯化得到的1398中性蛋白酶经Maldi-Tof质谱分析,与已发布的微生物基因组信息库比对(结果未显示),确认1398中性蛋白酶与模式菌株枯草芽胞杆菌168 NprE蛋白为同源蛋白。利用枯草芽胞杆菌168 nprE基因序列设计引物,以1398基因组DNA为模板,扩增得到约1.5 kb特异片段(图6),经测序获得1398 nprE同源基因片段,与168nprE基因序列比对分析,核苷酸序列有3个碱基不同(结果未显示),但仅有1个碱基变化引起蛋白质序列改变,在靠近蛋白酶成熟肽末端,第260位氨基酸在1398中为组氨酸(His),168中为酪氨酸(Tyr)(图7)。

图6 1398中性蛋白酶基因的PCR扩增Fig.6 PCR amplication of 1398 neutral protease gene.
3 讨论
AS1398是我国自主分离得到的枯草芽胞杆菌工业生产菌株,经过多次物理化学方法诱变,可以特异性地大量分泌表达中性蛋白酶,在我国被广泛应用于工业生产中[15]。但是枯草芽胞杆菌1398在发酵中粘度过大,色素等其他次级产物过多,对提取和最终产品质量有很大影响,不再适应当前对中性蛋白酶产品规格要求的提高[16]。本研究发现,在实验室条件下,摇瓶发酵结束后,通过离心可以很好地达到固液分离的目的,且85%以上酶活存留于发酵液上清中,可以用于进一步纯化。工业生产中仍需考虑更好的固液分离手段并进一步减少固体中的酶活损失。实验证实,离子吸附可以有效纯化发酵液中的1398中性蛋白酶,且完全去除色素和异味物质,应用工业级大孔树脂也可以达到实验室级预装柱的分离效果。

图7 1398中性蛋白酶与模式菌株枯草芽胞杆菌168的NprE氨基酸序列比对分析Fig.7 Alignment analysis of amino acid sequence between 1398 neutral protease and NprE of Bacillus subtilis 168.
本研究利用质谱分析对该蛋白酶的序列进行了分析,确定了中性蛋白酶的序列,建立了后期进行异源分泌表达生产、蛋白酶定向工程改造的研究基础[17,18]。本研究利用质谱分析首次确定了1398蛋白酶与枯草芽胞杆菌模式菌株168 NprE为同源蛋白,已获得的1398蛋白酶片段与168 NprE蛋白之间仅有1个氨基酸的差异。但根据168 nprE序列全长,无法在1398基因组中获得类似的上游序列(结果未显示),说明1398菌株作为工业生产菌株,与模式菌株168存在较大差异,1398菌株中性蛋白酶编码基因上游调控序列可能与1398菌株中性蛋白酶高产性状相关,下一步工作将克隆上游调控序列,从而解析与发酵产量、发酵液粘度等相关的分子机理,并为进行高效的外源重组表达奠定基础。
[1]吴京平.几种促进因子对中性蛋白酶活力影响比较[J].食品科技.2008,(6):12-15.
[2]李忠玲,张强,马齐,等.产蛋白酶枯草芽孢杆菌的复壮及生产初步研究[J].中国酿造.2009,(4):102-103.
[3]刘婷,张天斌,林元山.产中性蛋白酶菌株的筛选及其发酵条件的优化[J].湖南农业科学,2009,(5):102-104,107.
[4]孙晓鸣,王萍,邬向东.产中性蛋白酶芽胞杆菌配伍发酵响应面法研究[J].中国食品学报,2010,10(2):117-124.
[5]李艳丽,许少春,许尧兴.中性蛋白酶高产菌株的筛选及产酶酶系分析[J].生物技术,2007,17(1):20-23.
[6]赵 丛,殷向斌,张 敏,等.N+离子注入技术在中性蛋白酶高产菌株选育中的应用[J].原子能科学技术,2008,42(12):1130-1134.
[7]许波,黄遵锡,陈金全,等.枯草芽孢杆菌AS1398中性蛋白酶基因的克隆及其在毕赤酵母中的高效表达[J].云南师范大学学报,2005,25(3):51-56.
[8]白玮,张锐,郭三堆.枯草芽孢杆菌B111中性蛋白酶基因BS2在毕赤酵母中的表达[J],中国农业科学,2009,42(3):876-883.
[9]Jo H D,KwonG H, ParkJY, et al.. Cloningand overexpression of aprE3-17 encoding the major fibrinolytic protease of Bacillus licheniformis CH 3-17[J].Biotechnol.Bioprocess Eng.,2011,16:352-359.
[10]Wang J,Xu A,Wan Y,et al..Purification and characterization of a new metallo-neutral protease for beer brewing from Bacillus amyloliquefaciens SYB-001[J].Appl.Biochem.Biotech.,2013,170(8):2021-2033.
[11]姜锡瑞.酶制剂应用手册[M].北京:中国轻工业出版社,1999,292-299.
[12]Wang J,Zhao C,Meng B.,et al..The proteomic alterations ofThermoanaerobactertengcongensis cultured atdifferent temperatures[J].Proteomics,2007,7(9):1409-1419.
[13]Wang L F,Devenish R J.Expression of Bacillus subtilis neutral protease gene(nprE)in Saccharomyces cerevisiae[J].J.Gen.Microbiol.,1993,139(2):343-347.
[14]Wang L F, EkkelS M, Devenish R J. Expression in Escherichia coli of the Bacillus subtilis neutral protease gene(NprE)lacking its ribosome binding site[J].Biochem.Int.,1990,22(6):1085-1093.
[15]王海洪,吴汉民.枯草杆菌AS1.398制备中性蛋白酶的研究[J].浙江水产学院学报,1996,15(3):179-183.
[16]胡学智,王俊.蛋白酶生产和应用的研究[J].工业微生物,2008,38(4):49-61.
[17]赵丛,张敏,王建玲,等.枯草芽孢杆菌ZC-7中性蛋白酶的分离纯化及酶学性质研究[J].中国生物工程杂志,2007,27(10):28-33.
[18]Zhu M J,Cheng J R,Chen H T,et al..Optimization of neutralprotease production from Bacillussubtilis:using agroindustrial residues as substrates and responsesurface methodology[J].Biotechnol.Appl.Biochem.,2013,60(3):336-342.
