盐碱胁迫下不同燕麦品种钠、钾、钙流量测定分析
2014-06-13杨海峰刘景辉王俊英
杨海峰, 刘景辉, 王俊英
1.内蒙古农业大学,呼和浩特010019;
2.中国农业科学院生物技术研究所,北京100081
Na+在植物体内各个组织、器官中的分布与作物的耐盐性密切相关,Na+/K+比是衡量作物耐盐性的一个重要指标。植物中Na+和K+为竞争性关系,因此盐胁迫下通常造成植物中Na+的过量渗入和K+的降低。研究发现,限制Na+吸收、增加Na+外排,同时保证K+的吸收,维持细胞质低Na+/K+比是植物维持正常代谢和提高抗盐性的关键[1~4]。Ca2+作为第二信使,能够在植物体内传递盐信号,开启体内一系列的级联反应,将根部多余的Na+泵出体外,将地上部分茎、叶中的Na+转到液泡中以调节细胞内的Na+平衡,以减少Na+对植物的毒害[5,6]。
燕麦主要种植在我国西北土壤贫瘠地区,具有较强的抗旱、耐盐碱能力,在荒漠化治理,改善当地生态环境方面有重要作用。为研究不同燕麦品种的耐盐性,本实验选取了4个燕麦种植区的主栽品种,应用电感耦合等离子体质谱(ICP-MS)法测定了不同燕麦品种在不同pH生长条件下,不同器官中的离子含量。
ICP-MS分析技术是一种无机微量及痕量元素分析技术,近年来发展迅速,该技术精密度高、线性范围宽、简便快速、干扰少、可多元素同时分析,检出限一般比电感耦合等离子体原子发射光谱(ICP-AES)低2~3个数量级。应用ICP-AES测定植物无机元素的研究较多[7~11],在测定植物体内不同器官离子含量中引入电感耦合等离子体质谱测定方法的研究还很少,主要应用在医药类、生物样品、地质样品中测定多种微量元素[12~14]。
本研究首次应用这种高灵敏度的快速检测方法检测不同离子间的微弱变化,可以为精准评价燕麦的耐盐性提供理论基础和分析方法。
1 材料和方法
1.1 实验材料
实验选用4个裸燕麦品种。其中,燕科一号为内蒙古农科院选育的本地主栽品种,坝莜8号、花早2号和白燕2号为其他省市选育的栽培品种。种子均采自内蒙古武川县燕麦品种异地鉴定示范基地。
1.2 主要仪器
电感耦合等离子体质谱仪(美国Agilent7500cx型);Milli-Q超纯水仪(美国Millipore公司)。
1.3 标准物质与试剂
HNO3为优级纯试剂;水为超纯水(18.2 MΩ)。
标准储备液:10 mg/L Na、K、Ca混合标准溶液(5%HNO3介质),购自国家标准物质中心,以0.32 mol/L HNO3逐级稀释备用。
内标溶液:由 100 mg/L Sc、Ge、In、Bi的混合标准储备液稀释为10 mg/L(5%HNO3介质)(Agilent,Part#5188-6525)。
(一)医疗服务定价原则与办法缺乏顶层设计。中国地域辽阔,经济发展水平差距大,财政补助政策差异更大,各地区医疗服务价格定价办法有多种,国家卫生、发改、财政等部门虽然出台了《医疗服务价格规范》,但没有统一的定价原则,定价办法。没有调价的程序、调价的依据、调价的范围、调价的幅度、调价的方法规制。从专家发表的研究资料中披露了多种定价方法,已经为政府主管部门制定价格定价原则和办法提供了思路。
调谐溶液:1 μg/L Li、Mg、Y、Ce、Tl、Co 混合标准溶液(5%HNO3介质)(Agilent,Part#5185-5959)。
1.4 实验方法
1.4.1 样品处理 将供试的4个裸燕麦品种分别播种于两种土壤中,pH分别为8.0和8.8,其他养分条件一致,盆栽。每份材料播种3盆(3次重复),每盆播种30粒。待盆内幼苗长到约15cm后,保留生长健壮且基本一致的20株幼苗继续培养,生长50 d后,分别取0.5 g根、茎、叶组织,加800目石英砂研磨,用灭菌的去离子超纯水定容到5mL,室温放置4 h,8 000 r/min离心,取上清液,过0.22 μm滤膜后作为上样样品待测。
1.4.2 仪器条件的优化 采用Agilent公司调谐溶液在仪器设置的Tune程序下对仪器参数进行优化。在优化的工作条件下,Li、Y和Tl的灵敏度分别不低于 3 000、8 000和 4 000,氧化物含量(156CeO+/140Ce+)<1.5%,双 电 荷 干 扰(70Ce2+/140Ce+)<3%。为了尽可能减少质谱干扰,提高检测灵敏度,选用23Na、39K和43Ca为同位素。
1.4.3 标准曲线的绘制 以0.32 mol/L HNO3将 Na、K、Ca混合标准储备液逐级稀释为 0、0.01 μg/L、0.05 μg/L、0.10 μg/L、0.50 μg/L和1.00 μg/L的系列标准溶液。使用仪器优化参数,测定空白样品及系列标准溶液,自动绘制标准曲线并确定线性相关系数。
1.4.4 方法检出限的测定 使用仪器优化参数,测定空白样品,取10次平行结果;测定各元素标准溶液,取3次平行结果,按以下公式计算方法的检出限。
检出限(ng/L)=[3(σ/(S-B)]×C
1.4.5 方法的重复性验证 对Na、K、Ca混合标准液分两个浓度分别进行9次平行测定,计算相对标准偏差。
1.4.6 燕麦样品的测定 每一个燕麦样品分别进行9次平行测定,一次上样量2mL,计算相对标准偏差。
2 结果与分析
2.1 标准曲线的绘制
仪器自动绘制的标准曲线和确定的线性相关系数见表1。如表1所示,测定不同稀释浓度Na+、K+、Ca2+含量的相关系数均在 0.99 以上,表明优化后的仪器测定条件及标品可用于实际样品的测定。

表1 Na+、K+、Ca2+标准曲线的线性相关Table 1 The linear correlation of standard curve of Na+,K+and Ca2+.
2.2 方法检出限的确定
按1.4.4中的测定方法测定,所得结果代入公式计算得出方法的检出限。各元素检出限分别为 K+:10.0 ng/L、Na+:8.0 ng/L、Ca2+:5.0 ng/L。
2.3 方法重复性的验证
对Na、K、Ca混合标准液进行9次平行测定,结果见表2。相对标准偏差均小于1%,误差在痕量分析允许范围内,表明方法精密度良好。
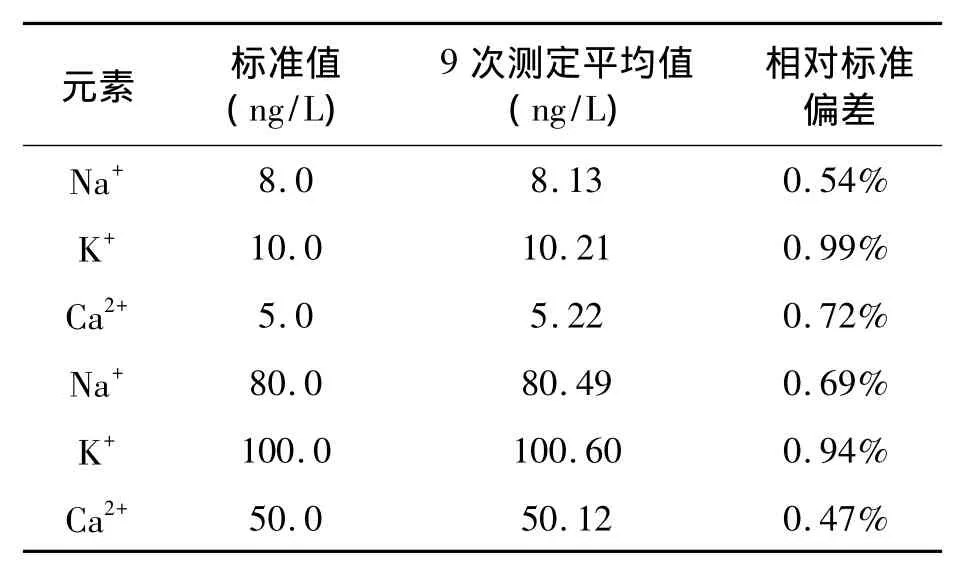
表2 测定方法的重复性验证Table 2 Verification of repeatability of the determination method.
2.4 燕麦样品中Na+、K+和Ca2+含量的分析
四个裸燕麦品种在不同pH下生长,利用电感耦合等离子体质谱法测定根、茎和叶中Na+、K+和Ca2+含量,结果见表3。
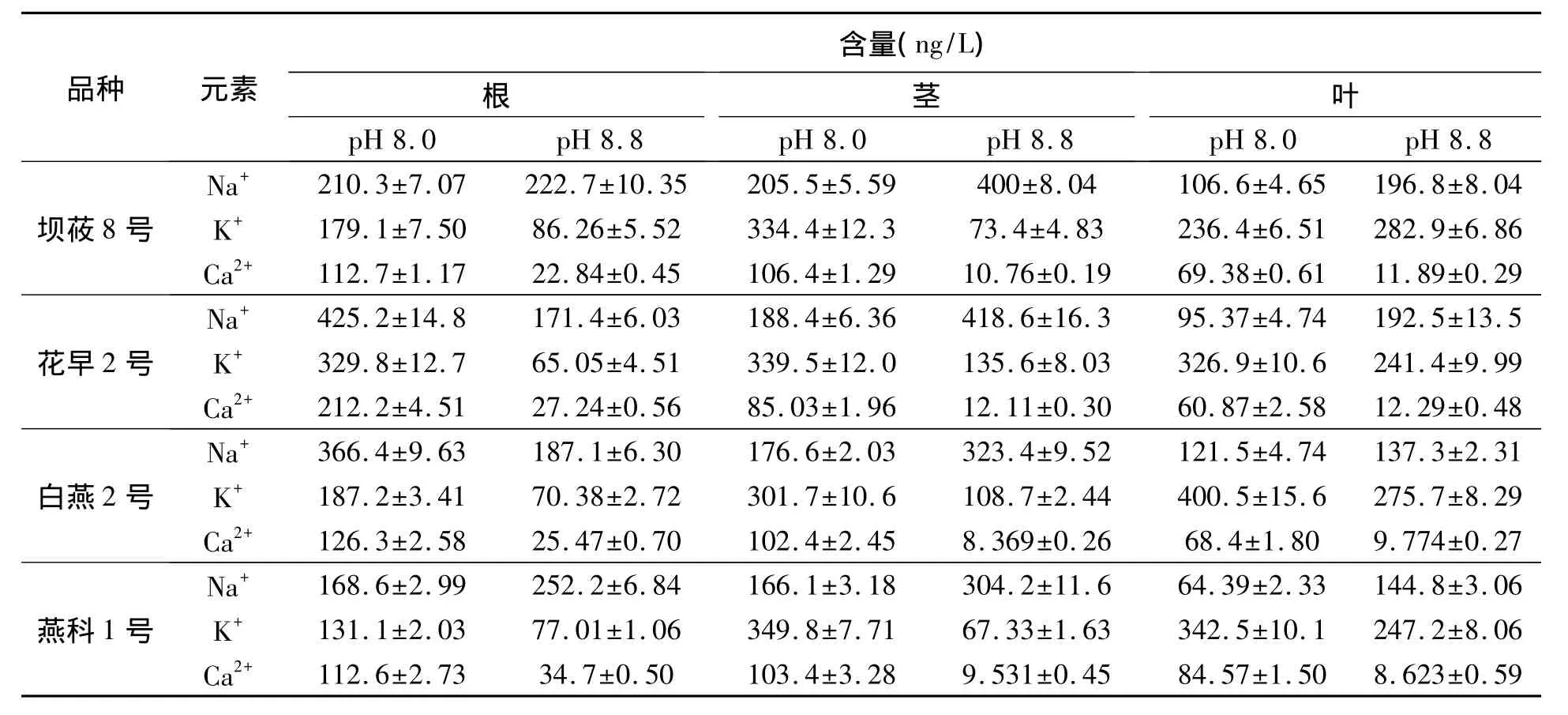
表3 四个裸燕麦品种根、茎、叶中Na+、K+、Ca2+含量Table 3 Content of Na+,K+and Ca2+in roots,stems and leaves of four oat varieties.
实验结果显示,当土壤pH增大时,四个裸燕麦栽培品种茎和叶中的Na+含量都在升高,而在根中显示了不同的趋势,花早2号和白燕2号Na+含量是随着pH的升高而降低的。但是在测试的4个裸燕麦栽培品种中相同的趋势是,在低盐碱(pH 8.0)生长条件下,燕麦植株中Na+的累积主要在根部,Na+在整个植株中的分布是根中含量大于茎,茎大于叶;在高盐碱(pH 8.8)处理条件下,不同燕麦品种中Na+的累积主要在茎而不是根,茎中Na+含量高于根和叶片,表明这四个裸燕麦品种应答盐碱胁迫的机制主要是将Na+隔离在茎中以减少根和叶中的Na+含量,维持燕麦正常生长。
分析K+含量显示:在低盐碱生长条件下,只有根中的K+含量低于Na+,茎和叶中K+均高于Na+;在高盐碱胁迫下,只有叶片中的K+含量高于Na+含量,表明供试的四个燕麦品种在受到土壤pH升高胁迫时,首先维持叶片中低Na+/K+比值。结果同样显示4个裸燕麦品种无论是在高盐碱还是低盐碱条件下,都能够维持叶片中Na+/K+比值最低(见图1),维持叶片的低Na+/K+比值是植物在盐碱条件下能够正常生长的条件。
在正常生长条件下,植物地上部茎、叶含有较多的钙,而根部中则较少[5,6],检测结果显示,无论在土壤低盐碱条件(pH 8.0)还是高盐碱条件(pH 8.8)下,四个裸燕麦品种中Ca2+的积累主要在根部,Ca2+的浓度在根部的含量最高(见图2),表明Ca2+含量对土壤pH的敏感度更高,推测对燕麦而言,在受到盐碱胁迫时,Ca2+可能是先于Na+和K+发生含量变化的离子。
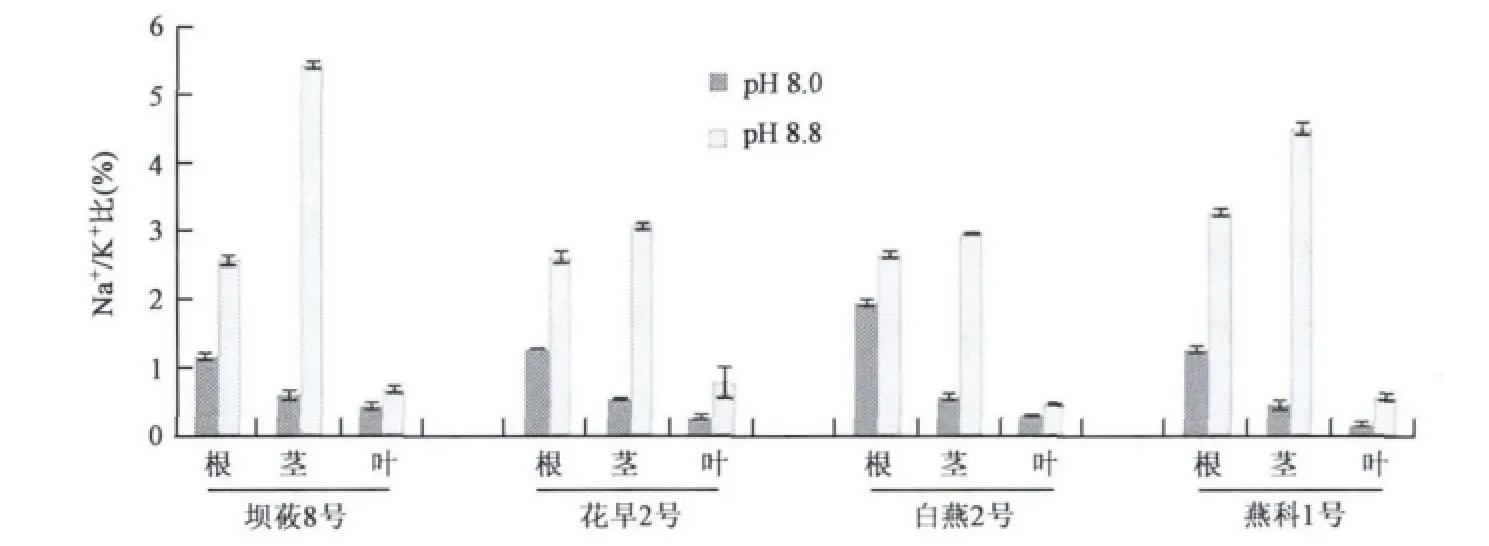
图1 4个裸燕麦品种在不同pH条件下根、茎、叶中Na+/K+比值Fig.1 Na+/K+ratio in root,stem and leaf from four oat varieties under growth condition with different pH value.
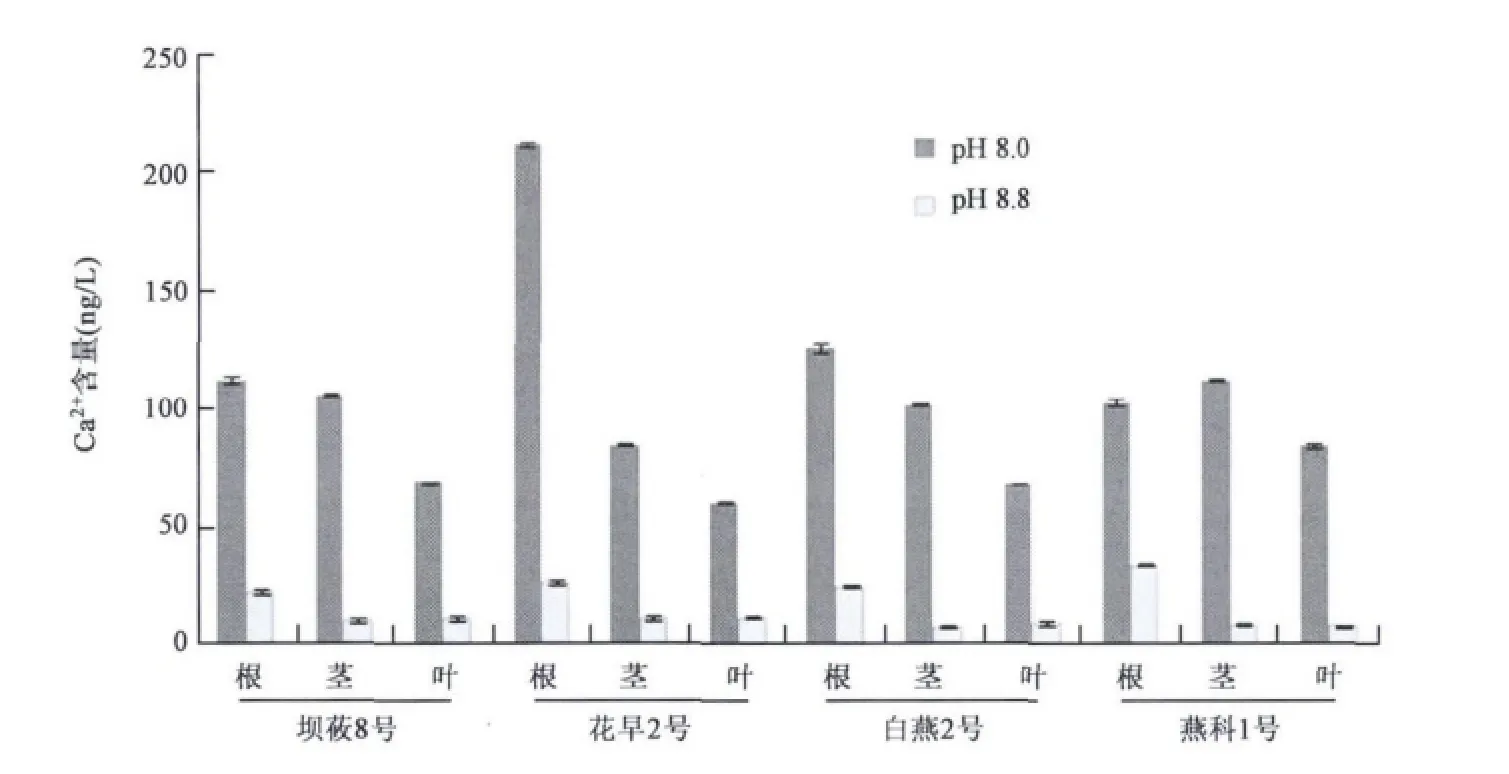
图2 4个裸燕麦品种在不同pH条件下根、茎、叶中Ca2+含量Fig.2 Comparison of Ca2+in root,stem and leaf of four oat varieties under growth condition with different pH value.
3 讨论
植物在受到盐碱胁迫时,对Na+、K+和Ca2+的吸收与累积是一个动态平衡的过程,很多时候各离子的变化非常微弱,但是这种微弱的变化所导致的Na+、K+和Ca2+比例的变化有可能成为一系列生理变化的原因之一,因此采用更灵敏的检测方法来测定盐碱胁迫下植株体内离子的浓度,是深入研究离子浓度变化与生理变化关系的一个有力手段。通常测定植物Na+、K+、Ca2+含量一般是使用原子吸收方法[15],在大量测定样品时耗时较长,而且原子吸收相对ICP-MS而言,灵敏度较低[16]。本实验结果表明ICP-MS适用于作物体内各个器官不同离子含量的分析,可用作为研究植物抵抗环境离子胁迫生理机制研究方面的一个工具。
研究发现,植株对抗盐胁迫必须限制Na+的渗入,增加Na+外排,同时保证K+的吸收,特别是在植物生长点及幼嫩叶片处保持低Na+。维持细胞质低 Na+/K+比值是植物抗盐性的关键[1]。Volkov等[17]研究发现,在盐胁迫条件下,盐芥根部Na+内流明显小于拟南芥根部Na+内流,因此比拟南芥更具耐盐性。郭房庆等[18]比较了盐胁迫下抗盐突变体和野生型小麦Na+、K+累积的差异,发现抗盐突变体的根、尤其是叶中Na+的相对累积显著低于野生型,而K+的累积则显著高于野生型。本研究对耐盐碱作物燕麦的检测结果显示,在高盐碱(pH 8.8)处理条件下,不同燕麦品种中Na+的含量主要累积在茎而不是根、叶中,推测燕麦在盐胁迫下抵抗离子胁迫的应答反应是将根中的Na+向上运送到茎,并且减少茎向叶片中的运输,以维持根和叶中有较低的Na+含量及Na+/K+比。根是植物吸收水分、养分的主要器官,降低根部Na+浓度有利于K+及其他养分,水分的吸收;叶片是植物进行光合作用、蒸腾作用等生命过程主要场所,推测维持叶片低Na+/K+比是燕麦在盐胁迫下能够正常生长发育的条件。
由于植物体内钙的主要运输动力是蒸腾作用,当作物在高盐碱条件下的水分吸收以及蒸腾作用受到限制时,根部向上运输钙的过程受限,钙主要累集在根部。本实验结果显示,虽然这四个裸燕麦栽培品种Ca2+的吸收在高盐碱条件下显著降低,但钙的积累仍然主要在根部,这表明当土壤pH 8.8时,4个燕麦品种中钙的向上运输均已受抑,其中花早2号无论在低盐碱还是高盐碱条件下均在根中累集了大量的Ca2+,并且在高盐碱条件下叶片中Na+/K+比最高,推测花早2号是供试的4个裸燕麦品种中耐盐碱性较弱的一个品种。
[1]Zhu J K.Regulation of ion homeostasis under salt stress[J].Curr.Opin.Plant Biol.,2003,6(5):441-445.
[2]Pardo J M,Cubero B,Leidi E O,et al..Alkali cation exchangers:roles in cellular homeostasis and stress tolerance[J].J.Exp.Bot.,2006,57(5):1181-1199.
[3]陈惠哲,Ladatko N,朱德峰,等.盐胁迫下水稻苗期Na+和K+吸收与分配规律的初步研究[J].植物生态学报,2007,31(5):937-945.
[4]赵旭,王林权,周春菊,等.盐胁迫对四种基因型冬小麦幼苗Na+、K+吸收和累积的影响[J].生态学报,2007,27(1):205-213.
[5]Kiegle E,Moore C A,Haseloff J,et al..Cell-type-specific calcium responses to drought salt and cold in Arabidopsis roots[J].Plant J.,2000,23(2):267-278.
[6]Sun J,Dai S,Wang R,et al..Calcium mediates root K+/Na+homeostasis in poplar species differing in salt tolerance [J].Tree Physiol.,2009,29(9):1175-86.
[7]段留生,张明才,董学会,等.等离子体原子发射光谱法(ICP-AES)测定玉米和大豆根系伤流液中无机元素流量[J].光谱学与光谱分析,2008,28(11):2671-2673.
[8]石荣丽,邹春琴,芮玉奎,等.ICP-AES测定中国小麦微核心种质库籽粒矿质养分含量[J].光谱学与光谱分析,2009,29(4):1104-1107.
[9]生吉萍,刘灿,申琳.有机和常规种植条件下樱桃番茄的营养物质含量与矿物元素ICP-AES分析[J].光谱学与光谱分析,2009,29(8):2244-2246.
[10]张运良,刘延成,石少明,等.ICP-AES法测定广西黄柏中多种金属元素含量[J].光谱学与光谱分析,2009,29(10):2848-2850.
[11]姚世响,陈莎莎,徐栋生,等.不同盐胁迫对新疆耐盐植物藜叶片钾、钠元素含量及相关基因表达的影响[J].光谱学与光谱分析,2010,30(8):2281-2284.
[12]刘彬,杨丙雨,冯玉怀,等.ICP-MS法在测定痕量贵金属中的应用[J].贵金属,2009,30(4):63-72.
[13]程和勇,徐子刚,黄旭,等.电感耦合等离子体质谱测定不同酒类中铬、砷、镉、汞、铅含量[J].浙江大学学报,2009,36(6):679-682.
[14]彭荣飞,侯建荣,黄聪,等.碰撞池ICP-MS直接测定尿液中16个痕量元素的研究[J].中国卫生检验杂志,2009,19(11):2475-2477.
[15]刘利娥,刘 诘,于 斐,等.原子吸收光谱法测定芝麻中矿物元素含量[J].现代预防医学,2009,36(18):3517-3524.
[16]刘宏伟,秦宗会,谢华林,等.ICP-OES/ICP-MS测定葵花子中28种无机元素[J].光谱学与光谱分析,2013,33(1):224-227.
[17]Volkov V,Amtmann A.Thellungiella halophila,a salt-tolerant relative of Arabidopsis thaliana,has specific root ion-channel features supporting K+/Na+homeostasis under salinity stress[J].Plant J.,2006,48(3):342-353.
[18]郭房庆,汤章城.NaCl胁迫下抗盐突变体和野生型小麦Na+、K+累积的差异分析[J].植物学报,1999,41(5):515-518.
