泰山照山白金丝桃苷诱导人乳腺癌细胞的细胞周期阻滞和凋亡的机制研究*
2014-06-13周长香李福荣
周长香 李福荣
(1.泰安市第一人民医院,山东 泰安,271000;2. 泰山医学院药物化学教研室,山东 泰安,271016)
照山白(Rhododendron micranthum Turcz),又名万经棵、照山白杜鹃,属于杜鹃花科杜鹃花属植物小花杜鹃[1]。主要分布在我国东北、华北等地[3]。
照山白中含有皂苷、鞣质、还原性物质、多糖、黄酮、油脂和挥发油等多种化学成分, 目前对照山白化学成分报道较少。从传统的中医记载看[2,3],照山白有祛风通络、调经止痛、化痰止咳的作用。枝叶入药,用于慢性气管炎、风湿麻痹、痛经、产后关节痛、高血压等[4]。但对照山白单体如金丝桃苷(Hyperin)成分的研究及抗氧化损伤和抗肿瘤作用研究鲜有报道。已有学者证实照山白提取物可有效抑制多种癌细胞的增长,诱导癌细胞的凋亡,具有抗肿瘤的作用,但其促进细胞凋亡的途径及分子生物学机制尚不明确[5]。
细胞凋亡或称程序性细胞死亡(programmed cell death,PCD),近年来发现细胞凋亡与许多疾病尤其是肿瘤有密切关系,在肿瘤的发生发展中往往伴有抑凋亡基因的表达增强或促凋亡基因表达的受抑,因而细胞凋亡的研究对肿瘤的发生、预防和治疗都有着广阔的前景[5]。然而目前中药成分抗肿瘤在分子水平上的研究尚不深入,为了进一步探讨照山白抗癌细胞的作用机制,本实验应用MTT法,流式细胞术PI染色、及western blot检测金丝桃苷处理对人乳腺癌细胞株MCF-7的细胞生长、细胞周期以及凋亡相关蛋白的表达的影响,旨在进一步探讨其抗乳腺癌的可能机制。
1 材料与方法
1.1 材料与试剂
1.1.1材料 人乳腺癌细胞株MCF-7购于中科院生化细胞所,细胞周期检测试剂盒购自南京凯基生物公司,兔抗人CDK2、Cyclin A及caspase 3多克隆抗体及二抗羊抗兔IgG均购自美国基因(CST) 公司。二甲基亚砜(DMSO)为北京化工厂产品;RPMI-1640培养基、胎牛血清(FBS)购自GIBCO公司;MTT购自Sigma公司;胰蛋白酶-EDTA消化液购自北京Solarbio科技有限公司。
1.1.2照山白金丝桃苷单体的制备 金丝桃苷由泰山医学院药物化学合成教研室提供。根据已有文献[6]从泰山杜鹃属植物照山白枝叶中提取,纯化,经与对照品比对,高效液相色谱法测定纯度在98%以上。将金丝桃苷溶解在二甲基亚砜(DMSO)中,作为原液,储存在-20 ℃,并在实验前用培养基稀释。整个研究过程中DMSO的终浓度的不超过0.1%,对照组相应的用含0.1%DMSO培养基处理。
1.1.3细胞培养及干预 将MCF-7细胞置于含10%FBS的RPMI-1640培养基中,置于37 ℃、5%CO2恒温培养箱中培养,80%~85%融合率后常规传代。
1.2 方法
1.2.1MTT法检测细胞生长 取对数生长期细胞, 制成1×105/ ml的细胞悬液, 接种于96孔培养板,每孔加细胞悬液100 μl培养过夜,PBS洗涤,实验组分别加入浓度为1 μg/L、10 μg/L、100 μg/L、1 mg/L、2 mg/L的金丝桃苷,对照组只加培养基。金丝桃苷组分别继续培养24 h、48 h、72 h、96 h、120 h后, 加入MTT溶液( 5 mg/ml) 10 μl继续培养4 h, 弃去各孔内液体, 每孔加入100 μl二甲基亚砜,置振荡器上振荡5 min, 使细胞内和周围的紫色颗粒充分溶解,室温放置10 min,于全自动酶标仪上测定各孔A490 nm值,取3孔平均值计算细胞抑制率:抑制率%= (1-实验组A值)/对照组A值×100%。
1.2.2流式细胞仪 PI染色分析各实验组细胞周期变化:以含10%FBS的RPMI-1640培养液调整细胞密度至每毫升1×105个,按每瓶2 ml接种于25 ml的细胞培养瓶,每48 h更换培养液1次。待细胞融合率为80%~85%时,无血清培养使细胞同步化于G0期,然后按分组分别加金丝桃苷处理24 h。细胞分组如下。对照组:仅含培养基; 金丝桃苷低、中、高剂量处理组: (10 μg/L、100 μg/L、1 mg/L)。取出各处理组细胞培养瓶,胰蛋白酶消化,分别收集细胞入试管中。以1000 转/分离心5 min,弃上清,加入4℃PBS缓冲液,涡旋混匀,再离心,洗涤细胞2次。4 ℃ 70%的乙醇约0.5 ml贴壁缓慢加入试管中固定细胞。以1800 转/分离心5 min,弃去固定液。再加PBS离心洗涤细胞1次。每106细胞加入500 U的RNA酶,置 37℃孵育30 min。离心去除RNA酶,再经PBS洗1次,离心去上清液。加入50 mg/L的PI lml,室温下避光染色20 min后,300目尼龙网过滤。上流式细胞仪测定(激发波长488 nm ,氢离子激光),用multcycleDNA分析软件包进行细胞周期分析。
1.2.3Western blot法检测蛋白的表达 细胞接种、分组、消化处理同上,预冷的PBS 洗2 次,加入1ml细胞裂解液充分混合,冰上放置30 min,12000 转/min 离心10 min,取上清,BCA法进行蛋白定量。总蛋白经SDS-PAGE分离后,转移至PVDF膜上,加入5%脱脂奶粉室温封闭2 h,再加入1∶1000稀释的兔抗人的抗体,4 ℃过夜,用TBST洗3次,加入相应的二抗,室温孵育1 h,漂洗4次,ECL显色后,用Image软件进行灰度分析。
1.2.4统计学处理 实验数据以均数±标准差表示。采用SPSS 13.0软件分析对实验数据进行one-way ANOVA分析及LSD两两比较。P<0.05为差异有统计学意义。
2 结 果
2.1 金丝桃苷对人乳腺癌细胞株MCF-7增殖的抑制作用(表1,图1) 。
MTT法测定结果显示金丝桃苷对人乳腺癌细胞株MCF-7有抑制作用,并呈浓度和时间依赖效应。
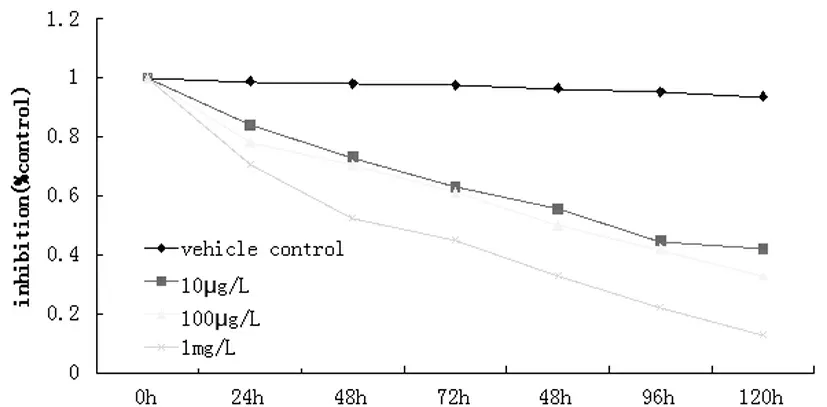
图1 MTT检测金丝桃苷对 MCF-7生长的抑制作用
2.2 实验各组药物对细胞周期的影响(表2)。
与对照组相比,金丝桃苷各处理组DNA倍体分析显示G2/M期细胞比例显著高于对照组、S期细胞百分比低于对照组(P<0.05或P<0.01),表1为流式细胞仪PI 染色DNA倍体分析统计结果。
表1 金丝桃苷对人乳腺癌细胞株 MCF-7生长的抑制作用
注:aP<0.05vs vehicle control,bP<0.01 vs vehicle control,cP<0.01 vs 10 μg/L Hyperin。
表2 金丝桃苷对人乳腺癌细胞株MCF-7各细胞周期细胞数量分布的影响
aP<0.05vs vehicle control,bP<0.01 vs vehicle control,cP<0.01 vs 10μg/L Hyperin。
2.3 实验各组细胞周期及凋亡相关蛋白表达的变化(图2) 。
Western blot结果表明,与对照组相比,经金丝桃苷处理后,CDK2、Cyclin A表达降低而caspase 3的表达增高,其中高剂量组较低剂量组组间则有明显差异(P<0.05)。
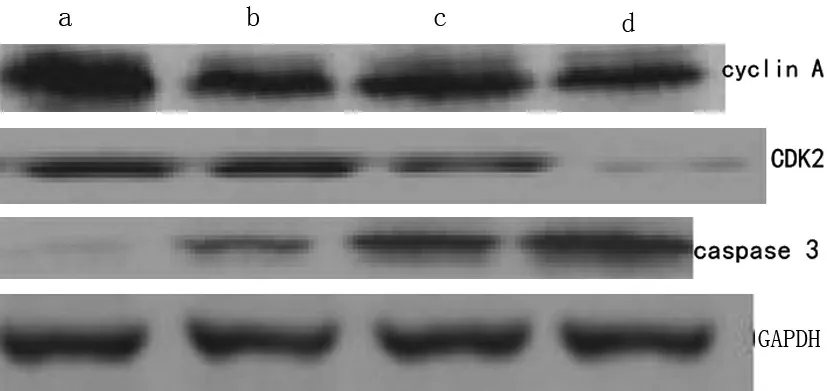
图2 金丝桃苷对细胞周期相关蛋白Cyclin A, CDK2和凋亡相关蛋白 caspase 3表达的影响
a: vehicle treated; b: 10μg/L Hyperin; c: 100μg/L Hyperin; d: 1mg/L Hyperin
3 讨 论
已有研究表明,金丝桃苷和槲皮素等黄酮类成分对心肌缺血损伤有明显的保护作用。而金丝桃苷作为黄酮醇苷化合物具有抗氧化和镇痛作用,已被广泛用于临床治疗。与其他黄酮类物质相比,金丝桃苷具有低毒、无诱变性等特点,具有抑制癌细胞的活性。
细胞要分裂,必须正确复制DNA和达到一定的体积,在获得足够物质支持分裂以前,细胞不可能进行分裂。细胞周期的运行,是在一系列称为检验点(check point)的严格检控下进行的,当DNA发生损伤,复制不完全或纺锤体形成不正常,周期将被阻断[7]。细胞周期蛋白依赖性激酶CDK2与细胞周期蛋白结合才具有激酶的活性,另外,细胞中还具有细胞周期蛋白依赖性激酶抑制因子(CDK inhibitor,CKI)对细胞周期起负调控作用,在G2/M期,cyclinA、cyclinB与CDK1结合,CDK1使底物蛋白磷酸化、如将组蛋白H1磷酸化导致染色体凝缩,核纤层蛋白磷酸化使核膜解体等下游细胞周期事件,完成一个细胞周期[7]。
为了探讨金丝桃苷诱导乳腺癌细胞凋亡的具体通路,本研究应用MTT法检测细胞生长的抑制作用,结果显示, 10μg-1mg/L 金丝桃苷能显著抑制细胞的生长, 10μg/L金丝桃苷作用48h后抑制率可达23.81%,并且金丝桃苷对乳腺癌细胞的抑制作用具有时间和剂量依赖性效应。为探究细胞生长抑制的原因,本研究应用流式细胞术PI染色检测细胞周期的分布,显示细胞分裂增殖最旺盛的G2/M期细胞比率显著增多,提示细胞分裂被明显抑制,复制不完全,正常细胞周期被阻断。而在下一步的实验中,促进通过细胞周期G2/M期检验点的细胞周期调节蛋白cyclin A与CDK2表达下降,同时凋亡家族的最后通路caspase 3表达增高,可见金丝桃苷抑制肿瘤细胞的生长与细胞周期阻滞,促进细胞凋亡有关。
目前认为除既往研究较清楚的两个主要通路: 细胞凋亡的细胞膜死亡受体通路; 细胞色素C释放和caspases激活的线粒体途经。细胞凋亡不仅在维持细胞群体数量的稳定、胚胎发育和免疫系统的克隆选择方面起着作用, 而且在肿瘤发生、发展及抗肿瘤治疗等方面有十分重要的作用[9]。研究细胞凋亡对肿瘤的发生发展及治疗均有指导意义。用现代生物学技术研究中医药抗肿瘤疗效及其分子机制的研究越来越引起人们的关注[8,9]。
总之,实验结果证实,金丝桃苷作用后抑制MCF-7细胞生长,呈时间和剂量依赖性地诱导细胞周期G2/M期阻滞及细胞凋亡。这提示金丝桃苷通过阻断细胞生长的正常细胞周期、使DNA复制受阻、同时激活caspases凋亡途径可能是乳腺癌细胞凋亡发生的重要环节,通过研究金丝桃苷抑制癌细胞的信号转导途径,将为寻找低毒、少副作用的抗癌制剂提供新线索,开发靶点特异、高效的天然抗癌药物,可望为恶性肿瘤的中医药治疗及其机制研究提供新的切入点。至于金丝桃苷对促凋亡蛋白表达调控具体的信号转导机制还有待进一步研究。
[1] 宋立仁, 洪恂, 丁绪亮, 等. 现代中药学大辞典[M]. 北京: 人民卫生出版社, 2001.
[2] 杨秀岭, 袁志芳,张兰桐,等. 照山白总黄酮药理作用研究[J]. 中草药,2006, 37(4): 583-585.
[3] Quinn J. Inflammation and cerebral amyloidosis are disconnected in an animal model of Alzheimer's disease[J]. J Neuroimmunol, 2003, 137: 32-41.
[4] Cagnin A. Positron emission tomography imaging of neuro inflammation[J]. Neurotherapeutics, 2007, 4: 443-452.
[5] Ducrey B, MarstonA, Gohring S, etal. Inhibition of 5 alpha reductase and aromatase by the ellagitannins oenothein A and oenothein B from Epilobiumspecies[J]. Planta Med, 1997, 63(2): 111-114.
[6] 夏重道,杜安全,王红萍,等照山白有效成分的化学研究[J].中国药科大学学报,1999,13(4):99.
[7] Matsumoto M, Furihata M, Ishikawa T et al. Comparison of deregulated expression of cyclin D1 and cyclin E with that of cyclin-dependent kinase 4 (CDK4) and CDK2 in human oesopha-geal squamous cell carcinoma[J]. Br J Cancer, 1999, 80:256-261.
[8] Kang SS, Lee JY, Choi YK, et al. Neuroprotective effects of flavones on hydrogen peroxide-induced apoptosis in SH-SY5Y neuroblostoma cells[J]. Bioorg Med Chem Lett, 2004, 14 (9) : 2261-2264.
[9] Xiao B, Guo J, Liu D, Zhang S: Aloe-emodin induces in vitro G2/M arrest and alkaline phosphatase activation in human oral cancer KB cells[J]. Oral Oncol, 2007,43: 905-910.
