乙型肝炎病毒诱导HLA-G的表达及其临床意义
2014-06-13周林杰郑贞苍王鑫陈鹏
周林杰,郑贞苍,王鑫,陈鹏
(恩泽医疗中心路桥医院 重症监护室,浙江 台州 318050)
人类白细胞抗原-G(human leukocyte antigen-G,HLA-G)是机体内一个重要的免疫耐受分子,属于非经典HLA I分子。在正常情况下,HLA-G分子表达具有组织特异性,仅在绒毛外滋养层细胞、角膜细胞等少数免疫豁免组织上表达。随着研究的不断深入,发现HLA-G分子在多种病理条件下(如病毒、炎症、肿瘤、自身免疫病等)能够获得诱导性表达,并发挥重要的免疫逃逸功能[1]。一方面,HLAG能够与免疫细胞上表达的受体结合,直接抑制如自然杀伤细胞、T淋巴细胞的杀伤活性;另一方面,HLA-G能够诱导产生具有免疫抑制活性的调节性T细胞(regulatory T cell,Treg)等,间接发挥免疫抑制功能[2]。近来有研究表明,羊膜内感染或组织绒毛膜羊膜炎的早产或正常分娩孕妇羊水中可溶性HLA-G(soluble HLA-G,sHLA-G)分泌水平要高于正常孕妇羊水sHLA-G的表达,推测sHLA-G可能在宿主抗羊膜炎症反应的过程中发挥重要的作用[3]。此外,在肌炎患者炎症部位的骨骼肌中或急性神经炎症患者脑脊髓液中均发现HLA-G+T淋巴细胞的存在,且比例较高,表明HLA-G在机体内调节炎症反应过程中发挥了重要的功能[4]。本研究通过检测54例乙型肝炎病毒(hepatitis B virus,HBV)感染患者及63例正常献血员外周血HBV的载量及sHLA-G的含量;将不同载量的HBV体外刺激单核细胞,采用RT-PCR、Western blot和流式细胞术检测HLA-G抗原的诱导表达情况,旨在探讨HBV诱导单核细胞HLA-G的表达及其临床意义。
1 材料和方法
1.1 一般资料 收集2011年3月-9月在本院住院治疗的HBV感染患者54例,其中男30例,女24例,年龄20~72岁,平均(46.5±21.6)岁。所有患者血清谷丙转氨酶(ALT)/谷草转氨酶(AST)持续或间歇升高,黄疸及凝血酶原时间均提示患者处于免疫清除期。住院前未口服过抗病毒药物或免疫调节药物,住院后马上抽血保存于-20 ℃冰箱内。经乙肝三系检测为HBV感染患者,且乙肝三系定量检测乙肝表面抗原普遍大于250 IU/mL、乙肝e抗原为0.3~1 431 S/CO。台州市血站提供2012年3月-6月的乙肝三系、肝功能与转氨酶均正常的献血员63例作为对照,其中男33例,女30例,年龄23~45岁,平均(34.2±9.1)岁。
1.2 方法
1.2.1 HBV载量测定:采用实时RT-PCR的方法测定54例HBV感染患者和63例正常献血员外周血HBV的载量。HBV核酸扩增荧光定量检测试剂盒购自申友生物,血清病毒载量低于1 000拷贝/mL将不能被检测,实验操作及分析严格按照说明书执行。
1.2.2 血浆sHLA-G检测:采用ELISA法检测HBV感染患者血浆sHLA-G的含量。sHLA-G试剂盒购自biovendor公司(RD194070100R)。
1.2.3 细胞培养及病毒感染:单核细胞株THP-1细胞和含HBV的人肝细胞DCX细胞购自中科院上海研究所。大量培养DCX细胞,收集约1×108个细胞,置于冻存管中,反复冻融细胞,采用病毒核酸抽提试剂盒无菌抽提HBV,经实时PCR检测HBV载量,调整载量为1×108拷贝/mL、1×107拷贝/mL、1×106拷贝/mL、1×105拷贝/mL、1×104拷贝/mL及PBS分别与THP-1细胞共培养,培养时间分别为1、2、3、4、5、6 d。收集处理后的细胞,分别经RT-PCR、Western Blot和流式细胞术检测HLA-G诱导表达情况。
1.2.4 采用RT-PCR技术检测经HBV诱导后的单核细胞HLA-G异构体转录情况:收集上述处理后细胞,抽提总RNA,按Fermentas公司反转录酶试剂盒说明书操作,合成cDNA第一链。以cDNA为模板,分别应用HLA-G1~G6和pan HLA-G引物进行PCR扩增(引物序列见表1),条件为94 ℃预变性3 min;94 ℃ 30 s、58 ℃ 30 s及68 ℃ 1 min,共40个循环,最后于72 ℃延伸10 min。取PCR产物进行琼脂糖凝胶电泳,观察结果。
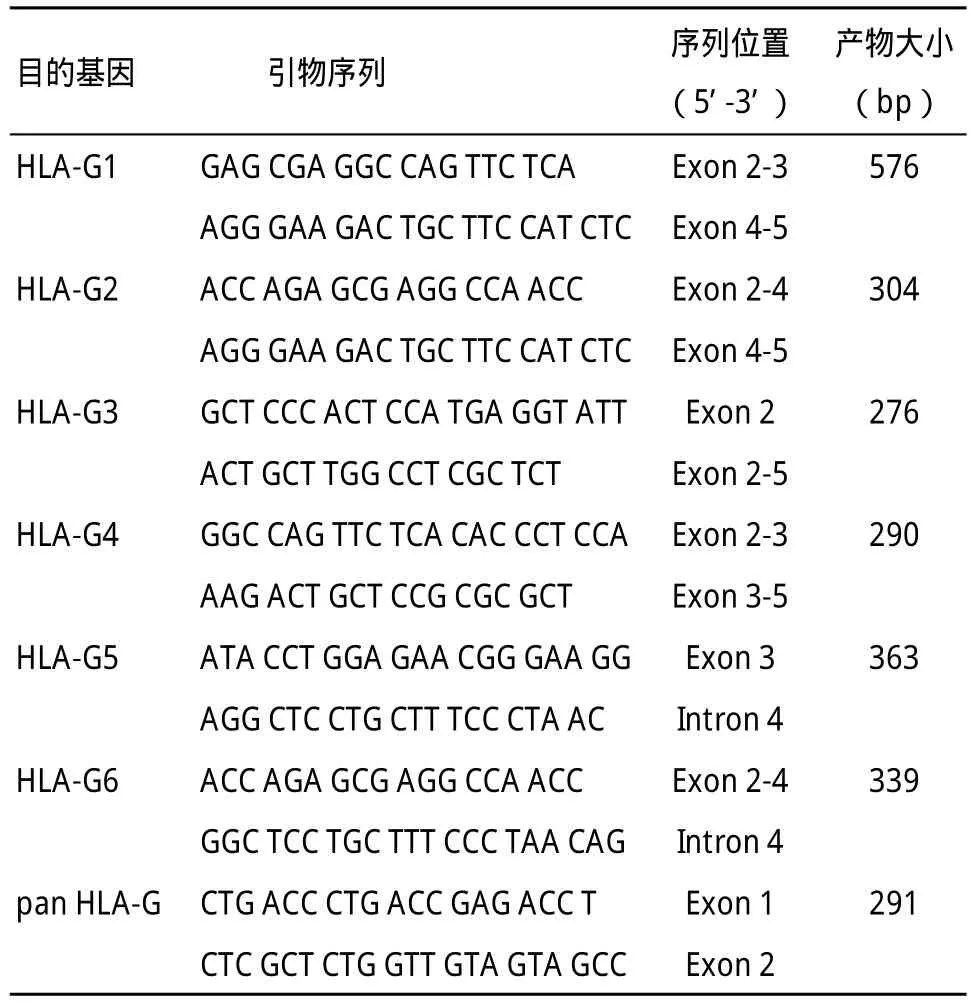
表1 RT-PCR扩增HLA-G异构体mRNA的引物序列
1.2.5 采用Western blot法检测经HBV诱导单核细胞胞内HLA-G表达情况:取上述细胞制备细胞裂解液,分别取10μL作SDS-PAGE,电转膜后,用1% BSA室温封闭过夜。加入HLA-G特异性抗体4H84(1:1 000),4 ℃过夜。0.1% PBST洗涤3次,加入HRP标记的羊抗鼠IgG抗体,室温孵育30 min,0.1%PBST洗涤3次,加入底物显色。
1.3 统计学处理方法 采用SPSS16.0软件进行统计学分析。HBV感染患者sHLA-G浓度用±s表示,组间比较采用t检验,若两组数据方差不齐,则采用Satterthwaite近似t检验。P<0.05为差异有统计学意义。
2 结果
2.1 HBV载量 HBV感染患者HBV载量均大于1×104拷贝/mL,而正常献血员则小于100拷贝/mL。
2.2 外周血sHLA-G表达水平 HBV感染患者血浆sHLA-G表达水平为(118.127±60.325)U/mL,而正常献血员为(8.484±5.129)U/mL,HBV感染患者血浆sHLA-G表达水平显著高于正常献血员,两者差异有统计学意义(P<0.01,95%CI:88.5~130.74)。2.3 HBV诱导HLA-G基因转录增强及诱导HLA-G蛋白表达 将1×108拷贝/mL、1×107拷贝/mL、1×106拷贝/mL、1×105拷贝/mL、1×104拷贝/mL的HBV及PBS分别与THP-1细胞共培养24 h,结果表明,HBV载量为1×107拷贝/mL和1×108拷贝/mL诱导HLA-G1异构体转录增强。采用1×108拷贝/mL HBV载量与THP-1细胞分别培养1、2、3、4、5、6 d,结果表明,在HLA-G1转录及蛋白表达在第4天达到最高(见图1-2)。此外,研究发现HBV诱导前后THP-1细胞均未转录HLA-G5 mRNA异构体。

图1 RT-PCR技术检测HBV诱导THP-1细胞HLA-G1~G6和pan HLA-G表达情况

图2 Western blot技术检测HBV诱导THP-1细胞HLA-G蛋白表达情况
3 讨论
HLA-G是机体内一个重要的免疫耐受分子,炎症、病毒感染后均可诱导HLA-G分子的表达,促进炎症和病毒的免疫逃逸[5-6]。在此次研究中发现,HBV感染患者血浆sHLA-G抗原表达水平显著高于正常献血员(P<0.01),表明sHLA-G可能是HBV感染的潜在有效标志物之一。
到目前为止,HBV感染患者未能完全清除体内病毒,与HBV通过多种机制破坏机体免疫平衡系统相关。而诱导HLA-G表达从而抑制树突状细胞、自然杀伤细胞、病毒特异性CD4+和CD8+T淋巴细胞等是HBV逃避机体免疫攻击的有效机制之一。研究发现,干扰素-α、干扰素-β、干扰素-γ、白细胞介素-2、白细胞介素-10、粒细胞-巨噬细胞集落刺激因子、白细胞抑制因子、激素(黄体酮、糖皮质激素等)等均能诱导HLA-G的表达和增加sHLA-G的分泌[7-9]。HBV感染患者血浆sHLA-G分泌水平较正常人显著升高,其诱导sHLA-G分泌机制还需进一步研究。因此,我们将HBV与THP-1细胞共同培养,结果表明,HBV载量为1×107拷贝/mL和1×108拷贝/mL诱导HLAG1异构体转录增强。采用1×108拷贝/mL HBV载量与THP-1细胞分别培养1、2、3、4、5、6 d,结果表明,在HLA-G1转录及蛋白表达在第4天达到最高。本研究初步发现,HBV通过体外感染THP-1细胞诱导sHLA-G分泌,而非通过细胞因子或激素等诱导。此外,HBV诱导HLA-G表达机制还需进一步研究。
Rebmann等[10]研究表明,血浆sHLA-G可能是HLA-G5或者是脱落的HLA-G1。本研究的sHLA-G ELISA试剂盒是用MEM-G/9包被而成,既能识别脱落的HLA-G1,也能识别HLA-G5,两种含有β2-微球蛋白。在此次研究中,HBV诱导前后THP-1细胞均未转录HLA-G5 mRNA异构体,提示HBV感染患者分泌的sHLAG可能是脱落的HLA-G1抗原。通过本次研究表明,HBV感染患者sHLA-G分泌水平显著高于正常献血员,而其机制可能是HBV增强单核细胞HLA-G基因转录,诱导单核细胞表达HLA-G蛋白,从而使HLA-G参与调节HBV免疫逃逸。
[1]徐丹萍, 颜卫华. HLA-G与HIV病毒的研究进展[J]. 现代免疫学, 2011, 31(6): 517-520.
[2]许惠惠, 颜卫华, 林爱芬. HLA-G依赖的调节性细胞研究进展[J]. 现代免疫学, 2010, 30(5): 32-35.
[3]Kusanovic JP, Romero R, Jodicke C, et al. Amniotic fluid soluble human leukocyte antigen-G in term and preterm parturition, and intra-amniotic infection/infl ammation[J]. J Matern Fetal Neonatal Med, 2009, 22(12): 151-166.
[4]Feger U, Tolosa E, Huang YH, et al. HLA-G expression defines a novel regulatory T-cell subset present in human peripheral blood and sites of infl ammation[J]. Blood, 2007,110(2): 568-577.
[5]Yan WH. HLA-G expression in cancers: potential role in diagnosis, prognosis and therapy[J]. Endocr Metab Immune Disord Drug Targets, 2011, 11(1): 76-89.
[6]Carosella ED, Moreau P, Lemaoult J, et al. HLA-G: from biology to clinical benefi ts[J]. Trends Immunol, 2008, 29(3):125-132.
[7]Selmani Z, Naji A, Zidi I, et al. Human leukocyte antigen-G5 secretion by human mesenchymal stem cells is required to suppress T lymphocyte and natural killer function and to induce CD4+CD25highFOXP3+ regulatory T cells[J]. Stem Cells, 2008, 26(1): 212-222.
[8]Yie SM, Xiao R, Librach CL. Progesterone regulates HLA-G gene expression through a novel progesterone response element[J]. Hum Reprod, 2006, 21(10): 2538-2544.
[9]Akhter A, Faridi RM, Das V, et al. In vitro up-regulation of HLA-G using dexamethasone and hydrocortisone in firsttrimester trophoblast cells of women experiencing recurrent miscarriage[J]. Tissue Antigens, 2012, 80(2): 126-135.
[10]Rebmann V, Busemann A, Lindemann M, et al. Detection of HLA-G5 secreting cells[J]. Hum Immunol, 2003, 64(11):1017-1024.
