秀丽线虫mfn-1 RNAi通过依赖于ATFS-1途径激活线粒体未折叠蛋白反应
2014-06-13姚秀萍陈思希任亚光周怀彬吕建新
姚秀萍,陈思希,任亚光,周怀彬,吕建新
(温州医科大学 浙江省医学遗传学重点实验室,浙江 温州 325035)
细胞在内部或外界环境的不利刺激下引起蛋白稳态失衡时会激活一系列的保护性反应,具体到细胞内的不同部位有内质网未折叠蛋白反应、细胞质未折叠蛋白反应、线粒体未折叠蛋白反应(mtochondrial unfolded protein response,UPRmt)[1-6]。当线粒体蛋白稳态受到影响时,细胞核基因编码的定位于线粒体的分子伴侣HSP-6、HSP-60等的表达会上调,以使发生错误折叠的蛋白质形成正确构象并促进新生蛋白质的正确折叠,这一过程叫作UPRmt[7-9]。转录因子ATFS-1介导UPRmt信号通路,ATFS-1含有线粒体及细胞核定位序列,在正常条件下,ATFS-1进入线粒体并被蛋白酶CLPP-1、LON-1等降解;在线粒体受到应激时,如线粒体亚基被RNAi敲低等,ATFS-1进入线粒体减少而进入细胞核增多,从而激活下游基因如分子伴侣HSP-6、HSP-60等表达,即激活UPRmt[10-11]。线粒体膜蛋白HAF-1被认为介导线粒体与细胞核之间的信号传递并参与UPRmt,然而最近发现clk-1的敲低通过HAF-1激活UPRmt,而nuo-6、cco-1等基因RNAi对UPRmt的激活则不依赖HAF-1[10,12-14]。
线粒体功能紊乱与人类许多疾病的发生有关,然而在线虫及果蝇等低等生物中却延缓衰老[15-17]。我们此前发现,敲低线虫线粒体转铁蛋白MFN-1后显著延长寿命[18]。现就mfn-1RNAi是否激活UPRmt及其激活的信号通路进行研究,今后将进一步验证UPRmt的激活是否介导了mfn-1RNAi寿命延长。
1 材料和方法
1.1 材料 线虫N2、SJ4058、SJ4100、TJ375、SJ4005、RB867、VC3201,大肠杆菌HT115(DE3)由Caenorhabditis genetics center(CGC)提供;质粒L4440由本实验室保存;LA Taq酶、DNA marker购自宝生物有限公司;异丙基硫代吡喃半乳糖苷(IPTG)、氨苄青霉素、盐酸四环素钠、琼脂、蛋白胨、酵母提取液、硫酸镁、氯化钙、磷酸氢二钾、磷酸二氢钾等试剂购自Sigma;其他材料为本实验室保存。
1.2 SJ4058雄虫的制备 将L4期SJ4058线虫挑至铺有HT115菌膜的板上,每板6条,共5个板,置于31 ℃热激6 h,然后置于20 ℃培养。3~4 d后寻找F1代雄性线虫(尾巴有突起状),将其挑至新的HT115菌膜上,然后再挑入3条雌雄同体线虫杂交,F2代可获得大量SJ4058雄虫。
1.3 SJ4058线虫与VC3201线虫的杂交 将SJ4058线虫雄虫20条与VC3201线虫雌雄同体2条挑至同一个铺有HT115菌膜的NGM板上(3.5 cm直径小平皿)让其交配产生F1代,将F1代雌雄同体线虫2条转到新的含菌膜NGM板上让其产生F2代,挑取50条F2代分别于50个NGM平板上,每板1条并编号,待其产卵后,PCR鉴定F2代基因型,筛选出含atfs-1纯合子及hsp-60::gfp线虫(杂合或者纯合),保留阳性的F2代平板,将每个阳性板上的F3线虫取20条通过PCR鉴定hsp-60::gfp,若某个板上20条F3全能扩增出目的基因,则该板很可能为纯合子hsp-60::gfp,最后将筛选到的阳性线虫品系传一两代后进一步PCR验证以确认。所有PCR鉴定过程均以野生型N2线虫为阴性对照,不加模板的为空白对照。鉴定hsp-60::gfp所用引物为:hsp-60::gfp上游(5’-CATTTTACCGCCTGA AATTC-3’),hsp-60::gfp下游(5’-CTTCCATCTTCAATGT TGTG-3’),鉴定atfs-1所用引物为:atfs-1上游(5’-TTTCAGTCGTTTCAGGACCC-3’),atfs-1下游(5’-TCATCGA GTTGATCTCACGC-3’)。PCR反应条件为:dNTP Mixture(各2.5 mmol/L)1.6 L,10×PCR buffer 1 L,上游引物0.2 L,下游引物0.2 L,LA Taq酶(5 U/ L)0.1 L,ddH2O 6.9 L,模板DNA 5 L,总体积为15 L。反应条件:①94 ℃ 4 min;②94 ℃ 30 s,58 ℃ 30 s,72 ℃ 5 min,共39个循环;③72 ℃20 min;④保持在4 ℃。取5 L PCR产物进行1%琼脂糖凝胶电泳检查扩增结果。
1.4 SJ4058线虫与RB867线虫杂交 方法类似,鉴定hsp-60::gfp用引物同上。鉴定haf-1引物为:haf-1上游(5’-CACCCCTGTCACAGACCTTT-3’),haf-1下游(5’-CGCCAGAGAACAACAGATGA-3’)。PCR反应条件为:dNTP Mixture(各2.5 mmol/L)1.6 L,10×PCR buffer 1 L,上游引物0.2 L,下游引物0.2 L,LA Taq酶(5 U/ L)0.1 L,ddH2O 6.9 L,模板DNA 5 L,总体积为15 L。反应条件:①94 ℃ 4 min;②94 ℃ 30 s,58 ℃ 30 s,72 ℃ 5 min,共39个循环;③72 ℃ 20 min;④保持在4 ℃。取5 L PCR产物进行1%琼脂糖凝胶电泳检查扩增结果。
1.5 秀丽线虫mfn-1的RNA干扰 分别挑取含mfn-1干扰质粒及空载l4440质粒的HT115菌在3 mL液体LB培养基(含氨苄青霉素终浓度100 g/mL,四环素12.5 g/mL)中培养约10 h,再加入3 L 1 mol/L IPTG培养1 h,然后各取70 L菌液均匀涂于NGM平板(含氨苄青霉素终浓度100 g/mL,四环素12.5 g/mL,IPTG 238.3 g/mL),放于25 ℃诱导12~16 h。然后将L4期线虫转至菌膜上,3~4 d后,取F1代进行各种指标观测。
1.6 倒置荧光显微镜观测 配3%的琼脂糖,加热融化后滴1滴于载玻片,立即加上盖玻片,使琼脂糖形成硬币大小的膜,然后移走盖玻片。在琼脂糖膜上滴1滴0.5%的左旋霉素麻醉剂,将同步化的mfn-1RNAi及空载l4440 RNAi处理F1代成虫分别放到麻醉剂里,1 min后即可观测荧光。在同样的曝光条件及放大倍数下观测荧光并拍照。
2 结果
2.1 将SJ4058线虫分别与VC3201及RB867线虫杂交后获得基因型分别为hsp-60::gfp/atfs-1(gk3094)V及hsp-60::gfp/haf-1(ok705)IV的线虫 首先通过热激获得了SJ4058雄性线虫,将雄性SJ4058线虫分别与雌雄同体VC3201及RB867线虫杂交,通过前述方法杂交并PCR鉴定筛选到基因型为hsp-60::gfp/atfs-1(gk3094)V和hsp-60::gfp/haf-1(ok705)IV的线虫,将该两品系线虫传几代后进一步PCR确认其基因型,成功获得杂交的线虫,如图1-2所示。

图1 PCR鉴定基因型为hsp-60::gfp/atfs-1(gk3094)V的杂交线虫
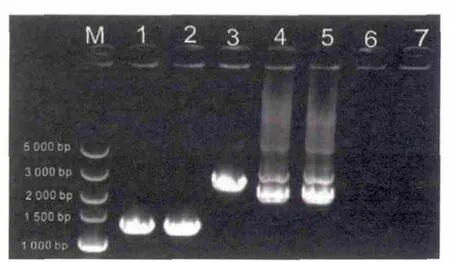
图2 PCR鉴定基因型为hsp-60::gfp/haf-1(ok705)IV的线虫
2.2Mfn-1RNAi特异性激活UPRmt分别将线虫SJ4058、SJ4100、TJ375、SJ4005的L4期幼虫放在含mfn-1RNAi质粒及l4440空载的HT115菌膜上进行干扰,方法如前所述。然后将F2代线虫在荧光倒置显微镜下观测绿色荧光,根据观测结果发现,mfn-1RNAi激活了线粒体的分子伴侣HSP-6及HSP-60的表达,而并没激活细胞质分子伴侣HSP-16.2及内质网分子伴侣HSP-4的表达,如图3所示。这表明mfn-1RNAi可能影响了线粒体蛋白质稳态,激活了线粒体的反馈性反应,而细胞质及内质网等蛋白质稳态未受到明显影响。
2.3Mfn-1RNAi对UPRmt的激活不依赖于线粒体膜蛋白HAF-1,而依赖于转录因子ATFS-1 为了验证mfn-1RNAi通过什么通路激活UPRmt,我们构建了基因型分别为hsp-60::gfp/atfs-1(gk3094)V及hsp-60::gfp/haf-1(ok705)IV线虫,对该两种线虫进行mfn-1RNAi处理后观测荧光,并以L4440空载为对照,发现在atfs-1基因功能缺失线虫中,HSP-60表达不能被激活,而haf-1基因功能缺失的线虫中,HSP-60的表达仍然可以激活,如图4所示。这说明mfn-1RNAi 对UPRmt的激活依赖于ATFS-1,而不依赖于HAF-1。

图3 Mfn-1 RNAi特异性激活线粒体分子伴侣,而未激活细胞质及内质网分子伴侣的表达(×100,200 ms)

图4 Mfn-1 RNAi对HSP-60表达的激活依赖于ATFS-1,而不依赖于HAF-1(×100,200 ms)
3 讨论
线粒体是ATP合成、三羧酸循环、铁硫簇及血红素合成的主要场所[19-21]。线粒体功能紊乱与许多疾病的发生密切相关,如线粒体储铁蛋白frataxin突变引起弗里德赖希共济失调,铁硫簇组装支架蛋白iscu突变引起肌病(myopathy)等[22]。在线虫中却发现许多呼吸链亚基突变可以延长寿命,某些保护性机制的激活被认为促进了长寿,主要有自噬、UPRmt、蛋白质翻译速率降低等[17,23]。深入研究这些机制将有助于发现线粒体疾病的新治疗方法。
MFN-1是线粒体转铁蛋白,我们在此前的研究中发现mfn-1RNAi后引起线虫体型变小,繁殖力下降,然而寿命却显著延长[18]。本研究中,我们发现mfn-1RNAi激活了UPRmt,而对细胞质及内质网特异性的未折叠蛋白反应则没有激活。这提示mfn-1RNAi影响了线粒体功能或蛋白质稳态,而对内质网及细胞质蛋白稳态影响不大。我们将hsp-60::gfp转基因线虫SJ4058与atfs-1基因功能缺失线虫VC3201杂交,发现当atfs-1缺失时,UPRmt不能再被激活。这说明mfn-1RNAi对UPRmt的激活依赖于ATFS-1。采用同样的方法,发现mfn-1RNAi对UPRmt的激活不依赖于线粒体膜蛋白HAF-1。这也与文献报道一致,如ISP-1、NUO-6等大部分定位于线粒体的蛋白表达降低对UPRmt的激活也不依赖于HAF-1[10,13,24]。本研究有助于继续探索UPRmt的激活是否与mfn-1RNAi延长寿命有关。
[1]Chakrabarti A, Chen AW, Varner JD. A review of the mammalian unfolded protein response[J]. Biotechnol Bioeng,2011, 108(12): 2777-2793.
[2]Oslowski CM, Urano F. The binary switch that controls the life and death decisions of ER stressed beta cells[J]. Curr Opin Cell Biol, 2011, 23(2): 207-215.
[3]Hu F, Liu F. Mitochondrial stress: a bridge between mitochondrial dysfunction and metabolic diseases?[J]Cell Signal, 2011, 23(10): 1528-1533.
[4]Whelan SP, Zuckerbraun BS. Mitochondrial signaling: forwards, backwards, and in between[J]. Oxid Med Cell Longev, 2013, 2013: 351613.
[5]Gidalevitz T, Prahlad V, Morimoto RI. The stress of protein misfolding: from single cells to multicellular organisms[J].Cold Spring Harb Perspect Biol, 2011, 3(6): a009704.
[6]Calderwood SK, Murshid A, Prince T. The shock of aging:molecular chaperones and the heat shock response in longevity and aging-a mini-review[J]. Gerontology, 2009, 55(5): 550-558.
[7]Pellegrino MW, Nargund AM, Haynes CM. Signaling the mitochondrial unfolded protein response[J]. Biochim Biophys Acta, 2013,1833(2): 410-416.
[8]Haynes1 CM, Ron D. The mitochondrial UPR-protecting organelle protein homeostasis[J]. J Cell Sci, 2010, 123(pt 22):3849-3855.
[9]Jovaisaite V, Mouchiroud L,Auwerx J. The mitochondrial unfolded protein response, a conserved stress response pathway with implications in health and disease[J]. J Exp Biol, 2014, 217(pt 11): 137-143
[10]Nargund AM, Pellegrino MW, Fiorese CJ, et al. Mitochondrial import efficiency of ATFS-1 regulates mitochondrial UPR activation[J]. Science, 2012, 337(6094): 587-590.
[11]Tatsuta T, Langer T. Quality control of mitochondria: protection against neurodegeneration and ageing[J]. Embo J,2008, 27(2): 306-314.
[12]Haynes CM, Yang Y, Blais SP, et al. The matrix peptide exporter HAF-1 signals a mitochondrial UPR by activating the transcription factor ZC376.7 in C. elegans[J]. Mol Cell,2010, 37(4): 529-540.
[13]Pujol C, Bratic-Hench I, Sumakovic M, et al. Succinate dehydrogenase upregulation destabilize complex I and limits the lifespan of gas-1 mutant[J]. PLoS One, 2013, 8(3):e59493.
[14]Lee SJ, Hwang AB, Kenyon C. Inhibition of respiration extends C. elegans life span via reactive oxygen species that increase HIF-1 activity[J]. Curr Biol, 2010, 20(23): 2131-2136.
[15]Wallace DC. A mitochondrial paradigm of metabolic and degenerative diseases, aging, and cancer: a dawn for evolutionary medicine[J]. Annu Rev Genet, 2005, 39: 359-407
[16]Copeland JM, Cho J, Lo T Jr, et al. Extension of Drosophila life span by RNAi of the mitochondrial respiratory chain[J]. Curr Biol, 2009, 19(19): 1591-1598.
[17]Lee SS, Lee RY, Fraser AG, et al. A systematic RNAi screen identifies a critical role for mitochondria in C. elegans longevity[J]. Nat Genet, 2003, 33(1): 40-48.
[18]Ren Y, Yang S, Tan G, et al. Reduction of mitoferrin results in abnormal development and extended lifespan in Caenorhabditis elegans[J]. PLoS One, 2012, 7(1): e29666.
[19]Phielix E, Szendroedi J, Roden M. Mitochondrial function and insulin resistance during aging: a mini-review[J]. Gerontology, 2011, 57(5): 387-396.
[20]Schultz IJ, Chen C, Paw BH, et al. Iron and porphyrin traffi cking in heme biogenesis[J]. J Biol Chem, 2010, 285(35):26753-26759.
[21]Rawat S, Stemmler TL. Key players and their role during mitochondrial iron-sulfur cluster biosynthesis[J]. Chemistry,2011, 17(3): 746-753.
[22]Lu C, Cortopassi G. Frataxin knockdown causes loss of cytoplasmic iron-sulfur cluster functions, redox alterations and induction of heme transcripts[J]. Arch Biochem Biophys,2007, 457(1): 111-122.
[23]Durieux J, Wolff S, Dillin A. The cell-non-autonomous nature of electron transport chain-mediated longevity[J]. Cell,2011, 144(1): 79-91.
[24]Runkel ED, Liu S, Baumeister R, et al. Surveillance-activated defenses block the ROS-induced mitochondrial unfolded protein response[J]. PLoS Genet, 2013, 9(3): e1003346.
