微量白蛋白尿对于IgA肾病患者的临床、病理研究*
2014-06-12郭宗运吴玉梅
郭宗运 吴玉梅
(1.山东省医学科学院附属济宁市第一人民医院肾内科,山东 济宁 272000;2.济南大学山东省医学科学院生命与医学科学学院,山东 济南 250200)
IgA 肾病(IgA nephrology,IgAN)是我国最常见的一种慢性肾小球肾炎,是我国终末期肾脏病的主要原发疾病[1]。众所周知,大量蛋白尿是IgAN进展及预后的独立危险因素,是IgA肾病预后不良的重要因素[2]。近期研究发现表现为轻度蛋白尿的部分IgAN患者病理较重[3],可进展至肾功能减退甚至终末期肾病(ESRD)[4,5],而有关微量白蛋白尿IgAN患者临床病理特点及预后影响因素的报道甚少,对微量白蛋白尿与IgA肾病的病理病变程度的相关性缺少相关研究。鉴于此,我研究组对于一部分表现为微量白蛋白尿的患者进行了常规肾活检,并进行临床特点及病理分析,以期针对性地采取合理临床干预,延缓IgA肾病的进展,减少终末期肾病发生。
1 对象和方法
1.1 对 象
选取取2009年1月~2013年10月在我院临床表现为微量白蛋白尿且行肾活检确诊为IgAN的患者90例。IgAN的诊断依据以免疫荧光系膜区IgA沉积为主,并排除过敏性紫癜、系统性红斑狼疮、乙肝相关性肾炎、强直性脊柱炎等肾损害。依据肾功能情况分为肾功能正常组及肾功能异常组。本研究中微量白蛋白尿定义为尿白蛋白排泄率在20~200 μg/min或白蛋白量30~300 mg/24 h。肾功能异常定义为:血肌酐>115 μmol/L或内生肌酐清除率<60 ml/min。
1.2 研究方法
统计的临床指标包括性别、发病年龄、病程(截止至肾穿刺活检时)、血尿、血压、肾功能(包括血肌酐、血尿酸、内生肌酐清除率)、血胆固醇、血清IgA。
1.3 病理学方法
肾活检取材的肾小球数目平均为(26.4±11.3)个,肾组织标本分为3份,分别进行光学显微镜检查(包括HE、Masson、PAM 染色)、免疫荧光检查(包括IgA、IgG、IgM、C3、C1q、FRA的沉积部位及强度)和电子显微镜检查。临床资料分型和病理分级分别采用单盲法完成。
按S-M Kurt Lee提倡的分级标准将肾脏的病理改变分为5级[6]。肾小球、肾小管间质及血管病变的各项病理参数的半定量积分采用Katafuchi标准[7];总积分为0~27分,肾小球病变积分为0~12分, 包括系膜细胞和系膜基质增生程度(0~4分);节段性肾小球病变如新月体形成、与球囊壁粘连、节段性硬化和节段性毛细血管壁纤维素样坏死(0~4分);肾小球球性硬化(0~4分)。积分评定标准为:①无,0分;②<25%,1分;③25%~50%,2分;④51%~75%,3分;⑤>75%,4分。肾小管间质积分0~9分,包括间质炎细胞浸润(0~3分)、间质纤维化(0~3分)和肾小管萎缩(0~3分)。血管积分0~6分,包括血管壁增厚(0~3分)和玻璃样变性(0~3分),积分评定标准为:①无,0分;②<25%,1分;③ 25%~50%,2分;④>50%,3分。
1.4 统计学方法

2 结 果
2.1 一般资料
本组90例临床表现为微量白蛋白尿IgAN患者,男女比为1.10∶1,平均发病年龄(33.0±5.2)岁。在90例患者中,64例的患者同时存在蛋白尿和血尿(71.11%),28例患者为单纯蛋白尿(31.11%);27例患者存在发作性肉眼血尿(30.00%);15例患者存在高血压(16.67%);14例患者存在肾功能异常(15.56%)。

表1 2组患者的临床资料
注:与肾功能正常组比较,*P<0.05;**P<0.01。
表1示,肾功能正常组和肾功能异常组相比较,发病年龄、性别、做肾穿刺活检时的病程均无统计学差异。发作性肉眼血尿在肾功能异常组少于肾功能正常组,差异有统计学意义(P<0.05)。高血压方面,肾功能异常组的高血压患病率42.9%显著高于肾功能正常组10.0%(P<0.01)。
2.2 实验室检查
由表2可示,样本中2组患者的血清胆固醇、血清IgA升高值无显著性差异, 肾功能异常组血尿酸水平均显著高于肾功能正常组(P<0.01)。与肾功能正常组相比较,肾功能异常组血肌酐显著升高,内生肌酐清除率显著下降(均P<0.01)。

表2 2组患者的生化指标
注:与肾功能正常组比较,*P<0.05;**P<0.01。
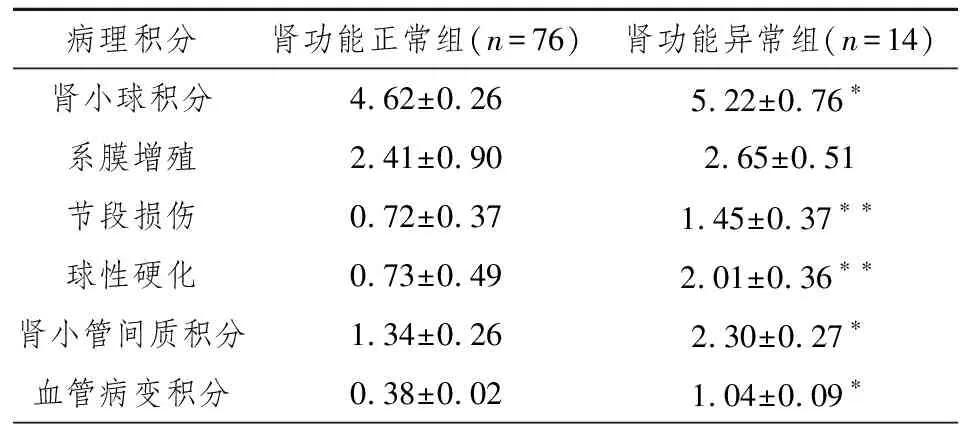
表3 2组患者的病理资料
注:与肾功能正常组比较,*P<0.05;**P<0.01。
在该样本中,肾功能正常组的病理类型以局灶增生和轻度系膜增生为主,共61例(80.3%);局灶增生伴部分新月体形成5例(8.5%),其中2例为细胞新月体及纤维新月体共存,1例为细胞新月体,2例为纤维新月体; 局灶增生伴缺血性肾损伤3例(3.9%);局灶增生坏死型4例(5.3%);毛细血管内增生型1例(1.3%);局灶增生硬化型2例(2.6%)。按照Lee 分级,LeeⅠ级34例(44.7%),Ⅱ级28 例(36.8%),Ⅲ级11例(14.5%),Ⅳ级3例(4.0%)。肾功能正常组55例(72.4%)存在不同程度的系膜增殖,35例(46.1%)存在不同程度的肾小球球性硬化,7例(9.2%)可见新旧程度不等的新月体形成,9例(11.8%)存在灶状肾间质纤维化,8例(10.5%)存在肾小管灶状萎缩,14例(18.4%)存在不同程度的血管病变。
肾功能异常组病理类型以系膜和局灶节段同时增生(4例,28.6%)及局灶增生伴缺血性肾损伤为主(4例,28.6%);局灶增生伴纤维新月体形成2例,局灶增生硬化3例;局灶增生硬化伴缺血性肾损伤1例。按照Lee 分级,无LeeⅠ级患者,LeeⅡ级6例,Ⅲ级5例,Ⅳ级2例,Ⅴ级1 例。肾功能异常组全部存在不同程度肾小球球性硬化,6例可见不同程度的新月体形成,所有患者存在灶状肾间质纤维化、肾小管萎缩及不同程度的血管病变。
由表3可示,2组患者比较,系膜增殖无显著性差异,肾功能异常组节段损伤、球性硬化程度显著重于肾功能正常组(P<0.01),且肾小管间质病变积分及血管病变积分均高于肾功能正常组(均P<0.05)。
另外,通过肾脏病理,由表4可示,样本中IgAN患者中轻度病理损伤组(LeeⅠ~Ⅱ级)和病理损伤偏重组(Lee Ⅲ以上)在发病年龄、性别、血尿、血压、血清IgA之间无明显差别,但后者微量白蛋白量明显高于前者,logistic回归分析结果证实微量白蛋白尿是肾脏病理损伤偏重的独立危险因素。

表4 90例患者临床表现与病理损伤相关性分析
注:*logistic回归分析微量白蛋白尿是肾脏病理损伤程度偏重的独立危险因素,OR=3.013,95% CI:1.34~5.51,P=0.003)
3 讨 论
IgAN在临床有多样表现,只蛋白尿的定量就可从微量蛋白尿到达到肾病综合征水平的大量蛋白尿。现已证实24h尿蛋白定量>1g是IgAN进展的独立危险因素[8]。但即使是轻度蛋白尿的IgAN患者肾脏损伤并非一定轻微,在长期随访中,可有一部分患者病情加重,甚至进展至肾功能减退[9]。本研究显示,多因素分析发现微量白蛋白尿是IgAN病理损伤的独立危险因素;90例临床表现为微量白蛋白尿的IgAN患者中,14例(15.6%)存在肾功能异常,在76例肾功能正常的患者中,14例(18.4%)存在LeeⅢ级以上的病理损害,提示相当一部分微量白蛋白尿的IgAN患者预后不容乐观。
本组资料肾功能正常组和肾功能异常组在性别、发病年龄及病程方面无显著性差异。肾功能异常组高血压的发病率(42.9%)显著高于肾功能正常组(10.0%),这与前者肾脏病理血管病变较重,以局灶增生伴缺血性肾损伤为主要表现相一致。本研究显示,肾功能正常组发作性肉眼血尿较多见,占35.5%,而肾功能异常组发作性肉眼血尿占28.57%,2组比较有统计学差异,这与原研究显示的病史中存在发作性肉眼血尿往往提示预后相对良好[10]相一致。血胆固醇和血IgA的升高在两组间无显著性差异。多数研究已证实血尿酸的升高是影响IgAN预后的独立危险因素[11,12],本研究中肾功能异常组血尿酸显著高于肾功能正常组,但受血尿酸在肾功能异常时排泄减少的影响,本结论需要进一步证实。
IgAN肾脏病理也呈现多样化[13]。本研究发现,肾功能正常组和肾功能异常组均可见到的病理类型为局灶增生伴部分新月体形成、局灶增生伴缺血性肾损伤及局灶增生硬化型。肾功能异常组的病理类型以系膜和局灶节段同时增生以及局灶增生伴缺血性肾损伤为主,占57.2%; 肾功能正常组病理类型以轻度系膜增生及局灶增生为主,占80.3%,其次为局灶增生伴新月体形成,占8.5%。提示在微量白蛋白尿IgAN患者中就有一部分患者肾脏病理存在活动性病变,临床需积极治疗。另外,肾功能正常组18.5%存在LeeⅢ级以上的病理损害;46.1%存在不同程度肾小球球性硬化,8.5%可见不同程度的新月体形成,11.8%存在灶状肾间质纤维化,10.5%存在肾小管灶状萎缩,18.4%存在不同程度的血管病变。提示微量白蛋白尿肾功能正常的IgAN患者,其肾脏病理损伤亦可能较重。该部分患者随着病程的延长病情是否会很快进展恶化,尚需临床随访结果的证实。
总之,微量白蛋白尿是IgAN病理损伤的独立危险因素,临床表现为微量白蛋白尿的IgAN患者的病理损伤亦可能较重,预后不容乐观,治疗过程中应积极干预。
[1] Floege J,Feehally J.Iea nephropathy:recent devdopments[J].J Am Soc Nephrol,2000,11(12):2395-2403.
[2] Goto M,Wakai K,Kawamura T,et al.A scoring system to predict renal outcome in IgA nephropathy:a nationwide 10 year prospective cohort study [J].Nephrol Dial Transplant,2009,24:3068-3074.
[3] Manno C,Torres DD,Rossini M,et al. Randomized controlled clinical trial of corticosteroids plus ACE-inhibitors with long-term follow-up in proteinuric IgA nephropathy [J].Nephrol Dial Transplant,2009,24(12) : 3694.
[4] 吕继成,张宏,刘刚,等.IgA肾病呈单纯血尿和(或)轻度蛋白尿临床病理分析[J].中华肾脏病杂志,2004,20:418-420.
[5] Shen PC,He LQ,Tang Y,et al.Clinicopathological characteristics and prognostic factors of asymptomatie IgA nephropathy[J].J Investig Med,2010,58(3):560-565.
[6] Lee SM,Rao VM,Franklin WA,et al.IgA nephropathy:morphologic predictors of progressive renal disease [J].Hum Pathol,1982,13:314-322.
[7] Katafuchi R,Kiyoshi Y,Oh Y,et al.Glomerular score as a prognosticator in IgA nephropathy:its usefulness and limitation[J].Clin Nephrol,1998,49:1-8.
[8] Donadio Jv,Grande JP.IgA nephropathy [J].N Engl J Med,2002,347:738-748.
[9] Szeto CC,Lai FM,To KF,et al.The natural history of immunoglobulin A nephropathy among patients with hcmaturia and minimal proteinuria [J].Am J Med,2001,110:434-437.
[10] Li Ls,Liu ZH.Epidemiologic data of renal diseases from a single unit in china:analysis based on 13519 renal biopsies [J].Kidney Int,2004,66(3):920-923.
[11] Feis DI.Uric acid:a novel mediator and marker of risk in chronic kidney disease [J].Curr Opin Nephrol Hypertens,2009,18:526-530.
[12] Sturm G,Kollerits B,Neyer U,et al.Uric acid as a risk factor for progression of non -diabetic chronic kidney disease The Mild to Moderate Kidney Disease(MMKD)Study [J].Exp Gerontol,2008,43:347-352.
[13] Coppo R,Cattran D,Roberts Ian SD,et al.The new oxford clinicopathological classification of IgA nephropathy [J].Prilozi,2010,31:241-248.
