难治性突发性聋患者外周血单个核细胞内HDAC2表达与其预后的相关性分析*
2014-06-12后婕戴艳红谢利生周琼琼佘万东
后婕 戴艳红 谢利生 周琼琼 佘万东
糖皮质激素(glucocorticoid,GC)用于治疗突发性聋(sudden sensorineural hearing loss,SSNHL),抑制各种因素导致的内耳炎症反应, 其疗效已经得到公认[1,2],但是全身给药的有效率介于35%~89%之间[3~5],极重度以上SSNHL的患者预后更差[4],目前鼓室局部灌注GC治疗难治性SSNHL的有效率也仅为20%~61.9%[6~9]。研究显示[10,11],最终听力恢复较好的患者,在GC治疗的早期听力即有改善,提示部分SSNHL患者对GC治疗可能存在不敏感或抵抗。炎性疾病的GC抵抗与多种因素有关[12], 李春林等[13]认为SSNHL患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中糖皮质激素受体β(glucocorticoid receptor-β,GRβ)表达水平的异常与其GC疗效密切相关,而本研究的前期研究未发现SSNHL患者的听力恢复与其PBMC中GRα、GRβmRNA水平变化有关[14]。GC在体内主要通过增加抗炎基因的转录以及减少炎症基因的转录来发挥抗炎效应[15]。组蛋白的乙酰化和去乙酰化受功能相互拮抗的两组酶即组蛋白乙酰转移酶(histone acetyl transferase,HAT)和组蛋白去乙酰化酶(histone deacetylases,HDACs)所调节。HAT使组蛋白乙酰化, 缠绕其上的染色质由关闭状态变为开放状态, 有利于RNA聚合酶及转录因子与其上的转录位点相结合, 进而增强炎症基因的转录与炎症蛋白的表达。而HDAC2可以逆转这一过程, 同时它还可以和多种转录因子如核因子κB(NFκB) 以及激活蛋白-1(AP-1) 相互作用, 导致炎症基因转录抑制, 进而使炎症基因编码的炎症因子表达减少。HDACs家族分为Ⅳ类,HDAC2属于I类[16],它广泛表达且主要位于细胞核内, 与基因的转录抑制有关。本研究以经过常规治疗无效后采用鼓室内灌注GC的SSNHL患者为研究对象,检测其PBMC中HDAC2的表达,探讨HDAC2水平与其疗效之间的关系。
1 资料与方法
1.1研究对象及纳入标准 研究对象为2013年1月至2013年9月于南京大学医学院附属鼓楼医院收治的难治性突发性聋患者,共20例20耳,其中男12例,女8例,年龄18~64岁,平均45.5 ± 14.9岁。纳入标准:①符合中华医学会耳鼻咽喉头颈外科学分会制定的突发性聋诊断标准[17],无感音神经性聋家族史;②已接受10天以上的常规治疗(包括全身使用GC、改善微循环、营养神经)无效(其中4例曾接受高压氧治疗),患耳0.5~4 kHz平均听阈(pure tone average, PTA) 依然>60 dB HL。排除中途退出研究或失访者。治疗结束后随访至发病三个月后,按照受损频率PTA改善是否 ≥ 15 dB分为GC有效组和GC无效组。发病至接受此次治疗的时间为10~42天,平均17.7±9.32天,治疗前PTA(0.25~8 kHz)平均为78.67±11.62 dB HL,GC有效组和GC无效组PTA分别为75.21±9.44和80.98±12.73 dB HL,两组间无统计学差异(t=1.092,P=0.289)。按照我国突发性聋多中心临床研究的分型的标准[18],20例患者中听力曲线呈平坦型9例,全聋型11例。取同期住院治疗的双耳听力正常、无其他内科疾病及慢性鼻炎过敏性鼻炎等慢性炎症疾病的单纯鼻中隔偏曲志愿者10例作为对照组。
1.2治疗方法 突聋患者于入院第二天早晨抽取空腹外周血分离PBMC以进行后续检验,进行纯音听阈检测后次日患耳鼓室置管[9],每天鼓室灌注甲强龙20 mg,并予银杏叶提取物注射液105 mg、单唾液酸四己糖神经节苷脂钠40 mg静脉滴注,每天一次,连续10天。治疗结束后再次提取PBMC,复查纯音听阈,出院后继续随访观察鼓膜生长及听力改善情况。对照组手术前采集空腹血分离PBMC。本研究获得南京大学医学院附属鼓楼医院医学临床研究伦理委员会批准,并征得患者知情同意,签定同意书。
1.3PBMC中HDAC2表达检测
1.3.1PBMC提取 采集清晨空腹血20 ml,等体积生理盐水稀释后,加入到淋巴细胞分离液(天津灏阳)中,密度梯度离心,收集PBMC,洗涤后,冻存于-80 ℃冰箱备用。
1.3.2PBMC中HDAC2蛋白活性检测
1.3.2.1提取核蛋白 使用碧云天公司的细胞核蛋白与胞浆蛋白提取试剂盒,按照说明书操作,提取核蛋白,所得核蛋白保存于-20 ℃冰箱备用。
1.3.2.2HDAC2蛋白活性检测 用碧云天公司的BCA蛋白浓度检测试剂盒,检测核蛋白浓度,按照Epiquik HDAC2 Assay Kit说明书要求将核蛋白稀释至0.4~1.0 μg/μl 之间,实验将核蛋白浓度稀释至0.8 μg/μl。随后经过孵育、洗板、加入显色抗体、反应液以及终止液等过程,最后用450 nm波长检测,读取每孔OD值,用OD值间接反映HDAC2蛋白活性。
1.3.3HDAC2 mRNA表达的检测
1.3.3.1细胞总RNA的提取 用Invitrogen公司的trizol裂解PBMC,离心,小心吸取上层无色水相,用异丙醇沉淀RNA,弃上清,75%乙醇洗涤沉淀,简单干燥RNA,最后将提取的RNA溶解于DEPC水中,-80 ℃冰箱保存。使用前用紫外分光光度计测定其浓度和纯度。
1.3.3.2RT-PCR检测HDAC2 mRNA的表达
①引物:RT-PCR HDAC2引物由南京金斯瑞生物科技有限公司合成,GAPDH引物购自TAKARA公司,各引物序列见表1:

表1 RT- PCR引物序列
②cDNA合成:按照TAKARA公司试剂盒PrimeScript RT Master Mix说明书操作,以5 μl总RNA为模板,进行逆转录,合成cDNA。
③Real Time PCR 按SYBR Premix Ex Taq(TaKaRa)说明书配置体系,进行扩增,以GAPDH作为内参,对HDAC2 mRNA表达情况进行相对定量,PCR循环参数设定为95 ℃预变性30秒,95 ℃变性5秒,60℃退火/延伸34秒,循环40次,扩增反应结束后, 立即进行融解曲线分析, 判定是否有非特异性扩增产物的存在。分别计算GR及GAPDH基因的Ct值, 两者之差即为△Ct值,2-△Ct即作为评价HDAC2 mRNA相对表达水平的指标。 采用7500 system SDS software 分析所得结果。
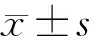
2 结果
2.1突聋组治疗效果 本组20例突聋患者治疗后PTA为63.09±22.59 dB HL,与治疗前相比差异有统计学意义(t=3.005,P=0.007),其中,GC有效8例,GC无效12例,GC有效组与无效组治疗后PTA分别为40.83±14.37和77.92±12.25 dB HL,GC有效组治疗后听力较治疗前明显提高(t=4.526,P=0.003)(表2)。
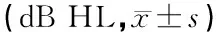
表2 GC有效组及GC无效组治疗前后 PTA比较
2.2三组HDAC2蛋白活性及HDAC2 mRNA表达量 此次治疗前,GC有效组以及GC无效组的HDAC2蛋白活性均显著低于对照组(F=13.291,P<0.05),而HDAC2 mRNA表达量显著高于对照组(F=6.047,P<0.05)(表3)。
治疗后,GC无效组HDAC2蛋白活性与治疗前无明显变化(t=0.937,P>0.05)(表3),而GC有效组HDAC2蛋白活性较治疗前明显提高(t=6.148,P<0.01)(表3),与对照组相比差异无统计学意义(t=0.287,P=0.778)。GC有效组与GC无效组HDAC2 mRNA表达均较治疗前提高(均P<0.01)。

表3 各组HCAC2蛋白活性和HDAC2 mRNA的表达比较
注:与GC无效组治疗前相比,*P<0.05;与GC有效组治疗前相比,△P<0.01
3 讨论
难治性突发性聋(refractory sudden sensorineural hearing loss)目前没有明确的定义,国外一般认为经过10~14天常规治疗无效的患者,即为难治性突发性聋[2,6,9]。本研究入选病例选择常规治疗十天以上无效(包括激素、改善血液循环药、营养神经剂)、0.5~ 4 kHz PTA 仍然>60 dB HL的患者。此类患者听力差,一般不易自愈[2],较易接受鼓室置管灌注激素这种有创的治疗方案。
在SSNHL的治疗中,GC因可抑制不同病因引起的内耳炎症反应、改善微循环、维持内外淋巴液的离子平衡,是目前公认的治疗SSNHL的一线药物[1,2 ],全身或鼓室局部给予GC后,GC与胞浆内GRα结合转运到核内,一方面与GRE结合,激活抗炎基因的转录;另一方面激活的GRα通过募集HDAC2至炎症基因的启动子区域,抑制NFκB相关的组蛋白乙酰化[15],抑制炎症基因的转录,从而发挥抗炎效应。HDAC2的水平会由于翻译后修饰,如硝化或氧化作用而发生下调,可导致部分炎性疾病如哮喘患者GC抵抗,HDAC2超表达可以恢复GC抵抗患者对GC的敏感性[19]。SSNHL的发病与氧化应激[20,21]、炎性反应[22]密切相关,氧化应激反应持续存在,能明显降低HDAC酶的活性,使组蛋白乙酰化/去乙酰化平衡被打破,组蛋白分子过乙酰化、炎症蛋白基因的转录和炎症蛋白的合成得到加强,阻断了GC的抗炎症反应效应[23,24]。目前在慢性阻塞性肺病(chronic obstructive pulmonary diseases,COPD)以及过敏性哮喘等的治疗领域对于HDAC2与GC抵抗研究较多,而在SSNHL的发病及治疗中的作用,研究尚不深入。本研究对GC有效组、GC无效组以及对照组PBMC中HDAC2的蛋白活性以及mRNA的表达进行检测,结果发现常规治疗(包括GC)无效的SSNHL患者,其体内HDAC2蛋白活性显著降低,与其他有关GC抵抗的炎症疾病的研究结果一致[25],提示SSNHL患者体内可能存在氧化应激反应[20,21]。鼓室灌注GC治疗促进了GC有效组患者的PBMC中HDAC2蛋白活性提高,间接反映内耳组织HDAC2蛋白活性的提高[26],恢复机体或内耳对GC的敏感性,有助于患者的听力恢复;全身应用银杏提取物,具有清除自由基作用[27],也可能提高HDAC2蛋白活性。但本次治疗后依然无效(即GC无效组)患者HDAC2蛋白活性依然低于对照组,说明GC可以上调HDAC2基因的表达,但在蛋白的修饰过程中,GC无效患者体内的HDAC2被氧化或硝化,蛋白含量或活性降低[19]。GC治疗后HDAC2 mRNA表达量进一步升高,推测原因是,本组均为入院前已接受10天或以上的常规治疗无效的患者,他们此前接受的GC全身治疗可能由于某些因素[24]不足以抑制患者体内的炎症状态,仅能上调HDAC2 mRNA的表达,并不能提高HDAC2蛋白活性,在接受鼓室灌注甲强龙及静脉给予银杏叶提取物后,GC有效组患者体内对HDAC2翻译后修饰的过程被抑制,使得HDAC2蛋白活性提高,听力改善。而经过本次治疗后依然无效的患者体内可能存在某种与COPD患者GC抵抗相似或相同的机制[25],HDAC2翻译后修饰并不能被GC抑制,有待于进一步探索。
综上,SSNHL患者体内存在氧化应激、炎性反应等可使HDAC2活性下降,给予GC鼓室内灌注治疗后,SSNHL患者PBMC内的HDAC2 mRNA表达和HDAC2蛋白活性上调,说明GC能有效抑制炎症反应和氧化应激,有助于听力恢复;而听力不能恢复者则可能与HDAC2蛋白活性下降有关。由于对SSNHL患者GC无效的影响因素很多,在将来的实验中,需要增加样本量,更深入研究,探讨影响HDAC2下降的机理,指导SSNHL的治疗。
4 参考文献
1 Rauch SD, Halpin CF, Antonelli PJ, et al. Oral vs intratympanic corticosteroid therapy for idiopathic sudden sensorineural hearing loss a randomized trial[J]. JAMA,2011, 305:2071.
2 Schreiber BE, Agrup C,Haskard DO, et al. Sudden sensorineural hearing loss[J]. Lancet, 2010, 375:1203.
3 Kara E, Cetik F, Tarkan O, et al. Modified intratympanic treatment for idiopathic sudden sensorineural hearing loss[J]. Eur Arch Otorhinolaryngo, 2010, 267:701.
4 赵晖,张天宇,傅窈窈,等.鼓室内注射地塞米松治疗极重度以上突发性聋的临床研究[J].中华耳鼻咽喉头颈外科杂志,2009, 44:297.
5 夏瑞明,李华亭,余力生.全聋型和重度平坦型突发性聋的治疗及预后[J].中华耳鼻咽喉头颈外科杂志,2007, 42:726.
6 Plontke SK, Löwenheim H, Mertens J, et al. Randomized, double blind, placebo controlled trial on the safety and efficacy of continuous intratympanic dexamethasone delivered via a round window catheter for severe to profound sudden idiopathic sensorineural hearing loss after failure of systemic therapy[J]. Laryngoscope, 2009, 119:359.
7 Li P, Zeng X, Ye J, et al. Intratympanic methylprednisolone improves hearing function in refractory sudden sensorineural hearing loss:a control study[J]. Audiol Neurootol,2010,16:198.
8 杨军,黄莉,施俊,等. 鼓室内注射地塞米松或甲泼尼龙治疗突发性聋的疗效观察[J]. 临床耳鼻咽喉头颈外科杂志, 2010, 24:594.
9 She W, Dai Y, Du X, et al. Hearing evaluation of intratympanic methylprednisoloneperfusion for refractory sudden sensorineural hearing loss[J].Otolaryngol Head Neck Surg, 2010, 142:266.
10 Ahn HJ, Yoo MH, Yoon TH, et al. Can intratympanic dexamethasone Aadded to systemic steroids improve hearing outcome in patients with sudden deafness[J]. Laryngoscope, 2008, 118:279.
11 Xenellis J, Papadimitriou N, Nikolopoulos T, et al. Intratympanic steroid treatment in idiopathic sudden sensorineural hearing loss: a control study[J]. Otolaryngol Head Neck Surg, 2006, 134:940.
12 Barnes PJ, Adack IM. Glucocorticoid resistance in inflammatory diseases[J]. Lancet, 2009, 373:1905.
13 李春林,罗英,杨春平,等. 糖皮质激素受体α和β与突发性聋治疗的相关性[J]. 中国耳鼻咽喉头颈外科,2011, 18:247.
14 戴艳红, 陆玲, 吴骎,等. PBMCs中糖皮质激素受体亚型与突发性聋预后相关性的初步分析[J]. 听力学及言语疾病杂志,2013, 21:32.
15 Ito K, Getting SJ, Charron CE. Mode of glucocorticoid actions in airway disease[J]. Scientific World Journal, 2006, 6:1750.
16 Adcock IM, Ford P, Ito K, et al. Epigeneticsand airways disease[J]. Respir Res, 2006, 7:21.
17 中华医学会耳鼻咽喉头颈外科学分会中华耳鼻咽喉头颈外科杂志编辑委员会.突发性聋的诊断和治疗指南(2005年,济南)[J]. 中华耳鼻咽喉头颈外科杂志, 2006, 41:325.
18 中国突发性聋多中心临床研究协作组. 中国突发性聋分型治疗的多中心研究[J].中华耳鼻咽喉头颈外科杂志,2013,48:355.
19 Mercado N, To Y, Ito K, et al. Nortriptyline reverses corticosteroid insensitivity by inhibition of phosphoinositide-3-kinase-delta[J]. J Pharmacol Exp Ther, 2011, 337:465.
20 Capaccio P, Pignataro L, Gaini LM, et al. Unbalanced oxidative status in idiopathic sudden sensorineural hearing loss[J]. Eur Arch Otorhinolaryngol, 2012, 269:449.
21 Yang CH, Ko MT, Peng JP, et al. Zinc in the treatment of idiopathic sudden sensorineural hearing loss[J]. Laryngoscope, 2011, 121:617.
22 Kassner SS, Schöttler S, Bonaterra GA, et al.Proinflammatory and proadhesive activation of lymphocytes and macrophages in sudden sensorineural hearing loss[J]. Audiol Neurootol,2011, 16:254.
23 Ito K, Hanazawa T, Tomita K, et al. Oxidative stress reduces histone deacetylase 2 activity and enhances IL-8 gene expression: role of tyrosine nitration[J]. Biochem Biophys Res Commun,2004, 315:240.
24 Tomita K, Barnes PJ, Adcock IM. The effect of oxidative stress on histone acetylation and IL-8 release[J]. Biochem Biophys Res Commun. 2003, 301:572.
25 Ito K, Ito M, Elliott WM, et al. Decreased histone deacetylase activity in chronic obstructive pulmonary disease[J]. N Engl J Med, 2005, 352:1967.
26 Lu L, Dai Y, Zhang X, et al., Relationship of glucocorticoid receptor expression in peripheral blood mononuclear cells and the cochlea of guinea pigs and effects of dexamethasone administration[J]. PLoS One,2013, 8:e56323.
27 Smith JV, Luo Y. Elevation of oxidative free radicals in Alzheimer's disease models can be attenuated by Ginkgo biloba extract EGb 761[J]. J Alzheimers Dis, 2003, 5:287.
