烟草连作对土壤微生物多样性及酶活性的影响
2014-06-12,,,,,,
, ,,,,,
(1.河南农业大学 植物保护学院,河南 郑州 450002;2.河南省许昌市烟草公司,河南 许昌 461000;3.河南省襄城县烟草公司,河南 襄城 452670)
我国耕地面积少,作物连作现象十分普遍。烟草是我国重要的经济作物,也是一种忌连作作物,但由于经济利益驱动烤烟连作在烟叶生产中十分普遍。烟草连作常导致烟株生长发育不良,品质及产量下降,抗病能力降低,土传病害加重[1-2]。
土壤微生物作为土壤有机质和养分转化与循环的动力,直接关系到土壤养分的有效性,对作物的正常生长发育起重要作用[3-4]。土壤微生物中以细菌的种类和数量最多[5],土壤细菌的多样性能够反映特定土壤环境的历史情况[6]。土壤酶来自微生物、植物和动物的活体或残体,通过催化土壤中的生化反应发挥重要作用,保持了土壤生物化学的相对稳定状态,其活性与土壤的理化性质和其他生物学特征紧密相关,是近年来土壤质量评估指标中必不可少的内容[7-9]。土壤蔗糖酶、淀粉酶 、纤维素酶广泛存在于土壤中,它们直接参与土壤有机质的代谢过程,与土壤肥力密切相关,是评价土壤肥力的重要指标之一,并能部分反映土壤生产力[10-13]。
研究试图利用常规方法结合PCR-DGGE技术,系统分析了烤烟连作对土壤细菌、真菌、放线菌数量和3种土壤酶活性的影响规律,以期为烟田土壤的可持续利用和克服连作障碍提供科学依据。
1 材料与方法
1.1 试验材料
试验土壤样品于2011年9月采自许昌市襄城县庾河村(GPS信息:33.99°N,113.56°E,H:113 m)连作1a-8a的21块烟田,其中烟草连作1a-6a土样各3个、连作8a土样3个,但没有采集到连作7a的土样。采样时遵循随机、等量、多点混合的原则,采用S形布点取样,每块田地取15个小样混合,土样取自0 ~ 20 cm深的耕层土,共3份平行样。一部分土样装入无菌纸袋,立即带回实验室,研磨过0.9 mm(20目)筛后于4 ℃冰箱保存,用于土壤微生物的分析;另一部分土样风干,用于测定土壤酶活性。采样烟田分布于相同的农业生态区域内,施肥和田间管理均按照当地烟草生产技术规程进行,烤烟品种均为中烟100。
1.2 试验方法
1.2.1土壤酶活性的测定。淀粉酶、蔗糖酶、纤维素酶活性的测定采用3,5-二硝基水杨酸比色法[14]。
1.2.2土壤微生物种群、数量的常规分离分析。菌分离采用1/10 TSA培养基,真菌分离采用PDA+Kana(卡那霉素0.005 mg·ml-1)培养基,放线菌分离采用高氏一号培养基。土壤细菌、真菌、放线菌的计数采用稀释涂抹平板法[15]。
1.2.3土壤样品DNA的提取。本实验室方法提取土壤样品总DNA,称取大约3 g土样于10 mL离心管中;加入6 mL TENP buffer(50 mmol·L-1Tris,20 mmol·L-1EDTA,100 mmol·L-1NaCl,0.01 g·mL-1PVPP,pH值10),涡旋震荡10 min,12 000 r·min-1离心5 min,弃去上清液;沉淀中加入6 mL PBS buffer(8 g NaCl,0.2 g KCl,1.44 g Na2HPO4,0.24 g KH2PO4,溶于1 L水,pH值7.4),涡旋震荡5 min,12 000 r·min-1离心5 min,弃去上清液,沉淀备用;将沉淀中加入3 mL土壤DNA提取液(100 mmol·L-1Tris·HCl,100 mmol·L-1EDTA,100 mmol·L-1磷酸钠缓冲液,1.5 mol·L-1NaCl,1%CTAB,2%CaCl,1 ug·mL-1BSA,pH值8.0),震荡混匀后置于超低温冰箱中冷冻15 min,65℃水浴5 min,然后充分反复冻融3次。向反复冻融的土壤中加入溶菌酶(100 mg·mL-1,50 uL)、蜗牛酶(20 mg·mL-1,100 uL),37℃水浴1 h,再加入2.0 mg(100 mg·Ml-1,吸取20 uL)蛋白酶K,37℃水浴30 min;加入500 uL裂解液(20%SDS),人工轻缓颠倒几次至液体变粘稠,65℃水浴1 h,12 000 r·min-1(4℃)离心5 min,收集上清液;将上清液中加入等体积的苯酚/氯仿/异戊醇(25∶24∶1),冰浴上人工晃动5min,取上清液;在上清液中加入0.5倍体积25%PEG8000,4℃放置2 h(或过夜沉淀);12 000 r·min-1(4℃)离心10 min,沉淀用75%乙醇洗涤2次,8 000 r·min-1( 4℃)离心5 min,沉淀室温晾干,根据DNA得量溶于60 uL~100 uL TE 缓冲液。
1.2.4细菌16S rDNA基因V3区的扩增。据NCBI数据库公开的细菌基因组16S保守序列设计了2对细菌通用引物,并进行巢式PCR扩增。其中第一轮PCR的引物对为Eubac 10F(5’-AGAGTTTGATCCTGGCTCAG-3’)和Eubac 1507R(5’-GGTTACCTTGTTACGACTT-3’),产物长度约为1.5 kbp。扩增反应体系25 ul,PCR反应条件:94℃预变性4 min;94℃ 50 s,52℃ 50 s,72℃ 1 min,28个循环;72℃总延伸10 min。第二轮扩增以第一轮PCR产物为模板,以细菌16S rDNA V3区引物对BV34F(5’-TCCGGATTTATTGGGCGTAAAGCGA-3’)和BV56GC(5’-CGCCCGCCGCGCCCCGCGCCCGGCCCGCCGCCCCCGCCCCTCGAATTAAACCACATGCTCCAGCAATTAAACCACATGCTCCA-3’),产物长度约为400 bp。第2轮PCR反应体系50 ul,PCR反应条件:94℃预变性4 min;94℃ 40 s,52℃ 45 s,72℃ 45 s,28个循环;72℃总延伸10 min。
1.2.5变性梯度凝胶电泳(DGGE)分析。GGE参数为:变性剂(尿素及去离子甲酰胺)梯度40%到60%,8%的聚丙烯酰胺凝胶。点样量为30 uL已浓缩PCR产物,电泳在60℃,1倍 TAE(pH 8.0)缓冲液,100V电压下进行10 h。电泳结束后在EB中染色15 min,并用BIO IMAGING(美国UVP GelDoc-It Imaging Systems)的凝胶成像系统拍照。
1.2.6数据处理与分析。验数据采用SPSS17.0统计分析软件进行数字化处理,并进行Duncan法方差分析;用Quantity One软件(Bio-Rad)对DGGE图谱进行数字化处理[16],按照如下公式计算多样性指数Shannon-Wiener指数、Simpson指数、McIntosh多样性指数[17]。其中:s——每泳道中的条带数量;Pi——泳道中第i条带灰度(height of the peak)占该泳道总灰度的比例;ni——泳道中第i条带灰度;N——每泳道中所有条带的总灰度。
Simpson指数:
Shannon-Wiener指数:
McIntosh多样性指数:
2 结果与分析
2.1 连作年限对土壤酶活性的影响
连作1 a-8 a土壤蔗糖酶活性整体呈现先升高后下降再略有回升的趋势,连作2 a时土壤蔗糖酶活性达到最大值,之后显著降低(p<0.01),并在连作第6 a达到最低,到第8 a又显著增加,见图1。此外,连作2 a、3 a蔗糖酶活性与其他连作年限相比差异达到极显著水平(p<0.01),而连作4 a、5 a和6 a的蔗糖酶活性并无显明差异,连作8 a蔗糖酶活性与连作5 a、6 a相比达到极限著差异(p<0.01)。

图1 不同连作年限土壤酶活性的变化Fig.1 The changes of soil enzyme activities during different continuous cropping years注:酶和淀粉酶标于主坐标轴,纤维素酶标于次坐标轴。
土壤淀粉酶活性呈先升高后降低的趋势,在连作2 a时达到最大值,与连作1a酶活性相比并无显著差异,但与其它连作年限相比差异达到显著水平(p<0.05);连作4 a-8 a的土壤淀粉酶活无显著性差异。
土壤纤维素酶活性在连作1 a-3 a时剧烈下降,连作1 a、2 a时的纤维素酶活性与其他连作年限相比存在显著差异(p<0.05);连作1 a时最高,连作年限达到3 a以后,土壤纤维素酶活性呈相对稳定状态。
2.2 不同连作年限的植烟土壤微生物学特征常规分离结果
土壤细菌数量随连作年限的延长,总体呈现减少的趋势,见图2;且连作1 a的烟田土壤细菌数量最多,与其他连作年限(连作5 a除外)有显著差异(p<0.05);连作5 a的细菌数量与连作3 a、6 a和8 a达到显著差异(p<0.05)。
从图2可以看出,土壤真菌随着连作年限的增加其数量变化趋势为升高-降低-升高-降低;连作3 a之前,土壤真菌数量逐渐增多,连作4 a、5 a数量有所增加,5 a之后再次减少。其中,连作3 a真菌数量与连作1 a和8 a达到显著差异(p<0.05);连作6 a与8 a达到显著差异(p<0.05)。
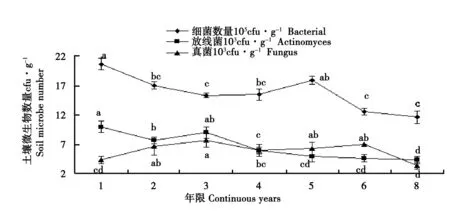
图2 不同连作年限土壤微生物数量的变化Fig.2 The changes of soil microbial number during different continuous cropping years
由图2可知,随着连作年限的延长,土壤放线菌数量总体上逐渐减少,其变化趋势与细菌相似,且连作3 a后,其数量显著下降,之后趋于平稳;试验结果表明,连作1 a、2 a和3 a放线菌数量接近同一水平,且与其他连作年限差异显著(p<0.05);连作4 a、5 a、6 a和8 a之间无显著性差异(p<0.05)。
2.3 不同连作年限土壤细菌的PCR扩增
细菌16S rDNA的第一轮PCR扩增条带亮度高,大小约为1 500 bp,阴性对照无条带,且无非特异性扩增,见图3。第二轮扩增的细菌V3区条带片段的大小约为400 bp,阴性对照无条带,且无非特异性扩增,见图4,能够满足进一步的DGGE分析要求。
2.4 不同连作年限烟田土样的细菌的DGGE分析
连作1 a-8 a的DNA泳道中条带的个数和亮度不一,说明不同连作年限土壤样品的细菌多样性不同,见图5。连作1 a-8 a的土样中多样性条带数量在11条~17条不等,且随着连作年限的延长,条带数逐渐减少。其中连作1 a的条带数最多,达到17条,连作8 a的条带数最少,只有11条,但连作5 a样品的条带数多于4 a和6 a样品,5 a后继续减少。说明土壤细菌丰富度(S)随植烟年限的增加呈下降趋势。
Shannon指数主要反映物种的丰富度,描述了土壤微生物群落功能多样性相对多度的信息。由表1可以看出,不同连作年限之间的土样的微生物的Shannon指数均存在极显著差异(p<0.01),且连作1 a、2 a其值较大,之后有降低的趋势,而到连作5a时,又有所上升。Simpson指数反映了群落中常见的物种多少。不同连作年限之间土样的微生物的Simpson指数均存在极显著差异(p<0.01)。Mcintosh多样性指数基于群落物种多维空间上的多样性指数。不同连作年限之间的土样的微生物的Mcintosh指数均存在极显著差异(p<0.01)。

图3 连作1 a-8 a土样细菌总DNA的第一轮PCR扩增结果Fig.3 The first round PCR amplification result of soil bacteria DNA during different continuous cropping years of 1-8注:M:DL 2000 DNA Marker;1 a-8 a分别表示连作1年- 8年的烟田土样;N:阴性对照
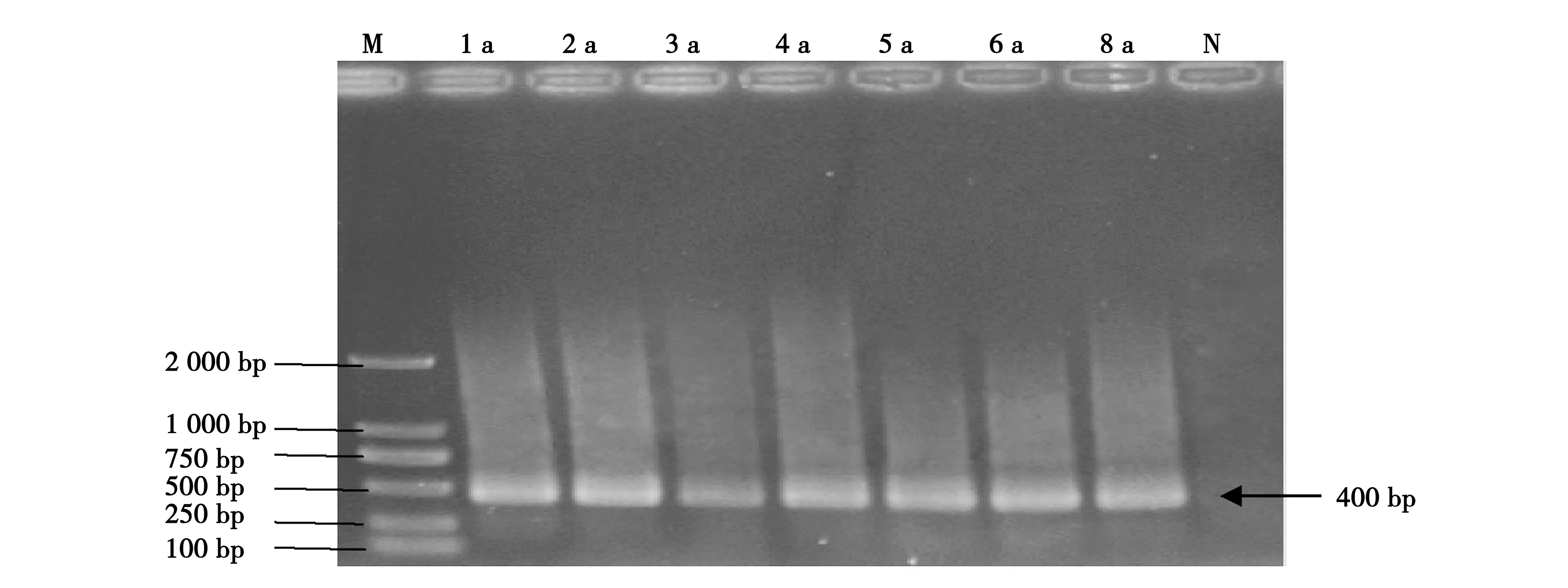
图4 连作1 a-8 a土样细菌总DNA的第二轮PCR扩增结果Fig.4 The second round PCR amplification result of soil bacteria DNA during different continuous cropping years of 1-8注:M:DL 2000 DNA Marker;1 a-8 a分别表示连作1年-8年的烟田土样;N:阴性对照
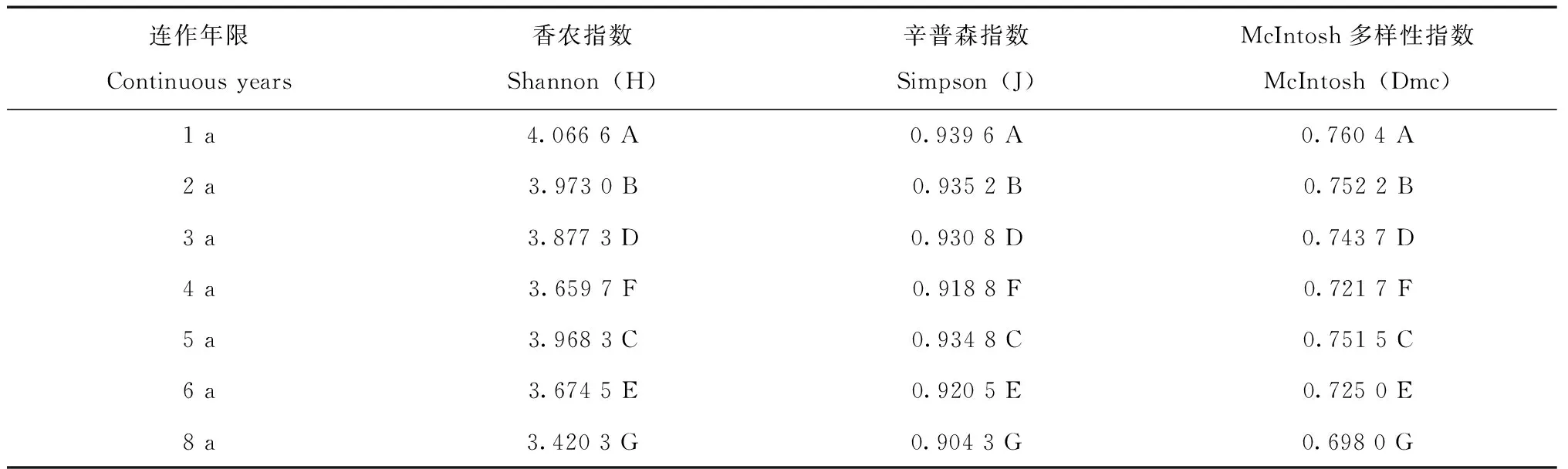
连作年限Continuous years香农指数Shannon(H)辛普森指数Simpson(J)McIntosh多样性指数McIntosh(Dmc)1 a4.066 6 A0.939 6 A0.760 4 A2 a3.973 0 B0.935 2 B0.752 2 B3 a3.877 3 D0.930 8 D0.743 7 D4 a3.659 7 F0.918 8 F0.721 7 F5 a3.968 3 C0.934 8 C0.751 5 C6 a3.674 5 E0.920 5 E0.725 0 E8 a3.420 3 G0.904 3 G0.698 0 G

图5 不同连作年限烟田土壤细菌群落V3区的DGGE指纹图谱Fig.5 The DGGE finger-print of soil microbial V3 area during different continuous cropping years注:1 a-8 a分别表示连作1年-8年的烟田土样
3 讨论与结论
土壤酶作为衡量土壤健康状况的一个必不可少的土壤微生物学指标之一,越来越受到人们的高度重视,许多研究者在连作对土壤酶影响方面也进行了很多研究。试验研究表明,短期连作(连作2 a-3 a)可使土壤淀粉酶和蔗糖酶活性升高;连作3 a以上时,两种酶活性显著下降,处于较低水平,与贾新民等[18]、何川等[19]的结果相似;而纤维素酶呈持续下降趋势,结果与胡汝晓等[20]研究结果一致。
土壤微生物在反映土壤质量状况上有较高的灵敏度,是近年来研究土壤健康状况不可或缺的生物学指标[21]。众多研究表明,连作可使土壤微生物数量和类群发生变化[22-24]。试验采用常规分离培养和分子技术两种手段,研究不同连作年限间土壤微生物多样性的变化。结果表明随着连作年限的延长土壤可培养微生物数量逐渐减少,其中细菌数量降低尤为明显,对连作表现出较高的敏感性,放线菌对连作反应稍滞后,至第3 a时开始呈现降低趋势,该结果与胡元森等[25]的研究结果极其相似;放线菌数量变化之所以较稳定,可能是由于放线菌与细菌相比,生长较慢、受农业技术措施的影响小也表现较慢的缘故[26]。而真菌数量的变化与与细菌数量变化村存在此消彼长的关系,与古战朝等[27]结果相似。总体上,随着连作年限的增加,土壤微生物种类和数量、土壤酶活性呈下降趋势,细菌和放线菌在微生物中所占的比例也呈下降趋势,而真菌所占比例有所上升。一方面可能是因为连作导致土壤中养分含量失衡,造成土壤贫瘠,更适宜真菌生长[28];另一方面可能是由于土壤根系分泌物抑制土壤微生物生长发育造成的,而细菌和放线菌对此反应较为敏感,真菌对此反应不太敏感,导致土壤微生物中真菌比例增加。
根据细菌16S rDNA的PCR-DGGE图谱中条带的位置和亮度的数字化结果计算了细菌群落结构多样性指标。连作1 a -8 a的条带数11条 ~ 17条不等,且随着植烟年限的延长,条带数逐渐减少,而到达5 a时条带数增加,5 a后减少。不同连作年限的变化规律相同,均随着连作年限的延长,土样的Shannon指数、Simpson指数和McIntosh多样性指数均在不断下降,而到第5 a又有所回升,之后继续下降,到第8 a降到最低。这与细菌的常规分离培养方法结果吻合。
烟草连作对土壤微生物数量的影响与对土壤酶活性的影响具有一致性。可能是由于烟草连作引起了土壤微生物主要类群发生定向改变,进而导致主要土壤酶活性的定向改变,这种改变将导致土壤生态系统中物质转化受到影响。
研究认为烟草连作年限应在3 a以下,此年限内土壤微生物的多样性和活性较高。
参考文献:
[1] 刘 方,卜通达,何腾兵.连作烤烟土壤养分变化分析[J].贵州农学院学报,1997,16(2),1-4.
[2] 晋 艳,杨宇虹,段玉琪,等.烤烟连作对烟叶产量和质量的影响研究初报[J].烟草科技,2002(1): 41-51.
[3] 章家恩,刘文高,王伟胜.南亚热带不同植被根际微生物数量与根际土壤养分状况[J].土壤与环境,2002,11(3),279-282.
[4] 柴 强,黄 鹏,黄商宝.间作对土壤微生物和酶活性的影响研究[J].草业学报,2005,14(5): 105-110.
[5] Whiting S N,De Souza M P,Terry N.Rhizosphere bacteria mobilize Zn for hyperaccumu1ation byThlaspicaerulescens[J].Environmental Science and Technology,2001,35(15): 3144-3l50.
[6] Kennedy A C.Bacterial diversity in agroecosystems[J].Agriculture,Ecosystems and Environment,1999,74(1-3): 65-76.
[7] 杨万勤,王开运.土壤酶研究动态与展望[J].应用与环境生物学报,2002,8(5): 564-570.
[8] 姚槐应,黄昌勇.土壤微生物生态学及其实验技术[M].北京: 科学出版社,2006.
[9] 刘恩科,赵秉强,李秀英,等.长期施肥对土壤微生物量及土壤酶活性的影响[J].植物生态学报,2008,32(1): 176-182.
[10] 刘旭辉,覃 珊,覃勇荣.不同植被对石漠化地区土壤纤维素分解酶活性的影响[J].中国农学通报,2010,26(18): 335-340.
[11] 严昶升.土壤肥力研究方法[M].北京: 农业出版社,1988.
[12] 张先蜿.土壤肥力研究进展[M].见: 中国土壤学会第三届土壤肥力学术讨论会文集.北京: 中国科学技术出版社,1991.
[13] 周世萍,段昌群,韩青辉,等.毒死蜱对土壤蔗糖酶活性的影响[J].生态环境,2005,14(5): 672-674.
[14] 关松荫.土壤酶及其研究法[M].北京: 农业出版社,1986.
[15] 中国科学院南京土壤研究所微生物室.土壤微生物研究法[M].北京: 北京科学出版社,1985.
[16] 姚 健,杨永华,沈晓蓉,等.农用化学品污染对土壤微生物群落DNA序列多样性影响研究[J].生态学报,2000,20(6): 1021-1027.
[17] 马克平,刘玉明.生物群落多样性的测度方法I α[J].生物多样性,1994,2(4): 231-239.
[18] 贾新民,于泉林,郑玉龙,等.大豆连作土壤酶与土壤微生物和基础肥力关系研究[J].现代化农业,1995(10): 3l-32.
[19] 何 川,刘国顺,李祖良,等.连作对植烟土壤有机碳和酶活性的影响及其与土传病害的关系[J].河南农业大学学报,2011,45(6):701-705.
[20] 胡汝晓,赵松义,谭周进,等.烟草连作对稻田土壤微生物及酶的影响[J].核农学报,2007,21(5): 494-497.
[21] 黎 宁,李华兴,朱凤娇,等.菜园土壤微生物生态特征与土壤理化性质的关系[J].应用生态学报,2006,17(2): 285-290.
[22] 陈文新.土壤与环境微生物学[M].北京: 北京农业大学出版社,1990.
[23] 刘芷宇.根际微域环境研究[J].土壤,1993,25(6): 225-230.
[24] 马云华,王秀峰,魏 珉,等.黄瓜连作土壤酸酚类物质积累对土壤微生物和酶活性的影响[J].应用生态学报,2005,16(11): 2149-2153.
[25] 胡元森,刘亚峰,吴 坤,等.黄瓜连作土壤微生物区系变化研究[J].土壤通报,2006,37(1): 126-129.
[26] 李仲强,谭周进,夏海鳌.耕作制度对土壤微生物区系的影响[J].湖南农业科学,2001(2): 24-25.
[27] 古战朝,习向银,刘红杰,等.连作对烤烟根际土壤微生物数量和酶活性的动态影响[J].河南农业大学学报,2011,45(5): 508-513.
[28] 刘训理,王 超,吴 凡,等.烟草根际微生物研究[J].生态学报,2006,26(2): 552-557.
