含硝酸盐水盐体系降温过程研究*
2014-06-11黄雪莉黄文婷任效京
张 霞,黄雪莉,黄文婷,任效京
(新疆大学化学化工学院石油天然气精细化工教育部和自治区重点实验室,新疆乌鲁木齐 830046)
硝酸钠是重要的化工原料。新疆是世界上天然硝酸盐矿巨量储存区,其开发利用意义很大[1]。新疆硝酸盐矿的开发工艺主要是:矿物溶解、盐田蒸发和强制蒸发、冷却结晶,其弊端之一是水消耗量大,这在干旱缺水的新疆盐湖地区是很大的问题。新疆冬季漫长寒冷,目前由于缺乏低温条件下进行盐湖资源开发利用的技术,漫长冬季的冷能没有得到充分的利用,而盐湖化工企业通常在冬季停工,导致开工率不足,影响了生产规模和经济效益。因此,充分利用新疆冬季低温能量,实现盐湖化学成分的无蒸发或小蒸发量分离,既可以获得目标产品,又在某种程度上淡化卤水,甚至可以获得淡水,对于新疆这样干旱缺水的地区意义重大。目前盐水体系低温相关系的研究多数集中于海水,直接研究卤水体系的工作很少。1906年W.E.Ringer[2]进行了海水冷冻的初步研究。 K.H.Nelson 等[3]和 T.G.Thompson 等[4]在 W.E.Ringer工作基础上,得到介稳平衡下的结晶路线。K.E.Gitterman[5]使用模拟海水进行了比较系统的冷冻实验,得到海水热力学平衡下的结晶路线。后面陆续有人在此基础上做了相关研究[6-7]。除了海水的冷冻实验研究,科研人员还研究了盐湖卤水低温淡化和含盐量较高废水的低温处理技术。高世扬等[8]研究了含硼浓缩盐卤在冷冻条件下析出的盐类。 张永生等[9]以西藏高原扎布耶盐湖冬季富锂卤水为对象,通过现场实验研究了该组成的卤水在一系列冷冻温度下的组成演变规律。乌志明等[10]进行了模拟卤水实验室冷冻和自然冷冻、自然冷冻和融化的对比实验。陈智晖等[11]用冷冻法处理Cl-质量浓度为1×103~1.5×104mg/L的模拟废水和钻井废水,冰相中的Cl-去除率可达90%左右。李青海等[12]研究了南翼山油田卤水低温结晶过程。目前,对新疆含硝酸盐卤水体系的低温相关系未见研究报道。笔者拟研究具有不同浓度特征的硝酸盐水盐体系在自然降温过程中液相组成及结晶规律的变化,并与人工降温过程进行对比,获得硝酸盐矿溶解后的水盐体系Na+∥Cl-,SO42-,NO3--H2O 的低温相变化规律, 进而为低温工艺开发提供基础数据和理论支持。
1 实验部分
1.1 实验试剂和仪器
配制实验样品所用NaCl、NaNO3、无水Na2SO4、FeSO4、AgNO3、BaCl2、H3PO4、浓 H2SO4、C12H10NNaO3S、K2CrO4、HCl、无水乙醇,均为分析纯;K2Cr2O7和标定AgNO3所使用NaCl为基准纯。
XTL-1型体视显微镜、X射线衍射仪等。
1.2 实验方法
1.2.1 实验体系的选择与配制
鉴于硝酸盐矿物溶解过程常在常温下进行,故以 25 ℃下 Na+∥Cl-,SO42-,NO3--H2O 体系相图[13]为依据,分别选取合适的实验点,研究当溶液处于NaCl、Na2SO4和 Na2SO4·NaNO3·H2O三盐共饱(1#点 ),NaCl、NaNO3和 Na2SO4·NaNO3·H2O 三 盐 共 饱(2# 点),NaCl和 Na2SO4两盐共饱 (3# 点),Na2SO4和 Na2SO4·NaNO3·H2O 两盐共饱(4#、5# 点),NaNO3和 Na2SO4·NaNO3·H2O 两盐共饱(8# 点),NaCl饱和(6#、7#点)时,降温对其液相组成和结晶的影响,具体点见图1。
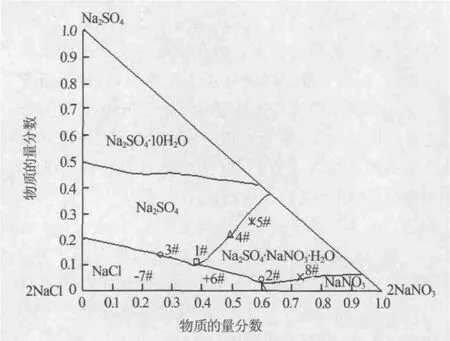
图1 实验点设置图
1.2.2 实验体系自然降温实验研究
按表1配置溶液500 g左右。先加入硫酸钠,然后依次加入氯化钠、硝酸钠。当不能完全溶解时,稍微进行加热,置于500 mL烧杯中放到自然环境下进行降温,每隔15 min搅拌一次,并测温。分别在温度降到 5、0、-5、-10、-15℃左右用取样管取 10 mL 左右的上清液,称量后稀释到250 mL待分析,并分离固相进行鉴定。

表1 实验样品的组成
1.2.3 人工降温实验研究
为了比较自然降温与人工降温的差距,选取并配置表1中2#与3#实验体系,将其放入温度恒为-25℃左右的冰箱中,与自然降温方法做同样的研究。
1.3 化学分析方法
Cl-用硝酸银容量法测定、SO42-用硫酸钡重量法测定、NO3-用重铬酸钾氧化法测定,偏差小于0.4%;Na+用差减法测定。固相鉴定采用物料衡算、体视显微镜、X射线晶体衍射法综合进行。
2 结果与讨论
2.1 实验结果
2.1.1 卤水自然降温实验研究结果
实验体系在自然降温过程中的液相组成数据列于表2,同表列出Janecke相图指数值,并据此绘制出图2、图3。由表2、图2和图3并结合固相鉴定可知以下几点。
1)随着温度的降低,Na2SO4·10H2O 的结晶区扩大, 复盐 Na2SO4·NaNO3·H2O 和 Na2SO4的结晶区缩小至消失,NaCl、NaNO3的结晶区变化不大。
2)对于在25℃时NaCl和Na2SO4两盐共饱的卤水(3#),降温至-15 ℃过程中 Na2SO4·10H2O 和NaCl始终处于饱和析出状态,不过Na2SO4·10H2O析出是由于其溶解度受温度影响很大,而NaCl析出是由于Na2SO4·10H2O析出后水量减少导致,因为NaCl溶解度受温度影响不大。
3)对于在 25 ℃时 Na2SO4和复盐 Na2SO4·NaNO3·H2O 两盐共饱的卤水(4#、5#),降温至-10℃左右的过程中只有Na2SO4·10H2O析出,究其原因是低温下复盐Na2SO4·NaNO3·H2O和Na2SO4的结晶区缩小至消失,Na2SO4·10H2O 结晶区扩大。
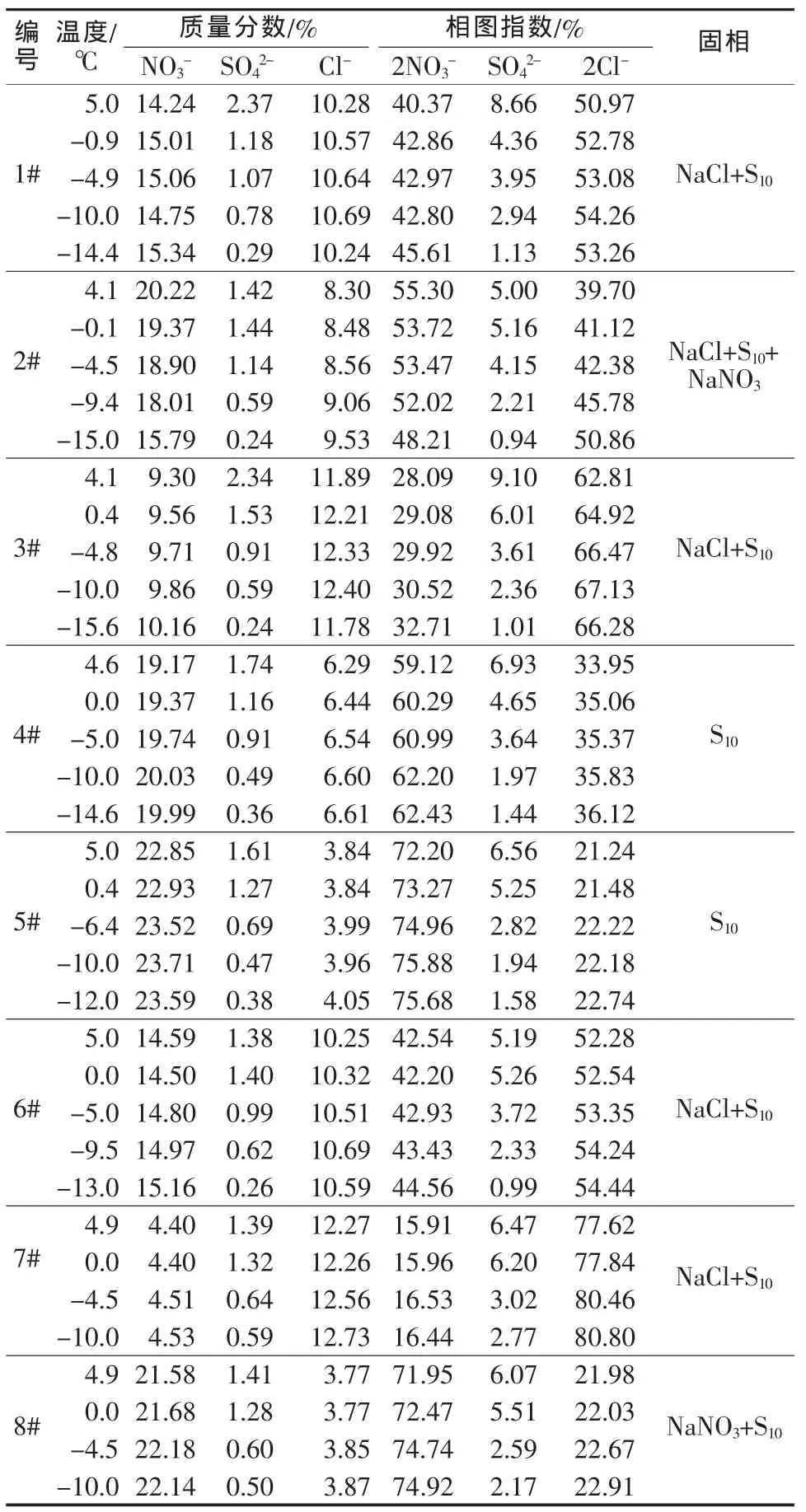
表2 含硝酸盐卤水体系自然降温过程液相组成

图2 3#—8#实验体系自然降温过程中液相组成变化

图3 1#、2#实验体系降温过程中液相组成变化
4)对于在 25 ℃时 NaNO3和复盐 Na2SO4·NaNO3·H2O两盐共饱的卤水(8#),降温至-10℃左右的过程中,NaNO3和 Na2SO4·10H2O 始终饱和析出,NaCl一直处于不饱和状态。
5)对于在25℃时处于NaCl饱和区的卤水(6#、7#),6#、7#分别降至-13℃和-10℃,Na2SO4未析出。
6)对 于 在 25 ℃时 NaCl、Na2SO4和 Na2SO4·NaNO3·H2O三盐共饱的卤水(1#),降温至-14℃过程中,由于复盐Na2SO4·NaNO3·H2O和Na2SO4的结晶区缩小至消失,该点落入Na2SO4·10H2O结晶区,不再是三盐共饱,Na2SO4·10H2O析出,同样由于水量减少NaCl也析出。
7)对于在 25℃时 NaCl、NaNO3和 Na2SO4·NaNO3·H2O三盐共饱的卤水(2#),由于是同组成共饱点,一般来说三盐始终共饱,依据笔者对5℃和0℃的平衡相图的初步研究推断,液相组成向图3中的左下方移动,但由于降温过程处于不平衡状态,液相组成的变化取决于三盐析出的速度。由于NaNO3的溶解度受温度影响大,故降温初期析出速度快,致使液相组成向图3的左上方移动,随后随着Na2SO4·10H2O的析出,液相组成向图3的左下方移动。
2.1.2 人工降温实验研究结果
2#、3#实验体系的人工降温实验数据列于表3中,同时对自然降温与人工降温过程中液相中各离子含量的变化进行对比。2#实验体系液相中Cl-、含量的变化见图 4。
由表3、图4并结合固相鉴定可知以下几点。
1)对于人工降温的2#实验体系,由于NaCl的溶解度受温度的影响较小,因而两种情况下NaCl几乎无差别;NaNO3无论是溶解或析出都是快速的过程,因而降温速率对其影响也较小;Na2SO4的溶解与析出则是相对较缓慢的过程,所以降温速率对其影响较大,人工降温速率要大于自然降温,Na2SO4·10H2O的析出滞后。3#实验体系的情况与2#基本一致。
2)固相鉴定研究可知,自然降温与人工降温的结晶规律基本一致。

表3 含硝酸盐卤水体系降温过程液相组成(人工降温)

图4 2#实验体系液相中Cl-、NO3-、SO42-含量的变化
3 结论
1)随着温度的降低,Na2SO4·10H2O 的结晶区扩大, 复盐 Na2SO4·NaNO3·H2O 和 Na2SO4的结晶区缩小至消失,NaCl、NaNO3的结晶区变化不大。2)常温下处于不同盐类饱和状态下的溶液,降温过程中将出现不同的结晶路线。3)对于 NaCl、NaNO3和Na2SO4·NaNO3·H2O 三盐共饱的卤水,随着温度的降低,三盐始终饱和并析出,但液相组成变化由3种盐的结晶速率共同决定。
[1]邱斌,宋文杰,葛文胜,等.新疆硝酸盐资源状况及其开发利用前景[J].资源与产业, 2009,11(3):55-58.
[2]Ringer W E.De verande ringen in sam enstelling van zeewater bij het bevriezen[J].Chem.Weekblad,1906(3):223-249.
[3]Nelson K H,Thompson T G.Deposition of salts from sea water by frigid concentration[R].Seattle:Office of Naval Research,University of Washington Department of Oceanography,1977:1-30.
[4]Thompson T G,Nelson K H.Concentration of brines and deposition of salts from sea water under frigid conditions[J].Amer.J.Sci.,1956,254(4):227-238.
[5]Gitterman K E.Thermal analysis of sea water[R].Hanover:Cold Regions Research and Engineering Laboratory,1937.
[6]Marion G M,Farren R E,Komrowski A J.Alternative pathways for seawater freezing[J].Cold Regions Science and Technology,1999,29(3):259-266.
[7]Spencer R J,Meller N,Weare H J.The prediction of mineral solubilities in natural waters:a chemical equilibrium model for the Na+-K+-Ca2+-Mg2+-Cl--SO42--H2Osystemattemperatures below 25 ℃[J].Geochimica et Cosmochimica Acta,1990,54(3):575-590.
[8]高世扬,赵金福,薛方山.含硼氯化镁饱和卤水的冷冻实验[J].盐湖研究,1998,6(1):1-10.
[9]张永生,乜贞,卜令忠,等.富锂碳酸盐型卤水在系列冷冻温度下组成演变[J].海湖盐与化工,2001,30(1):3-6.
[10]乌志明,邓小川.盐水冷冻淡化研究[J].无机盐工业,2001,33(2):6-8.
[11]陈智晖,陈集,周小燕,等.用冷冻法浓缩分离废水中氯离子的试验[J].内蒙古石油化工,2005(10):1-2.
[12]李青海,顾同欣,于升松,等.南翼山油田卤水低温结晶过程研究[J].物理化学学报, 2011,27(8):1803-1808.
[13]蔺尾燕,薄文旻,李惠,等.25℃及 50℃下,四元体系介稳相平衡研究[J].高校化学工程学报,2011,25(3):376-380.
