辛伐他汀对兔股动脉球囊损伤后内膜增生和平滑肌细胞增殖的影响
2014-06-09梁刚柱张福先刘勇
梁刚柱,张福先,刘勇
·实验研究Experimental research·
辛伐他汀对兔股动脉球囊损伤后内膜增生和平滑肌细胞增殖的影响
梁刚柱,张福先,刘勇
目的评价辛伐他汀对兔股动脉球囊损伤后血管狭窄和平滑肌细胞增殖的影响。方法将24只雄性新西兰兔随机分为假手术组、动脉狭窄模型组和辛伐他汀组,每组8只。除假手术组外,其余两组行股动脉球囊损伤,辛伐他汀组给予辛伐他汀灌胃干预。术后第14天处死实验兔,取出血管标本,处理后行HE染色观察组织病理变化。计算机病理图像分析系统测量动脉管腔、内弹力层、外弹力层围绕面积,计算内膜、中膜面积和内膜/中膜面积比值,免疫组化法检测动脉壁增殖细胞核抗原(PCNA)表达,观察平滑肌细胞增殖情况。结果与动脉狭窄模型组相比,辛伐他汀组血管管腔面积增加,但差异无统计学意义(P=0.057),新生内膜面积显著减少(P=0.006),内膜/中膜面积比值降低,但差异无统计学意义(P=0.16),血管壁PCNA的阳性表达指数显著降低(P=0.003)。结论辛伐他汀可以显著抑制兔股动脉球囊损伤后内膜增生和平滑肌细胞增殖。
股动脉;球囊损伤;辛伐他汀;动物实验
目前,经皮腔内血管成形术(percutaneous transluminal angioplasty,PTA)是治疗外周动脉硬化闭塞症(peripheral arterial occlusive disease,PAOD)的有效方法。但是术后管腔再狭窄影响了其远期疗效,有报道显示下肢动脉PTA术后1年再狭窄率达40%~60%[1-2]。PTA后血管内皮细胞损伤和脱落,诱发血管平滑肌细胞(VSMC)大量增殖并向内膜迁移引起内膜增生以及血管重构,是PTA术后再狭窄的主要病理机制[3]。既往研究表明他汀类药物在动脉系统中有不依赖其降脂作用的促动脉内皮修复和预防动脉粥样硬化、预防动脉血栓形成的作用[4-5],但对他汀类药物在预防外周动脉PTA术后再狭窄的作用研究较少[6]。我们通过建立兔股动脉球囊损伤模型,观察辛伐他汀对该模型血管管腔狭窄程度、内膜增生程度以及VSMC增殖的影响,探讨其在防止PTA术后血管再狭窄形成中的作用及机制。
1 材料与方法
1.1 实验动物及分组
选用体重2.5~3.5 kg的雄性新西兰兔24只(购自北京维通利华实验动物有限公司),分笼饲养。将24只兔随机分为假手术组、动脉狭窄模型组和辛伐他汀组,每组8只。辛伐他汀组给予辛伐他汀粉剂与蒸馏水配成的溶液,以3 mg·kg-1·d-1灌胃,假手术组和模型组给予等量蒸馏水灌胃。三组均喂养至2周末取材。
1.2 建立血管损伤动物模型
用5%戊巴比妥钠(30mg/kg)耳缘静脉麻醉后,解剖暴露兔右侧股动脉远端达腘动脉,在腘动脉远端结扎,阻断近端,之间作一长约0.5 cm的切口,向近端送入3 F Forgarty球囊导管达髂动脉,深入约10 cm,向球囊内注入生理盐水,维持压力,缓慢回拉球囊至平切口处,回抽球囊内液体维持负压,再将导管送至原处,重复上述过程5次,使血管内皮充分剥脱。退出导管,缝合切口。术后每天肌注青霉素80万u,连续3 d。假手术组不插入球囊,余步骤同上。
1.3 检测方法
于术后第14天处死动物,小心取出模型段血管(球囊损伤的股动脉全程),迅速置于4%多聚甲醛中固定,然后取材,逐级脱水、石蜡包埋。
1.3.1 血管管腔病理形态学检测将石蜡包埋标本5μm厚切片用苏木精-伊红(HE)染色后摄像,用MiE V2.0图像分析系统分别测量管腔面积、内弹力层围绕面积和外弹力层围绕面积,以毫米2(mm2)表示。通过以上测定结果,计算新生内膜面积、中膜面积以及新生内膜/中膜面积比值,每次测量3次,取平均值。具体计算方法如下:新生内膜面积=内弹力层围绕面积-管腔面积;中膜面积=外弹力层围绕面积-内弹力层围绕面积;新生内膜/中膜面积比值=新生内膜面积/中膜面积。
1.3.2 免疫组化检测增殖细胞核抗原(PCNA)表达将石蜡包埋标本于不同切面切3张5μm厚切片,置于载玻片(均经APES防脱片处理)上,抗PCNA抗体为I抗,阳性对照用人乳腺癌切片,阴性对照用PBS缓冲液代替I抗,进行免疫组化染色。PCNA表达评定方法:PCNA阳性细胞的胞核染成棕黄色,高倍镜(200倍)采集图像,利用图文分析系统随机测量每张切片中3个视野,计数内膜细胞中阳性细胞数,计算PCNA阳性细胞百分率,取其均值。
1.4 统计学处理
2 结果
2.1 三组血管管腔形态、面积比较
光镜下,假手术组右侧股动脉内弹力层内侧为一层蓝染的内皮细胞覆盖,内弹力层完整,呈卷曲“城墙状”,动脉壁各层结构完整,中膜VSMC呈梭型,排列整齐,分布均匀,外弹力层完整。动脉狭窄模型组内膜增生严重,向腔内呈丘状隆起,可见大量VSMC排列紊乱,内弹力层轻度拉伸,形态不规则。与动脉狭窄模型组相比,辛伐他汀组内膜增生程度较轻,管腔较光滑,内膜中VSMC均较少,见图1。
与动脉狭窄模型组相比,辛伐他汀组血管管腔面积增加,但差异无统计学意义(P=0.057,表1)。
与动脉狭窄模型组相比,辛伐他汀组血管管腔面积、内弹力层围绕面积和外弹力层围绕面积无明显增加(表1)。
与动脉狭窄模型组相比,辛伐他汀组新生内膜面积减少,差异有统计学意义(P=0.006),内膜/中膜面积比值减小,但差异无统计学意义(P= 0.16),见表1。
2.2 免疫组化染色形态学观察PCNA表达

图1 三组血管管腔形态(HE,×200)
表1 三组血管管腔面积、内/外弹力层围绕面积、新生内膜面积、中膜面积、内膜/中膜面积比值比较(±s)
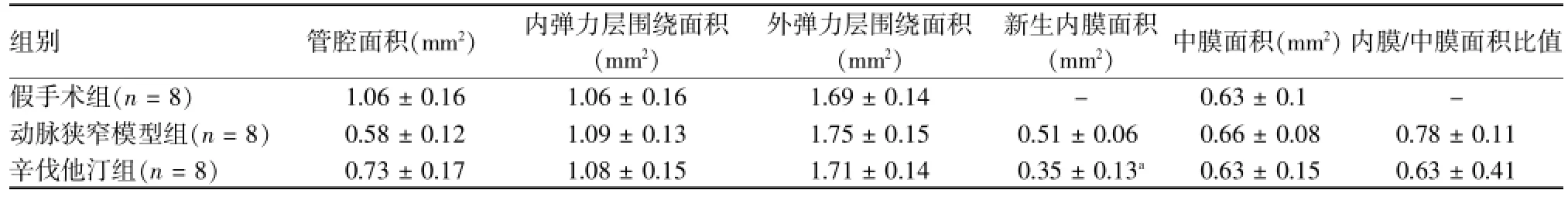
表1 三组血管管腔面积、内/外弹力层围绕面积、新生内膜面积、中膜面积、内膜/中膜面积比值比较(±s)
与动脉狭窄模型组比较,aP<0.05
组别管腔面积(mm2)内弹力层围绕面积(mm2)外弹力层围绕面积(mm2)新生内膜面积(mm2)中膜面积(mm2)内膜/中膜面积比值假手术组(n=8)1.06±0.16 1.06±0.16 1.69±0.14-0.63±0.1-动脉狭窄模型组(n=8)0.58±0.12 1.09±0.13 1.75±0.15 0.51±0.06 0.66±0.08 0.78±0.11辛伐他汀组(n=8)0.73±0.17 1.08±0.15 1.71±0.14 0.35±0.13a0.63±0.15 0.63±0.41
镜下观察,PCNA阳性细胞的胞核染成棕黄色。正常动脉管壁PCNA表达极少或无表达。各实验组PCNA阳性细胞主要聚集在新生内膜,中膜表达极少或无表达。
2.2.1 PCNA阳性指数比较与假手术组相比,动脉狭窄模型组与辛伐他汀组新生内膜中VSMC细胞有不同程度的PCNA表达,辛伐他汀组PCNA阳性细胞指数(17.25±6.88)小于动脉狭窄模型组(33.78±7.87),差异有统计学意义(P=0.003),见图2。
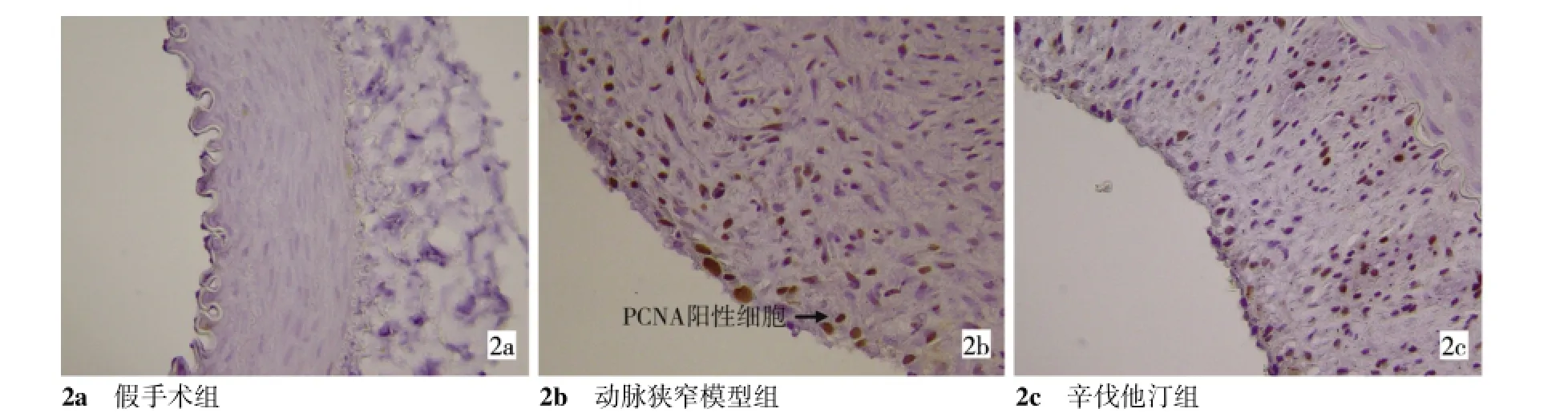
图2 三组PCNA表达(免疫组化,×200)
3 讨论
目前,抗血小板药物是预防PTA术后再狭窄的主要手段,其机制在于抗血小板药物可以抑制血小板活化引起的内膜增生,ACCP指南第9版推荐外周动脉PTA术后长期使用阿司匹林或氯吡格雷预防再狭窄[7]。虽然,抗血小板药物可以降低再狭窄的发生,但是再狭窄依然是制约PTA治疗效果的瓶颈。PTA术后再狭窄的机制复杂,涉及血管内皮细胞损伤、VSMC增殖和迁移及血管重构等多个方面。在血管损伤局部,活化的血小板、炎性细胞产生很多促细胞分裂剂和细胞因子,刺激中膜VSMC增殖、迁移及表型转变,分泌细胞外基质,胶原沉积,导致内膜增生,发生管腔再狭窄[3]。
既往研究发现,他汀类药物除降低血胆固醇外,还具有抗炎、改善内皮功能及舒张血管降压、抑制血管平滑肌的迁移和增生、抑制血小板聚集及抗凝等作用[4-5,8-10],提示其在预防PTA术后再狭窄中有潜在的应用前景。Kappert等[11]发现他汀类药物可以增加大鼠颈动脉球囊损伤后血管腔面积,但是新生内膜面积、内膜/中膜面积比值与模型组相比差异无统计学意义。van der Harst等[12]在大鼠主动脉内植入支架,喂养瑞舒伐他汀的实验组大鼠主动脉新生内膜面积较对照组减少23%[(0.66±0.06)mm2比(0.51±0.02)mm2,P<0.05],并证实其机制与瑞舒伐他汀保护内皮功能有关。Preusch等[13]从PTA术后血管重构角度研究他汀类药物在抑制内膜增生中的作用,发现在球囊扩张损伤颈动脉大鼠模型中瑞舒伐他汀可以显著抑制内膜增生,但该机制与瑞舒伐他汀对细胞基质金属蛋白酶-9(MMP-9)表达的影响无关。翟国君等[14]发现,他汀类药物可以减少犬静脉人工血管桥内膜增生。Lin等[15]研究发现,辛伐他汀可以抑制兔肿瘤坏死因子-α诱导的白细胞介素-18的表达,抑制兔主动脉VSMC增殖。Janardhanan等[16]研究发现,辛伐他汀可以降低动静脉瘘术后血管内皮生长因子-A(VEGF-A)和MMP-9的基因表达,抑制血管内膜增生和血管重构。赵钢等[17]研究发现,载有他汀类药物的纳米粒子涂层支架可抑制支架内再狭窄。以上研究提示他汀类药物确实可以抑制PTA术后的内膜增生,其机制涉及内皮功能的保护、抑制血管重构、抑制VSMC增殖等内膜增生的多个环节。本研究发现球囊损伤血管后,动脉狭窄模型组内膜增生明显,给予辛伐他汀干预后,新生内膜面积明显减少,提示辛伐他汀可有效抑制球囊损伤后VSMC增殖和内膜增生。本研究从VSMC增殖角度研究其相关机制,选用PCNA的表达观察VSMC增殖情况。PCNA的高表达提示细胞内DNA合成反应旺盛,是S期细胞的良好标志物,是评价细胞增生的良好指标。本研究发现动脉狭窄模型组新生内膜VSMC中PCNA呈高表达,而辛伐他汀组中PCNA阳性指数减少,提示他汀类药物可以通过抑制VSMC增殖抑制PTA术后的内膜增生。本实验改进了目前常用的兔颈动脉球囊损伤模型,采用兔股动脉球囊损伤狭窄模型,在球囊损伤股动脉全程后,结扎腘动脉,其流出道由隐动脉代偿,临床上更接近于下肢动脉病变流出道少的特点。
本研究结果证实他汀类药物可以抑制兔股动脉球囊损伤后的VSMC增殖和内膜增生,提示他汀类药物对于下肢动脉PTA术后再狭窄的防治具有潜在的临床应用前景,但其在预防外周动脉PTA术后再狭窄中的具体机制还需进一步深入研究。
[1]Schillinger M,Exner M,M lekusch W,et al.Restenosis after femoropopliteal PTA and elective stent implantation:predictive value ofmonocyte counts[J].JEndovasc Ther,2003,10:557-565.
[2]Siracuse JJ,Giles KA,Pomposelli FB,et al.Results for primary bypass versus primary angioplasty/stent for intermittent claudication due to superficial femoral artery occlusive disease[J].JVasc Surg,2012,55:1001-1007.
[3]Schwartz RS,Henry TD.Pathophysiology of coronary artery restenosis[J].Rev Cardiovasc Med,2002,3(supp l 5):S4-S9.
[4]Owens CD.Statinsand other agents for vascular inflammation[J]. JVasc Surg,2012,56:1799-1806.
[5]Antonopoulos AS,Margaritis M,Shirodaria C,etal.Translating the effects of statins:from redox regulation to suppression of vascular wall inflammation[J].Thromb Haemost,2012,108:840-848.
[6]A li FN,Carman TL.Medical management for chronic atherosclerotic peripheral arterial disease[J].Drugs,2012,72:2073-2085.
[7]Alonso-Coello P,Bellmunt S,McGorrian C,et al.Antithrombotic therapy in peripheral artery disease:Antithrombotic Therapy and Prevention of Thrombosis,9th ed:American College of Chest Physicians Evidence-Based Clinical Practice Guidelines[J]. Chest,2012,141:e669S-e690S.
[8]Korybalska K,Kawka E,Breborowicz A,etal.Atorvastatin does not impair endothelial cellwound healing in an in vitromodel of vascular injury[J].JPhysiol Pharmacol,2012,63:389-395.
[9]Ewa D,Michael HD.A review of lipid management in primary and secondary prevention[J].JCardiopulm Rehabil Prev,2009,29:2-12.
[10]Zhou Q,Liao JK.Statins and cardiovascular diseases:from cholesterol lowering to p leiotropy[J].Curr Pharm Des,2009,15:467-478.
[11]Kappert K,Leppänen O,Paulsson J,et al.Highly active antiretroviral therapy attenuates re-endothelialization and alters neointima formation in the rat carotid artery after balloon injury[J].JAcquir Immune Defic Syndr,2006,43:383-392.
[12]van der Harst P,Groenewegen HC,Roks AJ,et al.Rosuvastatin attenuates angiotensinⅡ-induced neointimal formation after stent imp lantation in the rat[J].Coron Artery Dis,2008,19:47-53.
[13]Preusch MR,Vanakaris A,Bea F,et al.Rosuvastatin reduces neointima formation in a ratmodel of balloon injury[J].Eur J Med Res,2010,15:461-467.
[14]翟国君,姚伟娟,贾子昌,等.静脉人工血管桥内膜增生的形态学特征及洛伐他汀的干预作用[J].北京大学学报:医学版,2012,44:783-787.
[15]Lin YC,Chiang CH,Chang LT,et al.Simvastatin attenuates the additive effects of TNF-αand IL-18 on the connexin 43 upregulation and over-proliferation of cultured aortic smoothmuscle cells[J].Cytokine,2013,62:341-351.
[16]Janardhanan R,Yang B,Vohra P,et al.Simvastatin reduces venous stenosis formation in a murine hemodialysis vascular accessmodel[J].Kidney Int,2013,84:338-352.
[17]赵钢,朱伟,陆志刚,等.载有匹伐他汀的纳米涂层支架的研究[J].介入放射学杂志,2012,21:486-491.
The effects of sim vastatin on in timal hyperp lasia and vascular smooth m uscle cell proliferation of balloon-injured fem oral ar tery in experimental rabbits
LIANG Gang-zhu,ZHANG Fu-xian,LIU Yong. Department of Vascular Surgery,Beijing Shijitan Hospital,Capital Medical University,Beijing 100038,China
ZHANG Fu-xian,E-mail:zhangfuxian@yahoo.com
ObjectiveTo evaluate the effects of simvastatin on vascular stenosis and vascular smooth muscle cell(VSMC)proliferation of balloon-injured femoral artery in experimental rabbits.MethodsA total of 24 male New Zealand white rabbits were random ly and equally divided into three groups:the sham group(n=8),the artery stenosismodel group(n=8)and the simvastatin group(n=8).Femoral artery stenosis was induced by injurieswith balloon in both themodel group and the simvastatin group,except for the sham group.The rabbits in simvastatin group were fed with simvastatin.The rabbitswere sacrificed on the 14th day after operation,and the femoral arteries were removed and sent for the pathological exam ination.The internal elastic lamina,external elastic lamina and luminal areasweremeasured.Then the areas of intima,media and the intima-to-media ratio were calculated.In order to observe the proliferation of VSMC,proliferating cell nuclear antigen(PCNA)expression of arterialwallwas tested and observed by immunohistochemistrymethod. Results In comparison with the model group,the average luminal area of the simvastatin group was increased although the differencewas not statistically significant(P=0.057).The area of intima of simvastatin group was decreased(P=0.006),and the intima-to-media ratio was notably decreased,but the difference was of no statistic significance(P=0.16).The PCNA expression of arterial wall was remarkably decreased(P=0.003).ConclusionSimvastatin can effectively inhibit the intimal hyperplasia and the vascular smooth muscle cell proliferation of balloon-injured femoral artery in experimental rabbits.(J Intervent Radiol,2014,23:50-53)
femoral artery;balloon injury;simvastatin;animal experiment
R543.5
B
1008-794X(2014)-01-0050-04
2013-07-02)
(本文编辑:侯虹鲁)
10.3969/j.issn.1008-794X.2014.01.014
100038北京首都医科大学附属北京世纪坛医院血管外科(梁刚柱、张福先),超声科(刘勇)
张福先E-mail:zhangfuxian@yahoo.com